(NH4)2S2 O8 氧化载金黄铁矿规律及E⁃pH 研究①
李国辉, 唐 云,2, 支永祥, 李 帅, 李宜昌, 杨典奇
(1.贵州大学 矿业学院,贵州 贵阳 550025; 2.贵州省非金属矿产资源综合利用重点实验室,贵州 贵阳 550025)
黄铁矿是金、银等贵金属的主要载体[1],在微细浸染型金矿床中,金以微细颗粒被黄铁矿等矿物包裹,难以直接浸出,需要经过预处理才能有效提高金浸出率[2-3]。 目前常见的预处理方法有焙烧氧化、加压氧化、生物氧化、化学氧化、超细磨等,其中化学氧化法因其适用性广、氧化速度快效果好、对环境友好等优点,成为研究的热点[4-6]。 相关研究结果表明,化学氧化法预处理可有效提高微细浸染型金矿金浸出率[7-9]。 本文采用(NH4)2S2O8作为氧化剂,研究热活化和FeSO4活化对黄铁矿氧化浸出的影响规律,并绘制FeS2⁃(NH4)2S2O8⁃H2O 体系E⁃pH 图,系统分析黄铁矿在(NH4)2S2O8体系中各物质的转换情况。
1 试 验
1.1 试验样品
试验用黄铁矿购于安徽省铜陵市威特矿产品销售有限公司。 手选富含黄铁矿矿石,经破碎、筛分至-2 mm,然后用摇床重选获取黄铁矿纯矿物,再低温烘干,使用振动磨将所得纯矿物磨矿至-0.075+0.045 mm 粒级,混匀、缩分、密封装袋保存,备用。 制得的黄铁矿纯矿物Fe、S 质量分数分别为42.18%和50.26%,纯度90.61%。
1.2 试验方法
采用磁力搅拌器进行黄铁矿浸出试验。 将配制好的浸出液加入反应容器中,启动磁力搅拌器进行加热,当浸出液达到设定温度时,加入-0.075+0.045 mm 粒级黄铁矿矿样,500 r/min 条件下搅拌浸出。 试验开始后,取样时间间隔为1 h。 每次取样3 mL,取样后补充3 mL 初始浸出液。 所取浸出液样品立即过滤、稀释,利用紫外可见分光光度计分析全铁浓度,计算黄铁矿中全铁浸出率。
2 结果与讨论
2.1 热活化(NH4)2S2O8 高级氧化体系对黄铁矿浸出的影响
2.1.1 (NH4)2S2O8浓度对黄铁矿浸出的影响
黄铁 矿 浓 度10 g/L、 温 度70 ℃时, 探 究 了(NH4)2S2O8浓度对黄铁矿浸出的影响,结果如图1 所示。 从图1 可以看出,适当增加(NH4)2S2O8浓度有利于黄铁矿浸出,(NH4)2S2O8浓度由0.219 mol/L 增至0.395 mol/L 时,黄铁矿浸出率由47.80%提高到73.71%。这是因为(NH4)2S2O8浓度增加,溶液中SO4-·和S2O8 2-浓度提高,从而提高溶液的氧化能力。 但(NH4)2S2O8浓度不宜过高,否则氧化能力反而下降。
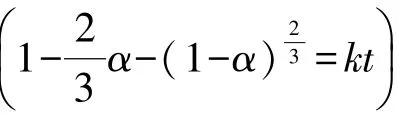
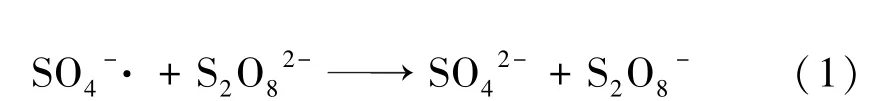
从图1 还可知,随着时间增加,黄铁矿浸出率随之上升。 反应起始阶段,黄铁矿浸出速率较快,随着时间增加,浸出速率逐渐下降,当浸出时间达到7 h 后,黄铁矿浸出率基本不变。 反应开始阶段,溶液中(NH4)2S2O8浓度较大,产生大量SO4-·,随着浸出时间增加,溶液中SO·浓度逐渐降低,导致浸出液氧化能力逐渐降低,因此黄铁矿浸出速率随浸出时间增加逐渐下降。
2.1.2 浸出温度对黄铁矿浸出的影响
黄铁矿浓度10 g/L、(NH4)2S2O8浓度0.395 mol/L,考察了浸出温度对黄铁矿浸出的影响,结果如图3 所示。温度对黄铁矿浸出影响较大,浸出时间8 h 时,70 ℃时浸出率为73.71%,比30 ℃时的浸出率(23.15%)提高了44.56 个百分点。 相同浸出时间下,温度高时的浸出率总是比温度低时的浸出率大,这是由于温度对引发S2O产生SO·的影响较大,温度越高,通过热激活引发产生SO·的速率就越快,相同时间内,浸出温度越高黄铁矿中铁浸出率就越大。对黄铁矿在不同温度条件下的浸出动力学采用扩散控制动力学方程进行拟合,拟合结果如图4 所示。 随着温度升高,溶解速率不断增大,试验数据计算结果表明,30 ℃时黄铁矿浸出表观反应速率为0.001 3 min-1,而70 ℃时提高到了0.012 5 min-1,升温对黄铁矿浸出速率的提升非常明显。 提高溶液温度可以加速分子扩散运动,S2O82-、SO4-·与黄铁矿分子活性增强,发生碰撞几率增大,使浸出速率增大。
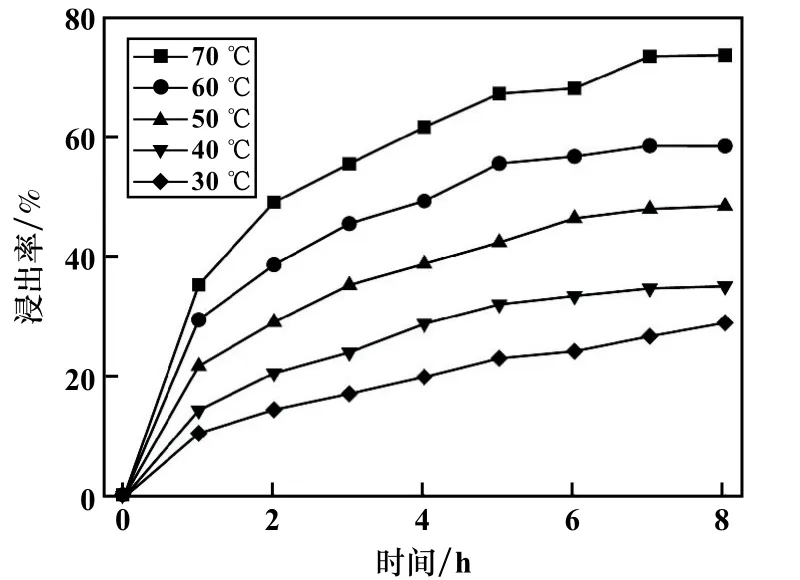
图3 浸出温度对黄铁矿浸出的影响
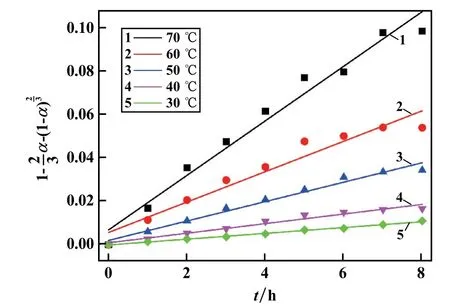
图4 不同浸出温度下拟合结果
根据阿伦尼乌斯方程将图4 中每个温度下浸出反应的表观速率常数的自然对数与温度的倒数1/T作图,得到Arrhenius 图如图5 所示。 由图5 拟合直线可求出表观活化能为:Ea=50.57 kJ/mol。
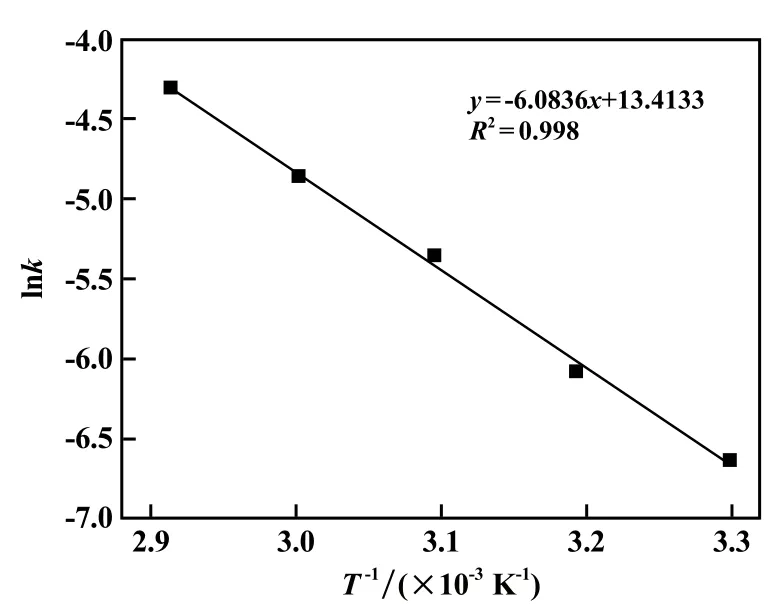
图5 黄铁矿浸出的Arrhenius 图
2.2 FeSO4 活化(NH4)2S2O8 高级氧化体系对黄铁矿浸出的影响
生成SO4-·的反应有热激活和化学激活两种方式,常温状态下,引入活化剂FeSO4以提高黄铁矿浸出率。在黄铁矿浓度10 g/L、(NH4)2S2O8浓度0.395 mol/L 条件下,考察了FeSO4浓度对黄铁矿浸出的影响,结果见图6。 由图6 可知,不添加FeSO4情况下,浸出10 h 时黄铁矿浸出率为19.56%,FeSO4浓度0.033 mol/L 时黄铁矿浸出率为37.35%。 对黄铁矿在不同FeSO4浓度条件下的浸出动力学采用扩散控制动力学方程进行拟合,拟合结果如图7 所示。 由图7 可以看出,在一定浓度范围内增加FeSO4浓度能加快黄铁矿浸出速率,这是因为常温下FeSO4中的Fe2+能够通过化学激活加快过硫酸盐反应产生SO4-·的速率,使得黄铁矿浸出速率和浸出率都有一定增加。 但随着FeSO4浓度逐渐增大,黄铁矿浸出速率增速放缓,这是由于过多的Fe2+与SO4-·反应导致SO4-·淬灭,影响黄铁矿浸出速率。
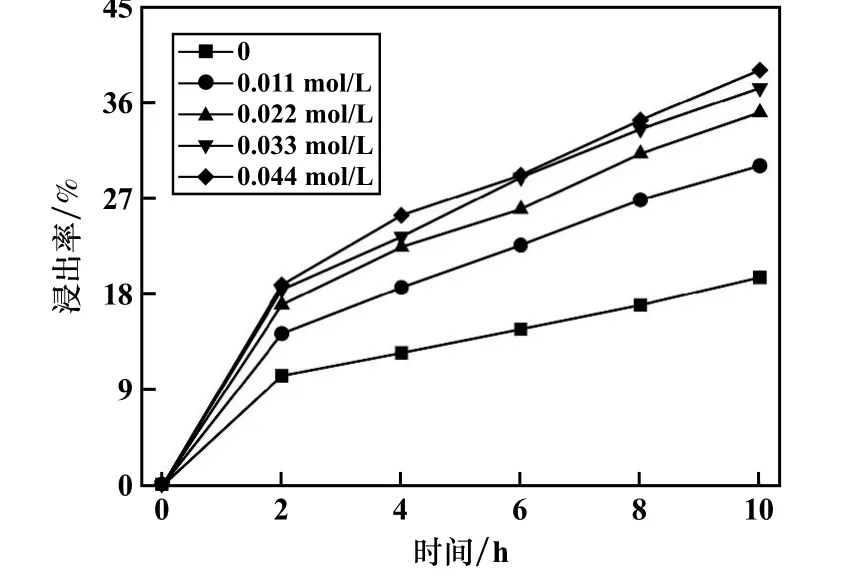
图6 FeSO4 浓度对黄铁矿浸出的影响
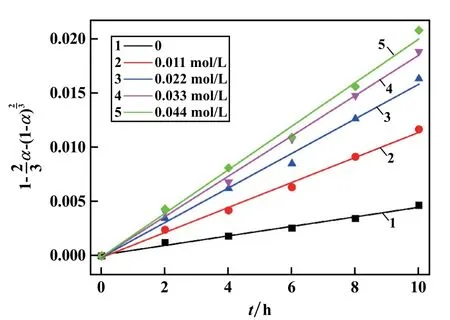
图7 不同FeSO4 浓度下拟合结果
2.3 (NH4)2S2O8 氧化浸出黄铁矿的E⁃pH 图
湿法冶金反应过程可用下列通式表示:
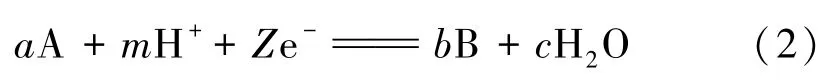
根据电化学与热力学的联系:
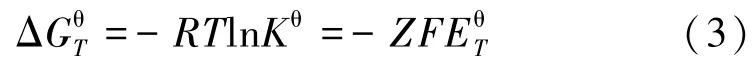
式中ΔGθT为标准反应吉布斯自由能变,J;R为气体常数,R=8.314 J/(mol·K);T为体系温度,K;Kθ为平衡常数;F为法拉第常数,F=9.648×104C/mol;EθT为标准电极电位,V。
Nernst 方程可表示为:
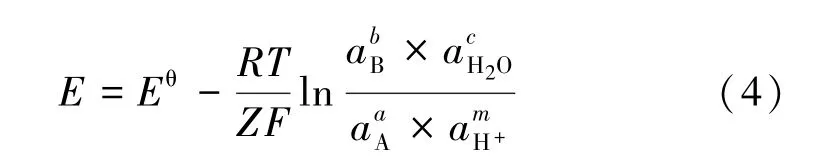
式中E为试验过程中电位,V。
式(4)可化简为:
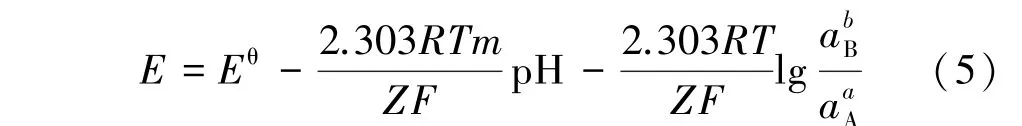

①Z=0,即无电子得失的水解⁃中和反应,反应只与pH 值有关而与电位无关,表达式为:
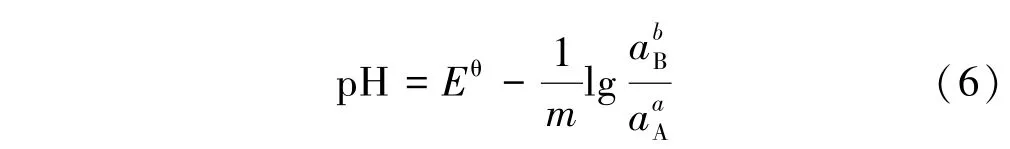
②m=0,即有电子得失的氧化⁃还原反应,反应与pH 值无关,只与得失电子数有关,表达式为:
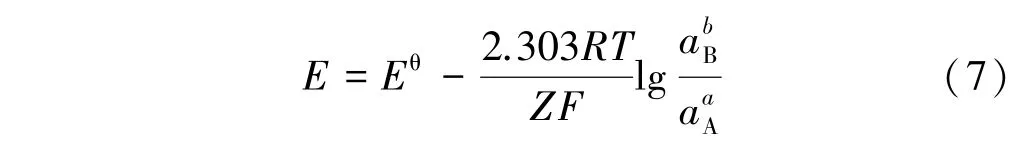
③氧化⁃还原与水解⁃中和反应共存,表达式为:
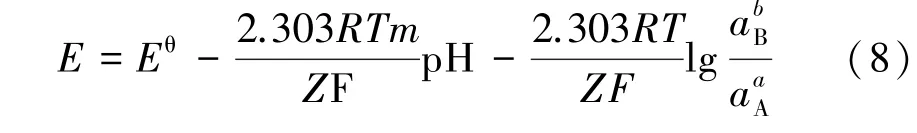
基于上述3 类反应的电位及pH 值计算方法,代入各反应值进行绘图,即可得到该体系的E⁃pH 图。对于(NH4)2S2O8氧化浸出黄铁矿的过程,假设反应体系中离子活度均为1,即以离子浓度代替离子活度,取各物质浓度为1 mol/L,通过式(2)可得到反应中热力学平衡电位与各物质浓度的关系,进而可得出电位与pH 值的关系。 以(NH4)2S2O8为例,FeS2⁃(NH4)2S2O8⁃H2O体系中对应各物质的吉布斯自由能值见表1[10]。
由表1 数据及式(6) ~(8),分别得到FeS2⁃H2O体系和(NH4)2S2O8⁃H2O 体系的E⁃pH 计算式,根据计算式绘制E⁃pH 图,见图8。
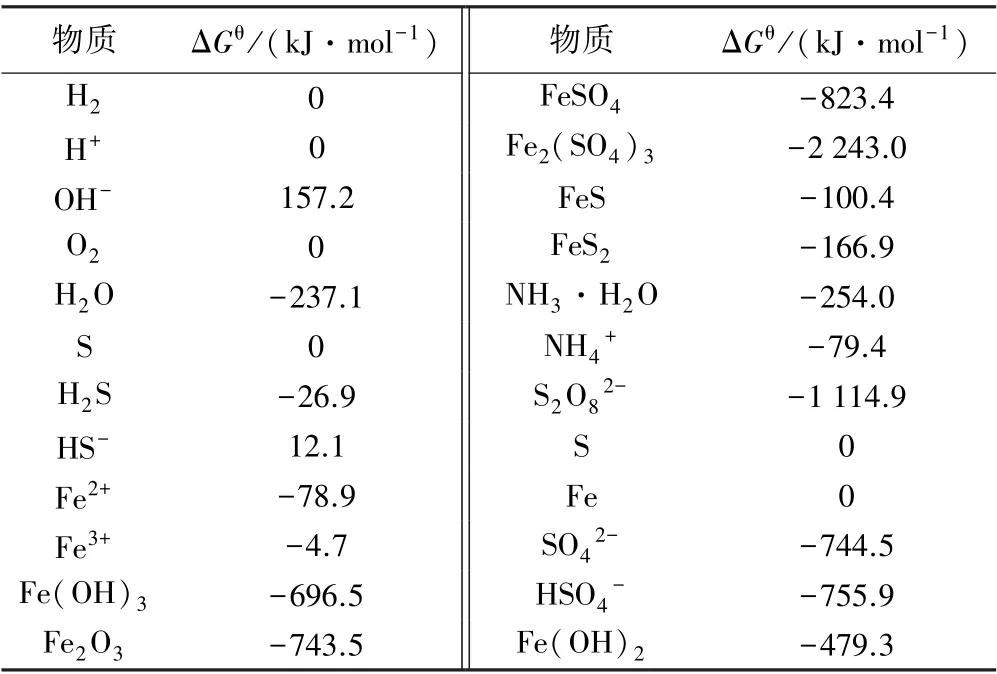
表1 298.15 K 时各物质吉布斯自由能
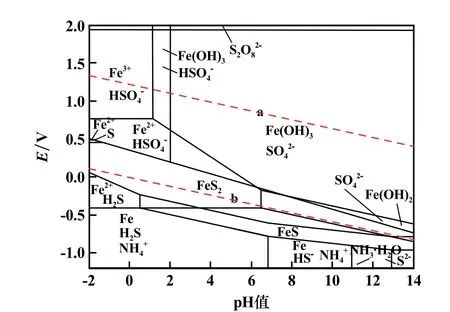
图8 298.15 K 时FeS2⁃(NH4)2S2O8⁃H2O 体系E⁃pH 图
由图8 可知,黄铁矿氧化浸出过程中,S2O还原生成SO的E⁃pH 表达式为:
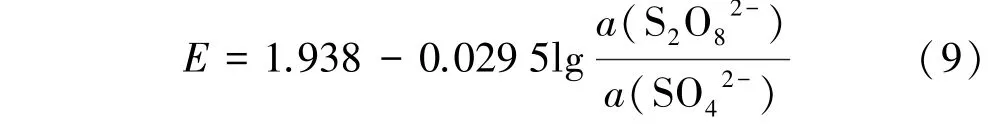

在氧化浸出黄铁矿过程中,如果有单质S 生成,将会覆盖在金矿石表面形成一层薄膜,不利于金的浸出。由图8 可知,在S 元素与Fe 元素的转变过程中,单质S 要在强酸性条件下才能生成,且稳定区非常小。 因此,在浸出过程中必须保证浸出液pH 值不太低,使S

3 结 论
1) (NH4)2S2O8作为氧化剂的高级氧化体系对黄铁矿氧化浸出效果良好,在(NH4)2S2O8浓度0.395 mol/L、浸出温度70 ℃、浸出时间8 h 条件下,黄铁矿浸出率可达73.71%。
3) 黄铁矿氧化浸出的E⁃pH 图分析结果表明,常温下过硫酸盐溶液具有很强的氧化还原电位,通过过硫酸盐氧化分解产生SO·氧化黄铁矿在理论上完全可行,为后续研究常温条件下寻找合适引发剂活化(NH4)2S2O8产生SO·氧化黄铁矿提供了理论依据。在浸出过程中,S 元素最终以SO和HSO形式存在,而Fe 元素最终以和形式存在,不会形成新的包裹体。

