孕期生殖道B 族溶血性链球菌感染检测的临床价值分析
郝永芳
(太原市太航医院检验科,山西 太原 030006)
0 引言
GBS 是成年女性生殖道中携带率最高的菌种之一,且大多数无不适症状[1]。作为一种革兰氏阳性链球菌,其能够导致孕产妇妊娠期阴道感染,同时可通过产道传染给新生儿,进而引发产妇胎膜早破、产后感染、新生儿肺炎及败血症等情况的出现,有流行学研究指出其感染率率约为3.0%~21.9%,对母婴健康及生命安全均造成巨大威胁[2]。国内有研究指出[3],妊娠状态下GBS 可经产道逆行感染并导致早产、流产、胎膜早破等发生,GBS 感染是胎膜早破的独立危险因素,同时阴道B 群链球菌感染孕妇会增加产褥感染、胎膜早破、新生儿肺炎、宫内窘迫的风险。故而在基于此,我院特选取妇产科收治的98 例孕妇作为本次研究对象行回顾性分析,分析院内孕产妇生殖道B 族溶血性链球菌感染率情况,并分析其对于母婴预后情况的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取我院妇产科收治的98 例孕妇作为本次研究对象行回顾性分析,患者选取时间为2020 年1月至2021 年1 月。基于孕妇怀孕30~35 周时为其进行阴道GBS 菌群培养,基于培养结果将其分为阳性组与阴性组两组,其中阳性组患者12 例,年龄20~45 岁,平均(27.39±4.51)岁,分娩时体质指数为(25.19±3.05)kg/m2,胎次(2.17±0.32)次,产 次(1.35±0.25)次;阴 性 组86 例,年 龄20~45 岁,平均(27.54±3.99)岁,分娩时体质指数 为(25.32±3.42)kg/m2,胎 次(2.20±0.37)次,产次(1.32±0.21)次。本次研究通过医院伦理审核,两组患者的基础资料分布差异无统计学意义(P>0.05)。
纳入标准:(1)符合《妇产科学》中对胎膜早破的诊断标准;(2)单胎活产;(3)既往无胎膜早破史。
排除标准:(1)合并妊娠期高血压、妊娠期高血压等妊娠合并症;(2)合并胎位异常;(3)合并前置胎盘、胎盘植入;(4)既往有生殖系统感染史。
1.2 检测方法
本次研究的98 例孕妇均于孕期30~35 周时由两名固定的产科医生对其外阴道消毒后采取窥阴器将宫颈完全的暴露,然后采用无菌的棉拭子从孕妇的阴道下段位置进行GBS 带菌状况的筛查。然后抽取筛查的标本,将其放在培养管中放于37℃的培养箱中进行温育18~24h,当培养管中为出现可疑菌落时再继续温育72h。温育后未出现可疑菌生长时表示为阴性,温育后出现可疑菌落时作革兰染色,采取灰白、圆形的GBS 可疑菌落接种癌血琼脂平板培养基上进行深入的分纯培养,培养的温度控制在35℃温育18~24h[4]。再采用法国生物梅里埃公司生产的ATBExpers-sion1200 细菌鉴定仪进行细菌鉴定的检测。
1.3 对比指标
对于本次研究中所选取的研究对象在分娩前后进行随访,并记录两组孕产妇的妊娠结局,记录两组出现早产、难产、胎膜早破的例数并计算发生率。记录两组新生儿并发症发生率,主要统计新生儿窒息、上呼吸道感染、新生儿肺炎的例数并计算发生率。
1.4 统计学分析
应用SPSS 17.0 统计软件进行数据处理。计量资料用均数±标准差表示,使用t检验,计数资料用百分比表示,使用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 对比两组患者妊娠结局情况
本此研究中研究对象孕期生殖道B 族溶血性链球菌感染率为12.24%。在两组患者的妊娠结局情况方面,阳性组早产例数为3 例,发生率为25.00%,难产例数3 例,发生率为25.00%,胎膜早破例数为4 例,发生率为33.33%;阴性组早产例数为5 例,发生率为5.81%,难产例数13 例,发生率为15.11%,胎膜早破例数为16 例,发生率为18.6%;经对比阳性组早产例数、胎膜早破发生率均明显高于阴性组,组间差异有统计学意义(P<0.05)而在难产例数方面两组患者差异无统计学意义(P>0.05)。见表1。
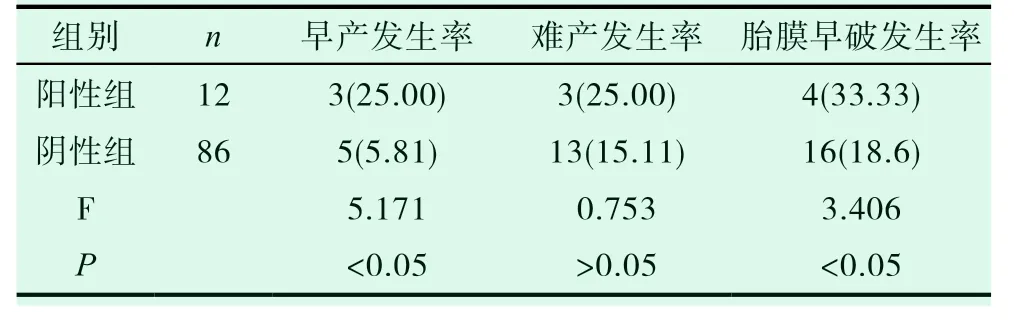
表1 对比两组患者妊娠结局情况 [n(%)]
2.2 对比两组患者新生儿并发症发生率
在两组患者的新生儿并发症发生率方面,阳性组新生儿窒息例数为1 例,发生率为8.33%,上呼吸道感染例数为1 例,发生率为8.33%,新生儿肺炎例数为2 例,发生率为16.67%;阴性组新生儿窒息例数为2 例,发生率为2.32%,上呼吸道感染例数为3 例,发生率为3.48%,新生儿肺炎例数为5 例,发生率为5.81%;经对比阳性组新生儿窒息发生率、上呼吸道感染发生率、新生儿肺炎发生率均明显高于阴性组,组间差异有统计学意义(P<0.05)而在难产例数方面两组患者差异无统计学意义(P>0.05)。见表2。
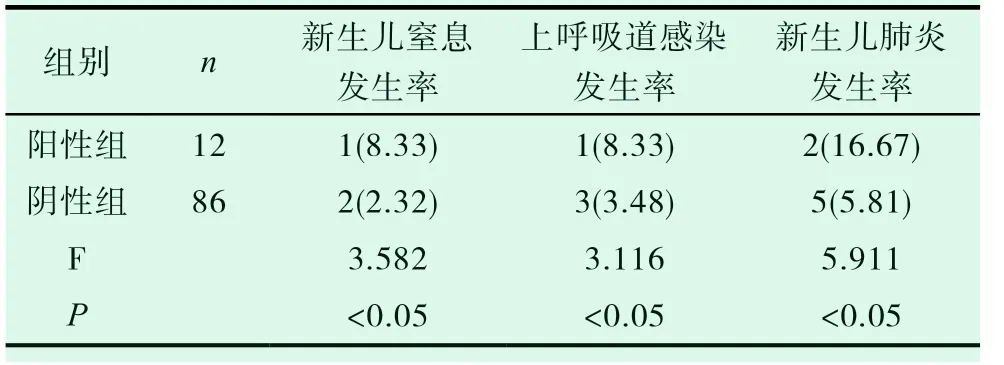
表2 对比两组患者新生儿并发症发生率[n(%)]
3 讨论
在机体中GBS 多存在于下消化道与泌尿生殖道位置,其作为成年女性生殖道中携带率最高的菌种之一[5]。在出现GBS 感染后,其作为所有病原菌中对绒毛膜吸附、穿透能力最强的病原体,上行感染胎膜后产生一系列病理变化并最终引发胎膜早破[6]。胎膜早破后GBS 及其他病原菌易侵入宫腔,引起羊水、胎盘以及胎膜感染[7]。分析其原因主要是由于GBS 阳性者胎膜组织中NLRP3、ASC、caspase-1 的蛋白表达量会出现高表达的情况,NLRP3 小体作为多组分的蛋白复合物,其中NLRP3 结合凋亡相关蛋白后进一步招募caspase-1,最后形成炎症小体并对caspase-1 形成自身激活,活化后的caspase-1 切割pro-IL-1β 等底物并形成成熟的炎症因子包括IL-1、IL-18 等,其认为NLRP3 是caspase-1 激活及成熟IL-1β 生成的重要媒介,而在妊娠的过程中,孕妇体内的胎盘上皮细胞、滋养细胞、蜕膜基质细胞中也存在一定的NLRP3,高表达的NLRP3、ASC、caspase-1 共同作用下,会使得胎膜早破情况的发生[7]。
同时不良母婴结局的发生往往与基质金属蛋白酶(MMPs)调节的细胞外基质降解异常直接相关[8]。MMP1 由羊水间充质细胞分泌并可降解Ⅰ~Ⅲ型胶原蛋白,参与宫缩启动、胎儿娩出等多个重要妊娠过程;MMP3 是羊水的生理成分之一,多于感染背景下合成增加,是一种在肿瘤、炎症状态下较为活跃的MMPs 亚型;MMP-8 在嗜中性粒细胞激活状态下大量释放,其在正常妊娠者中含量稳定且少,在机体受到刺激或者感染时引起中性粒细胞合成增加,可破坏胎膜组织的弹性及张力,导致结缔组织松弛、宫颈扩张、胎膜破裂[9]。NLRP3 小体激活后下游MMP1、MMP3、MMP8 表达量增加,增加对胎膜组织的分解并使之破裂,此外炎症因子刺激子宫收缩,导致晚期流产或早产孕妇生殖道GBS感染后可通过已破的羊膜上行传播途径或分娩时从母体感染新生儿,导致相关并发症的出现[10]。
综上所述,在孕产妇的妊娠晚期,若是其生殖道内存在GBS 感染情况,容易导致其妊娠结局与新生儿健康受到负面影响,故而在孕产妇分娩前应该对于其进行常规GBS 筛查,早发现早治疗改善孕产妇母婴结局。

