孤立性脑桥梗死病因亚型与神经功能进展、吞咽困难之间的相关性
陶微微
(浙江省台州医院神经内科,浙江 台州 318000)
0 引言
中国缺血性脑梗死发病率远高于西方国家,并且呈现高复发率、高致残率、高死亡率的特点[1]。脑桥梗死约占所有缺血性脑梗死的7%,后循环梗死的15%,发生率高于任何其他孤立的脑干梗死[2-3]。孤立性脑桥梗死患者的神经功能恶化较为常见,脑桥梗死虽然比皮质梗死少见,但皮质延髓束的影响却可导致吞咽功能严重受损[4]。神经生理学证据指向“吞咽中枢”或吞咽“中心模式发生器”位于延髓网状结构[5]。与延髓和幕上区域不同,脑桥并不包含吞咽中枢,也可致吞咽困难。吞咽困难是急性缺血性脑卒中的一个常见症状,卒中后吞咽困难常导致肺炎、脱水、营养不良和功能下降, 不仅会增加致残率和死亡率,而且可显著影响患者生活质量。因此,早期识别有吞咽障碍高风险的患者群体是非常重要的。越来越多的学者关注急性孤立性脑桥梗死与早期神经功能进展的相关性[6-8]。另有一些国外研究发现基底动脉分支疾病(basilary artery branch disease,BABD)亚型和脑桥下部病变是孤立性脑桥梗死神经功能进展的预测因素[9],脑桥上部和前外侧的梗死比其他部位的脑桥梗死更容易导致吞咽困难[10]。然而,同时探讨孤立性脑桥梗死病因亚型与神经功能进展及吞咽困难之间的相关性的研究目前较少。因此,本文致力于探讨孤立性脑桥梗死病因亚型、病变部位与神经功能进展(neurological deterioration,ND)、吞咽功能障碍之间的关系。
1 对象与方法
1.1 研究对象
我们一共筛选了143 名于2019年9 月至2020年 8 月之间在浙江省台州医院就诊的患者,他们均满足以下入选标准:(1)诊断急性缺血性卒中(国际疾病分类,十修订,I63.0-I63.9);(2)症状出现在入院48h 内;(3)磁共振上有一个孤立性脑桥梗死(见下面的成像评估)。仅接受CT 检查 (无论何种原因)的患者不包括在内。其他血管供血区伴发梗死的患者除外(但允许小脑或大脑后动脉供血区有小斑点病变的患者)。进一步排除标准:(1)年龄<18 岁;(2)脑桥陈旧梗死;(3)合并脑出血;(4)既往存在吞咽困难;(5)合并其他可能导致吞咽困难的疾病。
1.2 实验方法
孤立性脑桥梗死定义为局灶性神经功能缺损伴头颅磁共振弥散加权成像脑桥相应部位梗死,而脑桥外无并发梗死。我们收集这些患者的人口学特征、血管危险因素、临床、实验室和影像学数据。在禁食8 小时后的第二天早晨检测血糖、胆固 醇(total cholesterol)、甘 油 三 酯(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)和糖化血红蛋白(hemoglobin A1c, HbA1C)。所有患者均行颅脑MRI(包括DWI)和CT 血管造影(CTA)检查。美国国立卫生研究院中风量表(NIHSS)在患者入院的第一天进行评估,并在接下来的几天中每天至少进行两次评估。如果在前5 天内患者NIHSS 评分增加大于等于2 分即为神经功能进展ND[11],否则为非神经功能进展(without ND, wND)。因感染、吸入性肺炎、代谢紊乱、呼吸衰竭或心力衰竭等颅外疾病引起的神经功能恶化均未被记录为ND。孤立性脑桥梗死按病因分为三型,分别是大动脉粥样硬化(large artery disease, LAA)、基底动脉分支疾病(basilary artery branch disease,BABD)和小血管疾病(small vessel disease, SVD)。具体标准如下:(1)若基底动脉管腔狭窄大于50%,归为LAA;(2)若梗死灶到达脑桥表面,无基底动脉狭窄50%以上及其他可能原因,归为BABD;(3)若梗死灶小于15mm,且未达到脑桥表面,无基底动脉狭窄50%以上及其他可能原因,归为SVD。同时根据神经影像将脑桥梗死进一步分为上、中、下三种类型,将梗死区域分为前内侧、前外侧、外侧、后侧四种类型;如果涉及两个相邻的病灶,则以主要受影响的病灶进行分组[11,12]。所有患者均在入院后1 天内进行吞咽困难标准化床边测试。吞咽障碍评定分三个步骤进行,第一步是确定病人的意识水平和协作能力。第二步是干性吞咽(唾液)测试。第三步涉及吞咽5mL 的水,同时监测指脉氧,并仔细观察口腔期吞咽困难的迹象(水从嘴唇溢出,吞咽延迟,或者舌头运动异常或缺乏)或误吸的迹象(咳嗽,或脉搏氧饱和度小于90%)。根据这个三步床旁吞咽评估,每个病人被分为吞咽困难(每一步至少有一个评估标准的异常)或非吞咽困难[12]。
1.3 数据分析
我们采用SPSS 16.0 分析数据,符合正态分布的数据采用均数± 标准差表示,否则用中位数(四分位数间距,IQR)表示。分类变量的比较采用卡方检验,非正态分布数据之间的比较采用Mann-Whitney U 检验,正态分布的均数之间的比较采用两独立样本t检验。P<0.05 差异有统计学意义。
2 结果
2.1 进展组与非进展组临床基线资料比较
本研究共纳入143 例孤立性脑桥梗死的患者,其中ND 组51 例, wND 92 例,两组在性别、年龄、收缩压、舒张压、总胆固醇、LDLC、空腹血糖、糖化血红蛋白、烟酒嗜好及是否合并吞咽困难方面无统计学差异(P>0.05),但ND 组的甘油三酯水平、NIHSS 评分均高于wND 组,差别具有统计学意义(P<0.05);与wND 组相比,ND 组更常合并构音障碍,差别有统计学意义 (P<0.05)。见表1。
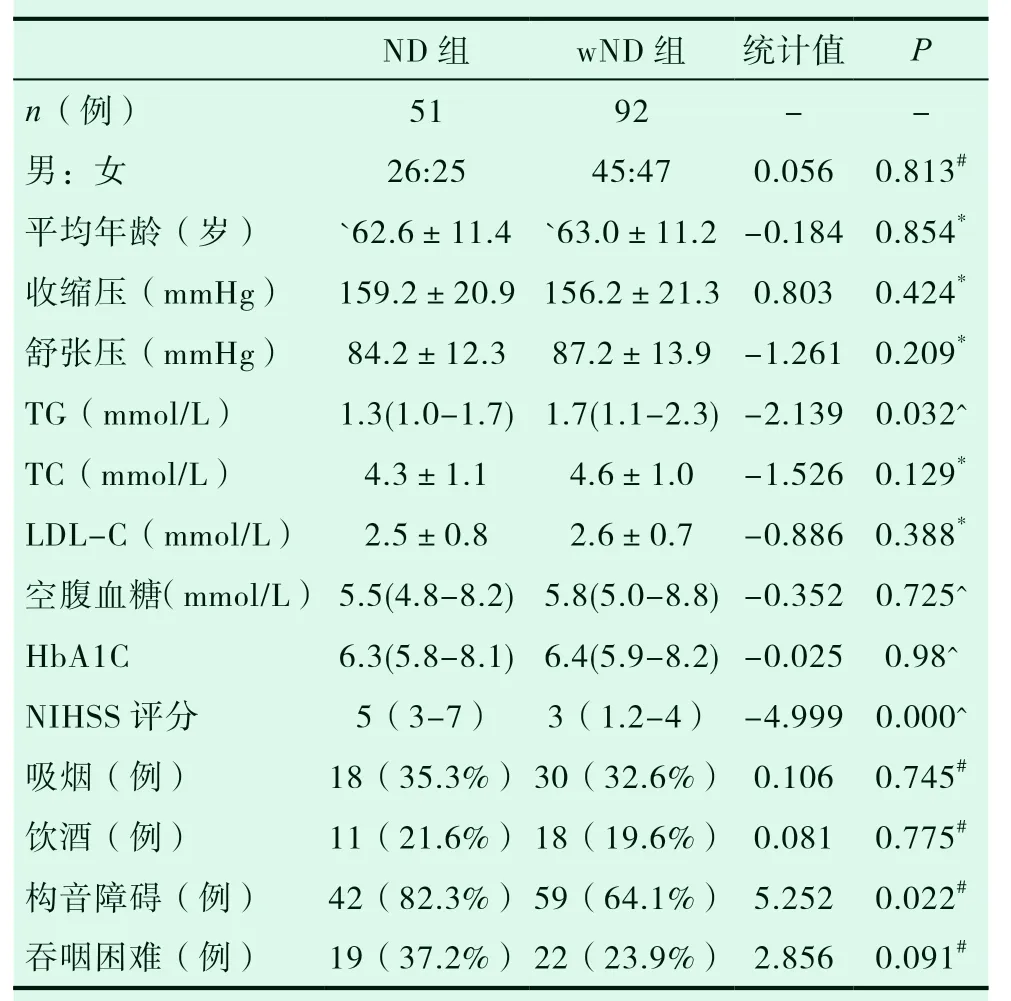
表1 进展组与无进展组临床基线资料比较
2.2 进展组与非进展组影像学特征比较
ND 组梗死层面最大直径大于wND 组,差别具有统计学意义(P<0.01)。我们未发现梗死层面、梗死区域与神经功能是否进展之间存在相关性(P>0.05)。在病因学分型方面,我们发现归为BABD 的孤立性脑桥梗死更常出现神经功能进展(P<0.01),而归为SVD 的孤立性脑桥梗死更少出现神经功能进展,差别具有统计学意义(P<0.001)。见表2。

表2 进展组与无进展组影像资料比较
2.3 进展组内吞咽困难患者与无吞咽困难患者影像资料的比较
51 例神经功能进展的患者中,合并吞咽困难的有19 例,无吞咽困难的有32 例,两者在梗死层面及梗死区域的分布方面差异无统计学意义(P>0.05);而归类于BABD 的ND 患者更常出现吞咽困难(P<0.05),归类于SVD 的ND 患者多无吞咽困难(P<0.01),差别具有统计学意义。
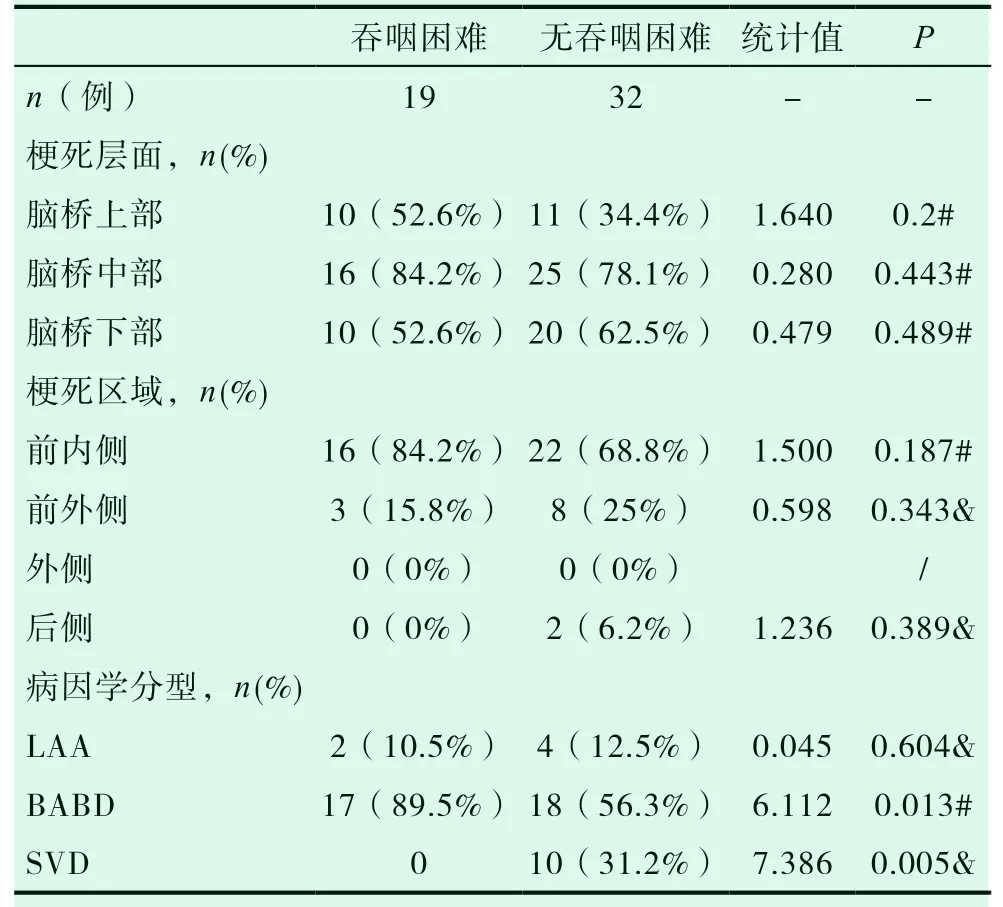
表3 进展组内吞咽困难者与无吞咽困难者影像资料的比较
3 讨论
我们共纳入143 例孤立性脑桥梗死,其中ND组51 例,wND 组92 例,在病因学分型方面,BABD亚型有74 例(51.7%),是孤立性脑桥梗死中最常见的亚型,这与既往研究一致[3]。ND 组的甘油三酯水平、NIHSS 评分均高于wND 组,且更常合并构音障碍,ND 组的病灶最大横径大于wND 组, 这些可能由于进展组病灶多是由于动脉粥样硬化斑块堵塞基底动脉穿支孔口导致梗死病灶延伸至脑桥表面累及皮质脊髓束所致。Ruyue Huang 等发现BABD 和脑桥下部病变是孤立性脑桥梗死神经功能进展的预测因素[9,13]。吞咽困难是脑桥梗死的一个常见临床表现。Sriramya Lapa[10]等研究发现脑桥上部和前外侧的梗死比其他部位的梗死更容易导致吞咽困难。而我们的研究未发现脑桥梗死层面、脑桥梗死区域与是否存在神经功能进展及是否出现吞咽困难之间存在相关性。我们进一步从病因学分型分析,发现在孤立性脑桥梗死患者中,BABD 是最常见的亚型,且病因学分型属于BABD的患者更常出现神经功能进展(P=0.003),这与既往文献所述一致;属于SVD 的患者则更少出现神经功能进展(P=0.000);而神经功能是否进展与LAA 无关,即与基底动脉狭窄是否狭窄至少50%无关,这表明,孤立性脑桥梗死的神经系统进展与大动脉狭窄导致的血流动力学障碍无关; Fisher 和Caplan 首次报道BABD 亚型是动脉粥样硬化斑块堵塞基底动脉穿支孔口导致梗死病灶延伸至脑桥表面所致,而将SVD 描述为穿支动脉远端的脂质玻璃样变,导致脑桥内形成岛状的梗死病灶[14,15]。BABD 亚型容易出现神经功能进展的机制可能与大口径穿透性动脉孔口的动脉粥样硬化病变引起的灌注减少、动脉粥样硬化性血栓的扩展以及邻近的桥脑分支的闭塞有关[11]。另外,在神经功能进展的患者中,我们发现病因学分型属于BABD 亚型的患者更常出现吞咽困难(P=0.013),而属于SVD的患者更少出现吞咽困难(P=0.005)。BABD 亚型梗死病灶累及脑桥腹侧表面,多累及皮质脊髓束,因此更容易出现神经功能进展和吞咽困难,而SVD亚型梗死病灶累及脑桥内部,避开了皮质脊髓束,故不容易出现神经功能进展和吞咽困难。
4 结论
我们的研究发现病因学分型属于BABD 的患者更常出现神经功能进展,在神经功能进展的患者中,病因学分型属于BABD 亚型的患者更常出现吞咽困难。该结果有助于通过神经影像早期识别孤立性脑桥梗死且出现神经功能恶化的患者中存在吞咽障碍高风险的患者群体,及时给予早期鼻饲及肠内营养支持以降低吸入性肺炎的发生率及改善患者预后。

