结肠癌化疗后缺血性肠炎1 例
容加梅,郭蕊,黄奇,缪应雷
(昆明医科大学第一附属医院,云南 昆明 650032)
0 引言
缺血性结肠炎(Ischemic Colitis,IC) 是指各种原因引起的体循环和或肠系膜血管病变导致的结肠缺血。好发于左半结肠,表现为腹痛、腹泻、便血。腹部CT 可见节段性肠壁增厚、水肿、“拇纹征”,透壁性肠炎时可见肠壁积气或门静脉积气,内镜下可见肠粘膜充血、溃疡、肠道狭窄,病变部位与非病变部位分界清楚。缺血性结肠炎常见危险因素包括心脑血管疾病、糖尿病、肠易激综合征、便秘、血液高凝状态、医源性肠系膜血管损伤、血管炎、肠梗阻等[1],值得提出的是药物也是缺血性肠炎一重要风险因素[2]。我们报道1 例以结肠癌化疗后发生的表现为腹部包块并内镜下黏膜剥脱样改变的缺血性肠炎。旨在提高对药物在IC 发病中的作用,IC、伪膜性肠炎、结肠癌间鉴别诊断的认识,以减少误诊和漏诊。
1 临床资料
患者男,56 岁,身高156cm,体重56kg,因“腹泻3 月,加重伴腹痛1 月余”于2021 年9 月2 日入院。患者2021 年7 月起无明显诱因出现大便次数增多,每日3 次,大便为黄色稀便,无粘液、脓血,无腹胀、腹痛,未治疗。2021 年7 月25 日出现阵发性下腹部胀痛,进食后加重,伴肛门停止排便排气,7 月26 日出现解粘液便,10-20 次/天, 伴腹痛、里急后重。7 月28 日至当地消化内科住院,2021 年7 月30 日完善肠镜:进镜至降结肠脾曲,粪便多,降结肠、乙状结肠粘膜重度充血水肿,肠腔狭窄,结肠镜尚能通过。直肠、肛门:粘膜充血水肿;病检:( 乙状结肠) 慢性炎症;2021 年8月2 日腹部CT:横结肠Ca 术后,吻合口通畅,周围未见明显异常密度及异常强化灶,结肠脾曲及降结肠、乙状结肠、直肠肠壁广泛不规则增厚,肠腔变形变窄,性质?炎症?其他?大便培养(-)。2021 年8 月1 日复查肠镜:进镜至回盲部,升结肠、肝曲、横结肠肠腔通畅,粘膜光滑,未见溃疡、肿物,降结肠、直肠局部粘膜充血、水肿,乙状结肠粘膜重度充血水肿、肠腔狭窄,肛门粘膜轻度充血水肿。当地医院诊断为结直肠炎性改变,性质待查。予阿莫西林、氨苄西林、诺氟沙星等药物抗感染、柳氮磺吡啶抗炎治疗。病情未见明显好转,腹泻同前,腹痛加重。2021 年8 月23 日转至我院分院,2021 年8 月24 日腹部CT:降结肠、乙状结肠及直肠上段壁增厚水肿,周围见渗出,考虑炎性可能,并结肠管腔狭窄,小肠不全性梗阻待排。予“左氧氟沙星 0.4g ivgtt qd ”抗感染。2021年8 月26 日复查肠镜:进镜至降结肠,大便多。距肛门50cm 以下粘膜明显充血水肿,散在白苔样物,肠道水肿至管腔相对狭窄。诊断:结直肠病变性质待查( 伪膜性肠炎待排),8 月27 日更改抗生素为“甲硝唑 0.4g po bid”,8 月30 日更换为“万古霉素 0.25g po q6h”。患者腹泻、腹痛同前。9 月2 日转至我科。病程中,患者体重减少10Kg。
既往:10 年前发现血压高:最高170/?mmHg,长期口服硝苯地平控释片1 次/d,每次30mg 降压,血压均波动于100-120/70-85mmHg。2019 年7 月当地医院确诊结肠缩窄型低分化癌(pT4NOMO);2019 年7 月29 日全麻下行腹腔镜辅助左半结肠癌根治术+结肠造口还纳术+肠粘连松解术,术后规律化疗方案为:XELOX(奥沙利铂+希罗达)至2019 年12 月,定期复查均未见异常,否认非甾体类抗炎药物服用史。吸烟饮酒20 年。
入院后完善相关检查:2021 年9 月3 日血常规:白细胞计数9.99×109/L ↑,中性粒细胞百分比75%,血小板计数329×109g/L,血红蛋白142g/L,血生化:白蛋白 32.4g/L ↓,感染相关蛋白:7.17mg/L ↑;EBV-DNA(-)、CMV-DNA(-);抗核抗体谱:ANA(+)、核颗粒型1:100,ANCA (-);凝血四项+纤溶三项:凝血酶原时间14.7 秒↑,D-二聚体2.51μg/mL ↑;肿瘤标记物全套:CA125:53.6U/mL,其余肿瘤标记物正常。血沉:28 ↑mm/h,免疫球蛋白+补体:IgA:4.73 ↑,补体C3:0.614 ↓;大便常规+潜血:(+);大便培养(-);大便真菌涂片:见真菌孢子,未见菌丝;粪便艰难梭菌检测(-);T-spot (-);肥大外斐试验(-);尿常规(-)。2021 年9 月10 日完善胃镜(见图1):慢性萎缩性胃炎( 中度/C3:胃窦、胃角、胃体小弯侧) 可能伴胆汁反流、慢性非萎缩性胃炎(胃体、胃角)、十二指肠炎。肠镜( 见图2):进镜30cm 至乙状结肠,大便拥塞肠腔不能进镜,所见肠粘膜弥漫性剥脱,剩余肠粘膜充血水肿,呈岛状隆起。病检:( 乙状结肠)粘膜轻度慢性炎伴息肉状增生,另见一小片炎性渗出物,未见肿瘤。
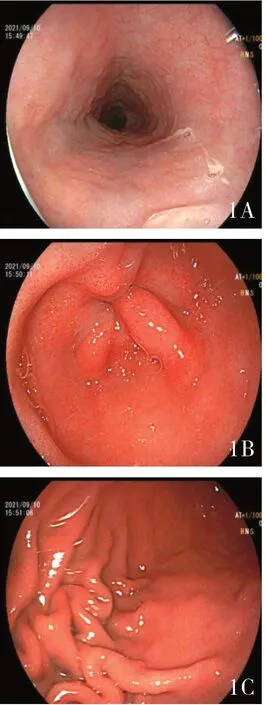
图1 A:食管未见明显异常;B:胃窦粗糙,白象多;C:胃体充血水肿;
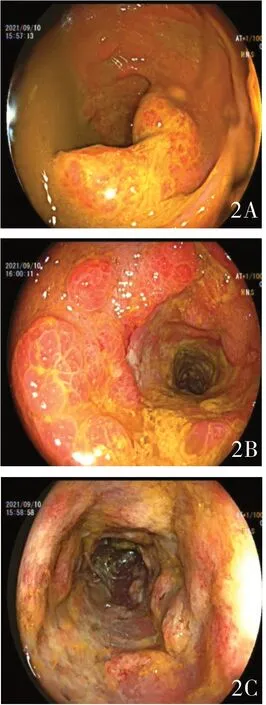
图2 A:直肠水肿、剥脱;B:乙状结肠水肿、剥脱;C:乙状结肠水肿、剥脱;
2021 年9 月13 日腹部增强CT+CTA(见图3):结肠脾曲、降结肠、乙状结肠及直肠肠壁不规则增厚并肠腔狭窄,周围脂肪间隙模糊,炎性肠病?其他?横结肠Ca 术后改变,吻合口未见明显异常。
MRI:乙状结肠-直肠上段肠壁弥漫性增厚,周围脂肪间隙模糊,盆腔少量积液,多考虑炎性。2021年9 月22 日PET-CT:横结肠癌术后,原术区未见确切密度及代谢异常。降结肠、乙状结肠管壁增厚、管腔狭窄,代谢增高,考虑炎性。病变周围及盆腔内脂肪间隙密度增高并絮状影,腹盆腔内肠系膜稍增厚,代谢不高,考虑炎性。残余横结肠扩张、积气。2021年9月27日肠镜(图4):进镜至回盲部,回盲部、升结肠、吻合口所见粘膜光滑、无异常,距肛门35 公分以下降结肠粘膜弥漫充血水肿、溃烂,直肠粘膜病变较轻;距肛门19 公分至16 公分粘膜充血水肿、溃烂、隆起,其口侧可见较多脓性分泌物。

图4 A:回盲部大便多;B:升结肠大便多;C:吻合口未见异常;D:乙状结肠充血水肿、溃烂;E:乙状结肠水肿、剥脱;F:降结肠水肿溃烂、脓性分泌物;
2021 年9 月29 日行“腹腔镜探查+结直肠次全切除+回肠预防性造口术。大体标本(见图5)。
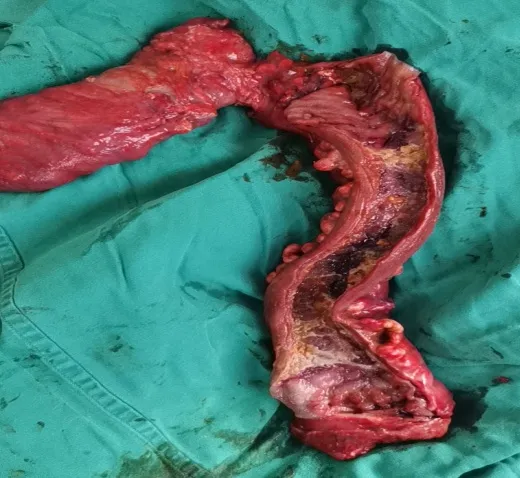
图5 结直肠次全切大体标本
病检示(见图6):送检肠管壁增厚、僵硬、肠粘膜多发息肉样改变,肠壁局部肿块样隆起,肠系膜多发结节样增厚区,镜下见肠壁纤维增生、水肿、血管增生、充血扩张,粘膜下层增宽,粘膜上皮呈慢性炎症改变,局部血管壁纤维素样坏死,粘膜上皮呈缺血改变,肠系膜纤维增生、慢性炎,未见肿瘤性病变,目前病变考虑与手术及化疗后炎症、缺血及增生病理改变相关。

图6 A:肠壁纤维增生、水肿、血管增生,粘膜上皮慢性炎、局部血管纤维素坏死,粘膜上皮缺血改变;B:肠壁纤维增生、水肿、血管增生,粘膜上皮慢性炎、局部血管纤维素坏死,粘膜上皮缺血改变;C:横结肠近端纤维组织增生。(A:HE染色 ×100;B、C:HE 染色 ×200)
诊断与鉴别诊断:(1) 缺血性肠炎:该病例患者为中老年人,急性发病,表现为解黏液便、腹痛;D-二聚体升高;腹部CT 提示病变局限于降结肠、乙状结肠、直肠,以乙状结肠、降结肠为重,乙状结肠见“拇纹征”;内镜下升结肠、结肠肝曲、横结肠等非病变部位与病变部位分界清,符合缺血性肠病内镜下特点;术后病理提示符合缺血性肠病。故该患者诊断为缺血性肠炎。(2) 伪膜性肠炎:该患者既往大量使用抗生素病,内镜见粘膜剥脱性改变,腹部CT 见乙状结肠拇纹征样改变,需考虑该病。但入院后完善艰难梭菌检测(-),故不支持该病。(3) 结肠癌复发:该患者既往结肠癌病史,此次病程可触及左下腹包块,需考虑结肠癌复发。但患者2021 年3 月外院肠镜未见肿瘤复发,腹部增强CT、PET-CT 考虑结肠病变,炎性可能性大,内镜下粘膜活检及手术大体活检未查见肿瘤细胞,故不支持该病。
治疗:2021 年9 月2 日入院,考虑“伪膜性肠炎可能”,予以“万古霉素 0.5g po q6h”抗感染,调节肠道菌群;“凝结芽孢杆菌、布拉氏酵母菌”调节肠道菌群;“瑞巴派特”保护肠粘膜。2021 年9 月5 日,加用“肠内营养液SP”,2021年9 月8 日加用“中/ 长链脂肪乳250mL ivgtt qd”加强营养支持;完善肠镜、腹部CT 等相关检查,提示“缺血性肠病可能”,2021 年9 月14 日加用“低分子肝素 0.4g ih q12h”抗凝治疗;患者病情未见好转,仍有间断性下腹部疼痛,进食后加重,大便10 余次/ 日,为粘液便,无脓血。9月16 日行疑难病例讨论,考虑初步诊断为:缺血性肠炎可能。对比外院7 月内镜结果,肠道病变进展明显,内科保守治疗效果不佳,需考虑外科治疗。胃肠外科建议进一步完善PET-CT、盆腔MRI、PET-CT、盆腔MR 均无肿瘤复发证据,2021 年9 月24 日转入胃肠外科。2021-9-29 全麻下行“腹腔镜探查+ 结直肠次全切除+回肠预防性造口术”,术后病理提示缺血性肠炎。予以患者补液、加强营养等对症支持治疗,患者腹痛、腹泻症状明显好转。2021 年10 月13 日予出院。
治疗结果、随访及转归:2021 年10 月13 日患者腹痛、腹泻症状明显好转,予出院,电话随访患者,术后恢复好,无腹痛,饮食睡眠正常。
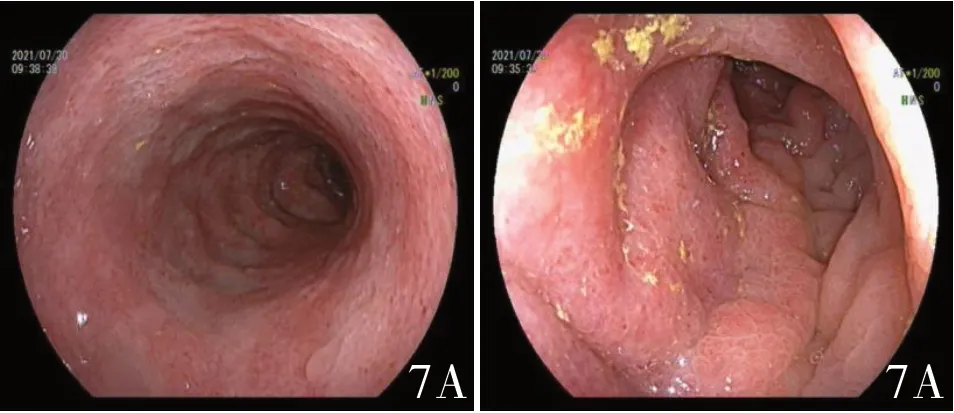
2021 年7 月30 日肠镜:A:乙状结肠充血、水肿
2 讨论
该病例患者既往高血压病史、结肠癌手术史、化疗史,此次急性起病,以“腹痛、腹泻”就诊,外院予以抗感染等治疗无效,至我院就诊,查体可触及左下腹包块,腹部CT 可见病变局限于降结肠、乙状结肠、直肠,且乙状结肠可见“拇纹征”,肠镜见降结肠至直肠上段粘膜剥脱样改变,肠腔狭窄,而病变区与横结肠、升结肠、回盲部分界清。考虑为缺血性肠病,予以患者抗凝、抗感染、调节肠道菌群、加强营养支持等治疗,患者症状无改善,转胃肠外科行“腹腔镜探查+结直肠次全切除+回肠预防性造口术”,术后病理显示缺血性肠病,最终确诊为缺血性肠炎。
该病例患者2019 年7 月当地医院确诊结肠缩窄型低分化癌(pT4NOMO),遂于2019 年7 月29日全麻下行腹腔镜辅助左半结肠癌根治术+结肠造口还纳术+肠粘连松解术。术后定期复查肠镜,均无明显异常。此次患者因腹痛、腹泻至当地医院住院,由于患者肠镜前无法耐受口服泻药行肠道准备,每次灌肠导致肠道准备不充分,且患者肠腔广泛水肿,导致多次进镜不满意,后因诊断不明,至我院就诊时未携带外院肠镜报告,在征求患者意见后在我院又复查肠镜。复查肠镜肠道病变较前进展明显(见图7),考虑缺血性肠病。内科保守治疗效果不佳,结合患者意见,转至胃肠外科行“腹腔镜探查+结直肠次全切除+回肠预防性造口术”。术中见右半结肠扩张明显,肠壁水肿,无法行有效游离后保留并吻合,且远端直肠仍伴有可疑水肿狭窄,术中肠镜无法定位远端切缘,同时见吻合近段小肠梗阻水肿扩张,考虑吻合后存在肠瘘、吻合远端肠壁再次狭窄风险,综合考虑后行预防性造口,待观察远端保留直肠的恢复情况。目前随访病人术后恢复可,无腹痛,精神、饮食、睡眠正常。近期拟去当地医院完善肠镜及腹部CT 检查,建议半年后可考虑造口回纳。

图7
在此次诊疗过程中主要有两个难点。难点一是缺血性肠病与伪膜性肠炎、肠肿瘤的鉴别,已在前文中对该点进行了叙述。有病例报告发现缺血性肠病可合并伪膜性肠炎,艰难梭菌感染与肠道缺血互为危险因素[3],本例中患者有大量抗生素使用史,且内镜下及影像学相关特点使得伪膜性肠炎及缺血性肠炎鉴别困难,外院就诊过程缺乏艰难梭菌相关检验结果,曾有抗艰难梭菌治疗,我院两次初筛粪便艰难梭菌检查阴性,细菌毒素A、B 及谷氨酸脱氢酶均阴性。但是患者病程中是否曾合并艰难梭菌感染,缺血与感染两者相互促进,致使病程进展,现不得而知。难点二是分析患者发生缺血性肠炎可能的原因。回顾患者起病前最后一次肠镜检查,2021 年3 月外院肠镜未提示结肠病变,但我院术后病理见肠壁纤维增生,病理表现与病史时长不符,说明起病时患者可能已经存在肠道缺血并纤维化,并呈隐匿性、持续性进展。患者既往行横结肠癌手术并术后规律化疗。肠道病变呈非对称性,以乙状结肠为重,这符合一般缺血性肠病病变分布特点,即由于脾曲、直乙交界区为相对低血管密度区,降结肠及乙状结肠为缺血性肠病好发区[4]。而横结肠切除术吻合口病变相对轻,术后缺血不能完全解释病变分布情况。且本次术中切除的部分,肠系膜血管存在,系膜水肿僵硬,血管离断时血管壁及血管血供基本正常。我们对术后病变轻的大体标本横结肠近端病理切片也进行了观察,发现粘膜下层也存在纤维化,故纤维化可能发生在整个结肠,在排外血栓栓塞、血管炎、手术操作等病因后,虽然患者10 年前发现血压高,但长期口服硝苯地平控释片1 次/d,每次30mg 降压,血压均波动于100-120/70-85mmHg,且患者术后一直停用降压药至今约2 月余,停药期间每日监测血压均波动于100-125/70-85mmHg,因此患者高血压是否确诊存在疑问,显然,仅根据血压情况仍然无法解释此次肠壁缺血。值得注意的是,患者既往曾有化疗史。药物也是缺血性肠炎一重要风险因素,2019 年发表的一个研究,分析了与结肠缺血相关的药物,地高辛、激素、安非他命、可待因、免疫调节剂,泻药和非甾体抗炎药与结肠局部贫血密切相关,而抗生素、化疗、减充血剂、利尿剂、麦角生物碱、血清素、他汀类药物和血管加压药中等程度相关。化疗药物以紫杉醇、铂类、长春瑞滨为代表,被认为与对结肠上皮直接毒性或抗血管生成毒性相关[2]。
当前结肠癌化疗方案主要是以“奥沙利铂”为基础的“mFOFOX6”“FLOX”“capeOX”及贝伐珠单抗、西妥昔单抗等靶向药物。该患者化疗方案为“奥沙利铂+卡培他滨”。关于奥沙利铂,2004 年,Rubbia-Brandt 等人对153 例结直肠癌肝转移的病理进行了分析,结果发现在有肝窦阻塞综合征病理改变的人中,79%的患者之前接受过含奥沙利铂的的化疗方案,提示肝窦阻塞综合征与使用含奥沙利铂的化疗方案相关[5]。主要病理表现为肝窦梗阻、扩张,肝结节性改变,肝小叶纤维化、肝细胞脂肪样变性,肝窦扩张并出血,肝小叶周围静脉纤维化,肝内小血管闭塞、肝板破裂[6]。具体机制有通过损伤线粒体、耗竭肝窦上皮细胞内谷胱甘肽引起氧化应激反应,TNF -α、IFN -γ 和IL-17、IL-16 等炎症因子水平上调致肝细胞损伤,激活肝星状细胞促胶原蛋白沉积、肝纤维化,损伤肝窦上皮细胞促进了基质金属蛋白酶激活、增加了血小板的粘附聚集能力[7]。此外,也有关于奥沙利铂致肺间质纤维化的报道[8]。查阅奥沙利铂的相关副反应,未见关于肠壁纤维化、缺血性肠炎的相关报道[9]。我们提出奥沙利铂是否也可以通过上述相同的机制,致肠道纤维化、肠道隐匿缺血,后续还需要有相应的病例报告、相关研究去证实。关于卡培他滨,现已有四例关于卡培他滨相关的肠炎的病例报告[10-13]。卡培他滨可引起血管收缩,损伤血管内皮,降解参与纤溶过程的因子[13]。在我们的病例中,我们推测患者使用了致肠道隐匿纤维化、缺血的化疗药物,在腹泻、感染等应激事件下诱发了肠道缺血的急性发病。提示临床医生在缺血性肠病的诊疗中应注意到药物的作用。

