大脑中动脉粥样硬化斑块特征及脑灌注分析与急性脑梗死发生的相关性研究
闫天志,张超,刘清祥,黄琦,黄显军,周运锋*
在亚洲人群中,颅内大动脉尤其是大脑中动脉(middle cerebral artery,MCA)粥样硬化性疾病是引起急性脑梗死(acute cerebral infarction,ACI)和短暂性脑缺血发作(transient ischemic attack,TIA)的最常见原因[1]。颅内动脉粥样硬化性疾病引起脑梗死的主要机制包括穿支动脉闭塞、大动脉内斑块阻塞及其脱落引起远端分支动脉阻塞、下游脑组织的低灌注[2],其中最常见的是后二者形成的混合机制[3]。易损斑块破裂形成微小栓子导致远端动脉间栓塞从而引起低灌注,而低灌注又会引起远端动脉对微小栓子的清除障碍进一步促进脑梗死的发生,两者相辅相成[4]。此外,颅内侧支状态也可能与ACI的发生及临床预后相关[5-6]。高分辨率磁共振血管壁成像(high-resolution magnetic resonance vessel wall imaging,HRMR-VWI)及全脑CT 灌注(computed tomography perfusion,CTP)能很好地对上述病因机制进行评估[6-7]。但是目前大多数研究仅针对斑块特征或者血流动力学某一方面与缺血事件的关系进行评估[8-10],且少部分有关ACI血流灌注的研究主要为定性分析[9,11],定量评估较少。
因此,本研究试图联合HRMR-VWI 及CTP 对症状性MCA 粥样硬化狭窄患者的斑块特征及血流灌注进行定量及定性评估,比较TIA 组与ACI 组斑块特征、血流灌注及侧支状态的差异,初步探讨与ACI 相关的危险因素,为症状性MCA 粥样硬化狭窄患者的危险分层及个体化治疗提供帮助和指导。
1 材料与方法
1.1 研究对象
回顾性分析2020 年1 月至2021 年8 月在皖南医学院弋矶山医院就诊的症状性MCA粥样硬化狭窄且行HRMR-VWI及CTP检查的患者病例64例。纳入标准:(1)根据DWI及临床表现判定为4周内出现MCA供血区域的ACI或TIA;(2)经时间飞跃磁共振血管造影(time-of-flight magnetic resonance angiography,TOF-MRA)、CT血管造影(CT angiography,CTA)或数字减影血管造影(digital subtraction angiography,DSA)检查证实狭窄程度>50%单侧MCA (M1 段)狭窄,且其余脑动脉、双侧颈内动脉、椎动脉及基底动脉狭窄程度小于30%;(3)存在≥1 个动脉粥样硬化危险因素,包括吸烟、糖尿病、高血压、高脂血症等。排除标准:(1)其他可能的缺血原因,如动脉夹层、血管炎、烟雾病或心源性栓塞等;(2)存在磁共振及CTP 检查禁忌;(3)临床、影像资料不完整或图像质量差导致无法进行诊断及数据测量。参考赵义等[12]对症状性MCA 粥样硬化患者的分组方法,将患者分为ACI 组和TIA 组。采集患者的一般临床资料,包括性别、年龄、吸烟史、饮酒史、糖尿病、高血压、高脂血症,同时记录患者症状发作至影像检查的时间间隔。本研究经过本院医学伦理委员会批准(批准文号:2019 伦审研第61号),免除受试者知情同意。
1.2 检查方法
所有患者于症状发生后4 周内接受全脑CTP 及HRMR-VWI检查。
1.2.1 CTP扫描方案
采用西门子炫速双源CT 机(SOMATOM Definition Flash),先行头颅CT 平扫,然后于肘静脉内以流速5 mL/s 注射55 mL 非离子型对比剂(碘佛醇350 mg/mL),以相同速率40 mL 生理盐水冲管,注射对比剂5 s 后开始全脑灌注扫描。CT 平扫参数:120 KV,390 mAs,层厚5 mm。全脑灌注扫描参数:80 KV,100 mAS,扫描范围为150 mm。通过卷积核H30f 将原始数据重建层厚为3 mm、层间距3 mm的图像用于灌注及侧支评分分析。
1.2.2 HRMR-VWI扫描方案
采用GE Signa HDxt 3.0 T MRI设备,配套8通道标准头线圈。先行TOF-MRA 扫描识别狭窄部位,然后进行垂直及平行患侧MCA 最狭窄处血管长轴矢状位及横轴位或冠状位的HRMR-VWI 扫描,包括增强前、后T1 加权成像。扫描参数为:(1) TOF-MRA:TR 20 ms,TE 3.4 ms,FOV=24 cm×24 cm,层厚=1.2 mm,矩阵=384×192;(2) HRMR-VWI:增强前、后T1 加权成像:TR 620 ms,TE 12 ms,FOV=16 cm×16 cm,层厚=2 mm,矩阵=256×256。经肘静脉以速率为2 mL/s 注射剂量为0.1 mmol/kg 钆喷酸葡胺,紧接着以相同速率注射生理盐水15 mL,从注射对比剂开始等待5 min后行增强扫描。
1.2.3 图像分析
两位影像医生共同分析CTP 及HRMR-VWI 的影像资料,意见不统一时经商讨达成一致。图像质量参考刘潇等[13]的方法对HRMR-VWI图像质量差的患者及CTP存在明显运动伪影的患者予以排除。
1.2.3.1 CTP图像分析
将重建后的数据传至西门子工作站(Siemens syngo.via VB10B),使用Volume Perfusion CT Neuro 软件,经过运动校正、自动去骨及识别动静脉血管后,得到时间密度曲线,计算得到脑血流量(cerebral blood flow,CBF)、脑血容量(cerebral blood volume,CBV)、平均通过时间(mean transit time,MTT)、流出时间(time to drain,TTD)、开始时间(time to start,TTS)、剩余函数达峰时间(time to the center of the impulse response function,Tmax)伪彩图。根据Alberta卒中计划早期CT 评分的区域[14],在最大密度投影轴位图像上的基底节及半卵圆中心层面分别手动勾画10 个直径为1 cm的感兴趣区(region of interest,ROI),通过镜像自动得到对侧脑组织ROI 数据。所有定量参数均取相对CTP 参数[相对CBF (relative CBF,rCBF)、相对CBV (relative CBV,rCBV)、相对MTT (relative MTT,rMTT)、相对TTD (relative TTD,rTTD)、相对TTS (relative TTS,rTTS)、相对Tmax(relative Tmax,rTmax)],计算方法为患侧10 个ROI 的平均值与对侧10 个ROI 的平均值的比值。参考tan 氏评分[15]在最大密度投影轴位图像上进行侧支状态的评估:侧支分级的评分从0 到3 分。0 分表示大脑中动脉区域无侧支血管显影;1 分表示侧支血管显影≤50%;2 分表示侧支血管显影>50%,但<100%;3 分表示侧支血管显影达到100%。
1.2.3.2 HRMR-VWI分析
动脉粥样硬化斑块定义为血管壁偏心性或不规则增厚[8],且增厚程度大于邻近正常血管壁厚度的50%。当患侧MCA 存在多个狭窄时,选择狭窄最严重位置的斑块进行测量分析,病变邻近正常血管作为参考。斑块长度:在平行血管层面上测量或者在血管轴位层面以层厚乘以斑块出现的层数表示。斑块厚度:在血管轴位层面血管最狭窄处测量斑块的最大厚度。狭窄程度:狭窄程度=(1-最狭窄处管腔面积/参考处管腔面积)×100%。斑块负荷:斑块负荷=(1-最狭窄处管腔面积/最狭窄处管壁面积)×100%。在匹配的增强前、后的T1加权图像上,于斑块邻近正常灰质处手工绘制面积约10~12 mm2的圆形区域,测量灰质的信号强度。利用以下公式计算斑块的强化指数:强化指数=[(增强后斑块信号强度/增强后灰质信号强度)-(增强前斑块信号强度/增强前灰质信号强度)]/(增强前斑块信号强度/增强前灰质信号强度)×100%[16]。强化程度:以正常血管壁及垂体柄为参考,将强化程度分为0~2 级。0 级:无强化;1 级:轻度强化,强化程度高于正常血管壁低于垂体柄;2级:明显强化,强化程度等于或高于垂体柄。
1.3 统计学分析
应用SPSS 25.0 统计学软件进行统计分析。采用Kolmogorov-Smirnov 法检验定量资料的正态性,符合正态分布者用±s表示,偏态分布者用M (Q1,Q3)表示。分类变量表示为频数或百分比。使用独立样本t检验、卡方检验或非参数Mann-WhitneyU检验对ACI 组和TIA 组的斑块特征、灌注参数进行及侧支评分比较。将ACI 组和TIA 组在单因素分析差异有统计学意义的变量输入多因素Logistic 回归模型,用后退法确定ACI的独立预测因子,并计算优势比(odds ratio,OR)及95%置信区间(confidence interval,CI)。使用ROC 曲线评估每个变量及其联合模型的诊断性能,并计算曲线下面积(area under the curve,AUC)。P<0.05 为差异有统计学意义。
2 结果
2.1 患者一般资料
共纳入64例患者,其中TIA组共25例,ACI组共39例。两组患者间临床资料的差异均无统计学意义(P均>0.05),见表1。
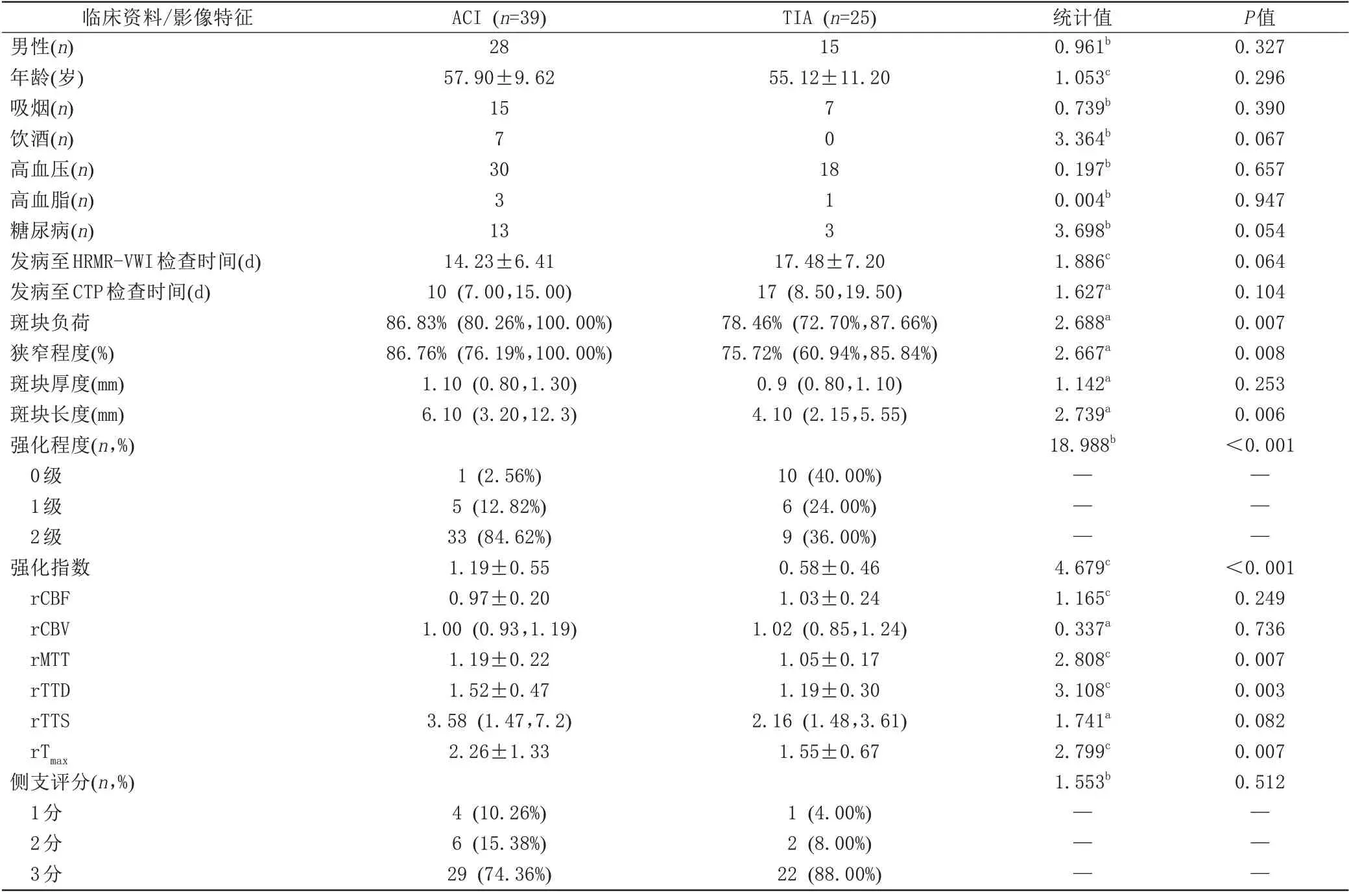
表1 ACI组和TIA组间一般资料、斑块特征、灌注参数及侧支评分的比较
2.2 TIA组与ACI组斑块特征、灌注参数及侧支评分比较
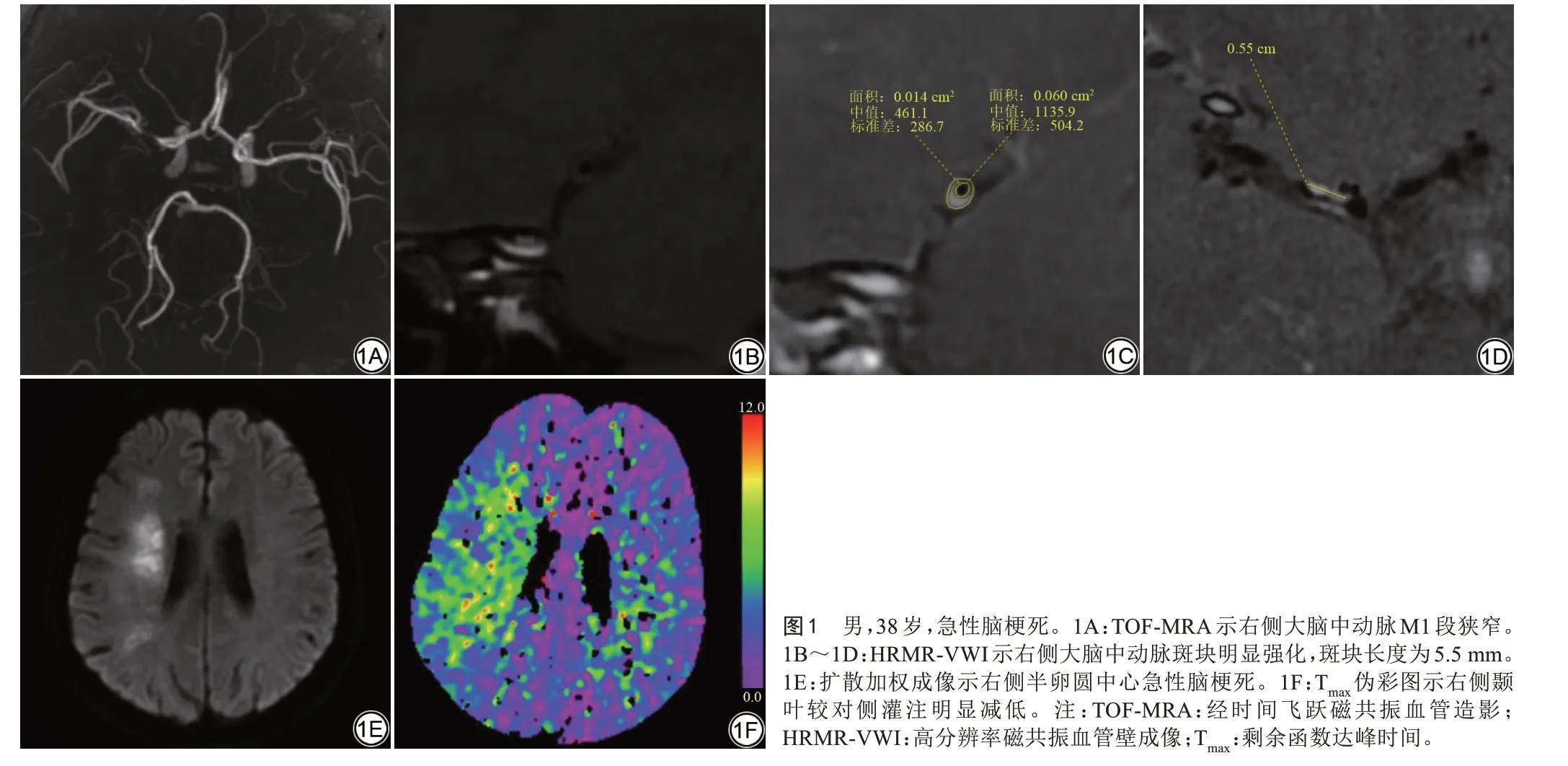
TIA组与ACI组斑块特征、灌注参数及侧支评分见表1。与TIA 组相比,ACI 组的斑块长度更长(P=0.006)、负荷更大(P=0.007)、狭窄程度(P=0.008)、强化程度(P<0.001)和强化指数(P<0.001)更高,同时rMTT (P=0.007)、rTTD (P=0.003)及rTmax(P=0.007)均更大。而rCBF (P=0.249)、rCBV (P=0.736)、rTTS(P=0.082)、斑块厚度(P=0.253)以及侧支评分(P=0.512)在两组间的差异均无统计学意义。图1为ACI典型病例的影像图像。
2.3 ACI的预测因素
多因素Logistic 回归分析显示,斑块长度(OR=1.17,95%CI:1.001~1.362,P=0.049)、强化程度(OR=2.32,95%CI:1.848~14.522,P=0.002)及rTmax(OR=5.18,95%CI:1.019~5.298,P=0.045)为ACI的独立预测因子。绘制斑块长度、强化程度及rTmax的单独及联合模型预测ACI的ROC曲线,结果显示斑块长度、强化程度及Tmax作为单项指标的AUC 分别为0.704(95%CI:0.577~0.831)、0.766 (95%CI:0.636~0.895)、0.681 (95%CI:0.550~0.812)。联合斑块长度、强化程度及rTmax的AUC最大,为0.862 (95%CI:0.767~0.956)。ROC曲线见图2。
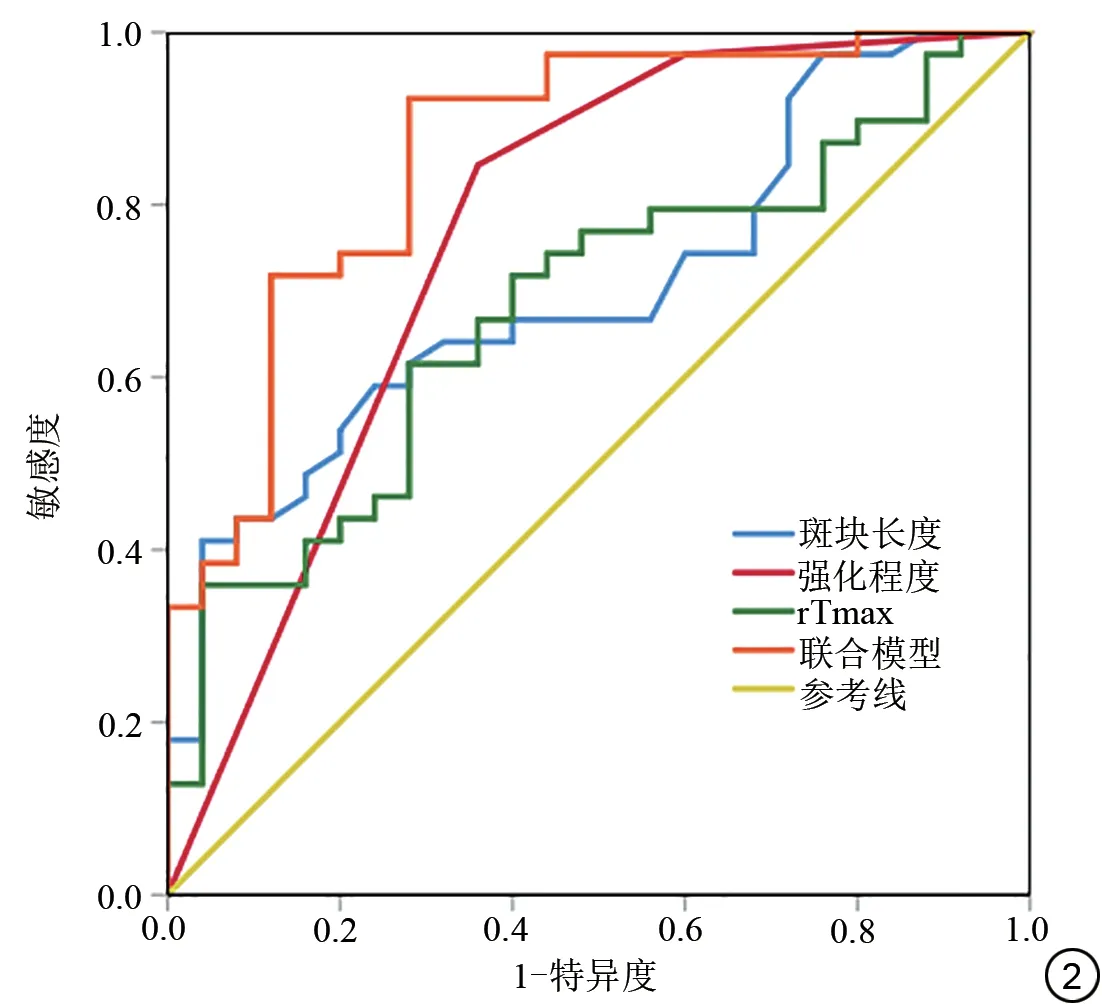
图2 斑块长度、强化程度、rTmax及三者联合模型预测急性脑梗死的ROC曲线。注:rTmax:相对剩余函数达峰时间。
3 讨论
本研究通过联合HRMR-VWI 和CTP 检查对大脑中动脉狭窄所致TIA 和ACI 两组患者的动脉斑块特征、血流灌注和侧支状态进行比较,其结果显示,斑块长度更长、强化程度及rTmax更高时,更容易发生ACI,且斑块长度、强化程度及rTmax三者联合模型对ACI 的预测效能最佳。联合斑块特征和血流灌注分析能更全面地对ACI 的发病机制进行反映,为症状性MCA 粥样硬化狭窄患者的危险分层及个体化治疗提供了理论依据。
3.1 斑块长度
本研究表明斑块长度与ACI 的发生独立相关。以往有关颈动脉粥样硬化斑块的研究表明,相较于对侧,同侧颈动脉斑块长度越长的患者更容易发生ACI[17]。近期,Zhao等[18]发现颈动脉斑块长度与远端动脉微血栓信号的发生独立相关,而脑动脉微血栓信号又预示着斑块的不稳定性及未来ACI的发生。因为颈动脉与脑动脉粥样硬化具有相似的病理过程,所以上述研究结果可能同样适用于MCA 斑块病变。此外,Liu 等[19]还发现斑块长度与下游脑组织低灌注的发生有关,斑块长度越长,血流经过斑块时压降越明显,造成脑灌注压减低,而低灌注又将引起远端动脉对微小栓子的清除障碍进一步促进ACI的发生。斑块长度的测量简单且易于操作(因为MCA 的M1 段走行较为平直),更适于临床实践中推广使用。本研究这一发现意味着日常测量斑块长度即可能有助于识别具有高危风险的颅内动脉硬化患者。
3.2 斑块强化程度
有关颈动脉斑块的组织学研究表明,斑块强化与炎性细胞浸润、内皮细胞通透性增加以及新生血管形成有关,这些改变均有利于对比剂渗入斑块[20],且颈动脉斑块强化程度与ACI相关[21]。虽然颅内斑块的病理组织难以获取,但是最近关于HRMR-VWI的荟萃分析显示颅内动脉粥样硬化斑块强化程度与ACI之间密切相关[22]。这与本研究的结果一致,即强化程度更高的斑块更容易出现在ACI 组中,斑块强化程度也可作为颅内动脉粥样硬化斑块不稳定性的影像标志。虽然在部分TIA患者中斑块也表现出了明显强化,但Kwee 等[23]的研究表明非责任斑块的强化在短期随访中消失,而责任斑块的强化可在发生ACI 后持续数月。与此同时,Zhang 等[24]的一项前瞻性研究发现斑块强化的持续或进展可能预示着脑梗死的复发。总之,强化程度可作为识别ACI 的影像标志,临床医生对于粥样硬化斑块强化程度较高的患者,可能需要更积极地干预和治疗。
3.3 rTmax及侧支评分
本研究对Alberta卒中计划早期CT评分的区域进行了灌注参数的测量,由于绝对值会因对比剂的给药方法和循环动力学的不同而有所不同,因此对相对值进行了评估。以往研究表明Tmax是一种能有效反映脑组织血流状态的灌注参数[19,25]。Liu等[19]以Tmax>6 s作为判定低灌注的标准,发现高血压、斑块长度、向心性斑块及侧支评分是导致下游低灌注的独立危险因素,且Tmax>6 s 的体积可预测患者的神经功能损伤。当de Havenon 等[25]以Tmax>6 s 的体积≥15 mL 为低灌注的标准时,发现远端低灌注与脑梗死复发相关。本研究同样发现较高的rTmax值反映了斑块远端脑组织的缺血状态,并且当rTmax值越高,越容易发生ACI。同时,Lu 等[26]还发现MTT-ASPECTS 评分(mean transient time maps based on the Alberta Stroke Program Early CT Score)联合斑块强化程度可以提高对ACI的预测价值。本研究发现联合斑块长度、强化程度及rTmax的预测模型具有最佳的预测效能。此外,Liu等[5,19]还发现侧支评分差与下游低灌注及ACI 的发生独立相关,这与本研究结果不符。样本量小及本研究ACI组大多为轻型卒中患者可能是导致这一差异的原因,而侧支评分可能对ACI患者预后影响更大。
3.4 本研究的局限性
本研究存在以下局限性:首先,该研究是单中心的回顾性研究,HRMR-VWI 和CTP 检查资料均在急性缺血期或之后获得,未来需要进一步的前瞻性研究来验证斑块特征及灌注参数对ACI 的预测价值;其次,本研究HRMR-VWI 采用的是二维扫描方法,只能评估M1 段动脉,不能全面观察颅内动脉的整体情况;最后,所有患者在入院后均接受抗血小板、降脂等常规治疗,这可能会对研究结果产生一定的影响。
综上所述,HRMR-VWI联合CTP检查能够对症状性MCA粥样硬化斑块特征及下游灌注状态进行全面评估,有助于识别可能发生ACI的高危症状性MCA粥样硬化狭窄患者。
作者利益冲突声明:全部作者均声明无利益冲突。