IVIM评价兔肠系膜动脉栓塞致急性肠系膜缺血的实验研究
巴成慧,王鑫雨,许昌,陈亮,钟晓飞,曹璋,张迪鸣,张濬韬,姜兴岳*
急性肠系膜缺血(acute mesenteric ischemia,AMI)是一种复杂的、多因素参与的疾病,其进展较快、并发症多、预后差、死亡率较高(约为71%)[1]。近年来,随着人口老龄化的加剧,肠系膜缺血的发病率有所增加,且一直保持高水平[2]。AMI病因复杂、种类多,包括肠系膜动静脉的栓塞及血栓形成、非阻塞性肠系膜缺血以及其他罕见病因[3-4]。无论缺血性损伤的原因如何,最终结局都是相似的,即从最初短暂的肠道活动改变到最终的透壁性坏死[5]。目前,尚缺乏准确客观的无创手段评估肠道缺血的情况,术中主要依据对肠道颜色、肿胀程度以及温度来进行主观判断,一旦确诊,肠道缺血程度往往处于难以逆转的阶段。
基于双指数模型的体素内不相干运动(intravoxel incoherent motion,IVIM)成像可以有效区分组织内水分子运动的“真扩散”及微循环灌注的“假扩散”成分,无需使用对比剂即可获得反映病变内水分子扩散和血液灌注的定量参数,包括灌注分数(f);纯扩散(也称慢池扩散)系数(D);假扩散(也称快池扩散)系数或灌注相关扩散系数(D*)[6]。目前,IVIM 在肠道方面主要运用于结肠癌、直肠癌的病理分期、壁外侵犯和淋巴转移等方面[7-8]。很少有研究者将IVIM成像运用到肠系膜缺血的研究中。本研究旨在应用IVIM成像技术反映AMI微循环障碍的病理生理过程,同时研究定量结果与病理的相关性,探讨IVIM 在AMI 早期定量评估与动态监测方面的价值。
1 材料与方法
1.1 动物模型制作
本研究已经过滨州医学院附属医院医学伦理委员会批准(批准文号:20190812)。66只新西兰兔(济南西岭角养殖繁育中心,普通级,No.370822211100057161),体质量2.0~2.5 kg,60~90 日龄,雄性,健康状况良好,采用单纯随机抽样方法分为两组(实验组、假手术组),每组33只,并分为11个时间节点(1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h、4.5 h、5 h、5.5 h、6 h),每个时间节点3 只。实验前禁食约12 h,可自由饮水。首先,经新西兰兔(以下简称家兔)的耳缘静脉置入留置针,建立静脉通道,然后经静脉通道缓慢注射10%的水合氯醛(北京雷根生物技术有限公司),剂量为2 mL/kg,同时观察家兔的状态、角膜反射情况及皮肤钳夹反应。当角膜反射消失,皮肤钳夹无反应,呼吸深、慢、稳定时,表示麻醉成功,停止注射。随后,缓慢注射2 mL的生理盐水。动物模型采取仰卧位固定在实验台上,充分暴露腹部。家兔AMI的模型制作参考Zhao等[9]及Dundar 等[10]学者的方法:取腹部正中切口,找到齐右肾门对侧垂直向腹腔动脉分出的前肠系膜动脉,分离周围筋膜,穿双线结扎,并结扎周围小分支尽可能阻断血流,结扎完毕后将肠管轻轻回纳入腹腔后逐层缝合关腹。假手术组仅分离、暴露前肠系膜动脉、不结扎。
1.2 IVIM成像扫描
使用配有8 通道兔子线圈(苏州众志医疗科技有限公司,3A81108C RB80)的3.0 T 核磁共振扫描仪(MAGNETOM Skyra,Siemens,德国)进行MR 图像采集。检查采取仰卧位、脚先进。实验动物佩戴定制的腹部绷带用于提供腹部压力,以防止腹部呼吸和肠道蠕动,尽量减少运动引起的伪影。MR 扫描序列及参数见表1。其中IVIM 采用双指数衰减的线性扫描扩散加权序列,b 值取20、40、60、80、100、200、400、600、800、1000 s/mm2共10个值。IVIM扫描持续时间约8 min。

表1 MR扫描序列及参数Tab.1 MR scan sequence and parameters
1.3 图像后处理及统计学分析
利用MITK-Diffusion 后处理软件进行图像后处理。在IVIM (b=1000 s/mm2)图像上手动选取感兴趣区(region of interest,ROI),ROI 的选择依照T1WI及T2WI 图像选取缺血肠段管壁,注意避开肠内容物及肠外脂肪间隙,选取肠壁较清晰区域、避开相互重叠肠壁,将ROI 面积呈现最大,每个模型选取5 个ROI,对ROI 进行分析得出IVIM 定量参数值(f 值、D 值及D*值)。采用SPSS 17.0 统计软件对数据资料进行统计分析。计量资料以均数±标准差(±s)表示。采用单因素方差分析比较实验组与假手术组IVIM各定量参数值,以P<0.05为差异有统计学意义。
1.4 病理标本制作
MR扫描结束后立即处死家兔,开腹,取3 cm左右长度的缺血肠段,缺血肠段选取前肠系膜动脉弧形血管网第5 分支所供应的肠管,使用10%甲醛水溶液进行固定,进行石蜡包埋、切片、组织学HE 染色。然后在显微镜下进行切片观察,由两名高年资病理诊断医生双盲法观察病理切片,观察指标[11-12]:绒毛排列是否整齐、腺体是否损伤、肠壁各层组织变化、炎症细胞浸润及血管有无充血、出血等情况。
2 结果
2.1 实验组及假手术组不同时间节点的肠管IVIM及病理表现
假手术组:各时间节点肠管走行自然,未见明显肿胀,肠管管壁未见明显增厚或变薄,扩散加权成像(diffusion weighted imaging,DWI)呈稍高信号,相应表观扩散系数(apparent diffusion coefficient,ADC)呈等信号,各时间节点信号近似,未见明显变化。不同时间节点肠壁病理无明显改变,肠壁分层清晰,各层结构显示良好,小肠绒毛排列整齐,各层细胞形态正常(图1)。
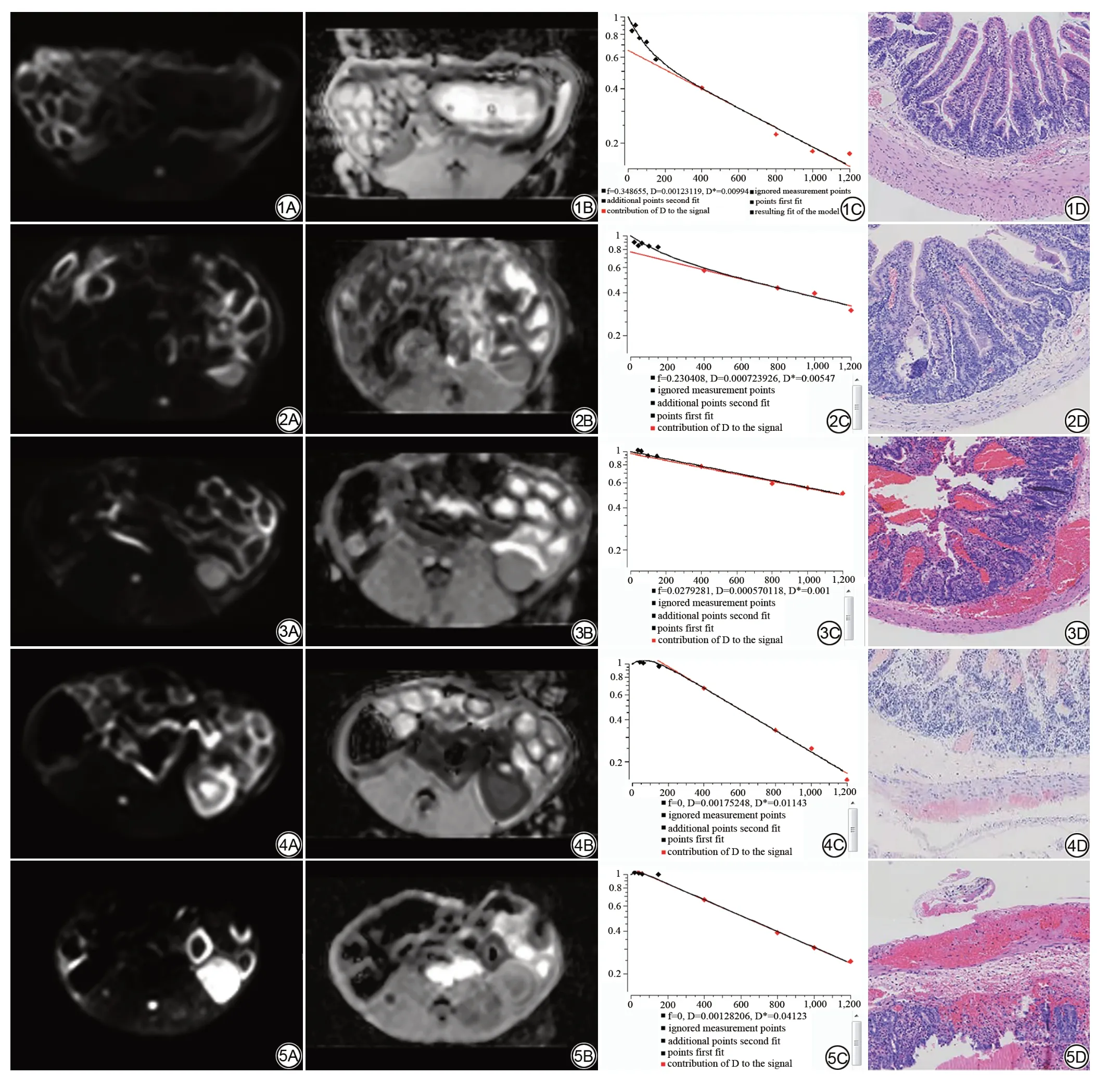
图1 假手术组造模6 h后的肠管IVIM 及病理表现。1A、1B:假手术组造模后6 h IVIM(b=1000 s/mm2)图像及相应ADC 图,DWI呈稍高信号,ADC 呈等信号;1C:假手术组造模后6 h IVIM双e指数模型的扩散信号衰减曲线;1D:假手术组造模后6 h病理图像(HE×8),肠壁各层显示清晰,从内到外依次为黏膜层、黏膜下层、肌层及浆膜层。图2~5:实验组不同时间节点的肠管IVIM及病理表现。2A~5A、2B~5B:肠系膜缺血2 h、4.5 h、5.5 h、6 h IVIM(b=1000 s/mm2)图像及相应ADC图,其中DWI呈高信号,相应ADC信号减低,且随着缺血时间的延长,信号改变更加明显;2C、3C、4C、5C:肠系膜缺血2 h、4.5 h、5.5 h、6 h IVIM双e指数模型的扩散信号衰减曲线;2D:肠系膜缺血2 h后病理图像(HE×8),缺血局限在黏膜层,黏膜层上皮细胞脱落,黏膜固有层可见少量出血;3D:肠系膜缺血4.5 h后病理图像(HE×8),黏膜层和黏膜下层可见大量出血,黏膜层部分腺体结构破坏,肠系膜缺血进一步累及到肌层,内可见少量出血及炎性细胞浸润;4D:肠系膜缺血5.5 h后病理图像(HE×8),黏膜层明显破坏,固有层及腺体几乎完全被破坏、消失;黏膜下层结构破坏,细胞数量减少,肌层出血较前增多,可见大量炎性细胞,肌细胞严重受损;5D:肠系膜缺血6 h后病理图像(HE×8),肠壁各层结构明显受损,可见大量出血及炎性细胞充填,肌层细胞排列紊乱,内可见出血,缺血已累及到浆膜层,局部缺损,可见出血。注:IVIM:体素内不相干运动;DWI:扩散加权成像。Fig.1 IVIM(intravoxel incoherent motion)and pathological findings of the sham operation group 6 h after modeling.1Aand 1B:IVIM(b=1000 s/mm2)images and corresponding ADC images of the sham operation group 6 h after modeling,DWI(diffusion weighted imaging)showed slightly higher signal,ADC showed equal signal;1C:the diffusion signal attenuation curve of IVIM double-e exponential model in the sham operation group 6 h after modeling;1D:the pathological images of the sham operation group 6 h after modeling(HE×8).All layers of intestinal wall were clearly displayed,including mucosal layer,submucosal layer,muscular layer and serous layer from inside to outside.Fig.2-5 Intestinal IVIM and pathological manifestations at different time points in the experimental group.2A-5A,2B-5B:IVIM images(b=1000 s/mm2)of mesenteric ischemia at 2 h,4.5 h,5.5 h,6 h and corresponding ADC images,in which DWI showed high signal,corresponding ADC signal decreased,and signal changes were more obvious with the extension of ischemia time.2C,3C,4C and 5C:the diffusion signal attenuation curves of IVIM double-e exponential model after 2 h,4.5 h,5.5 h and 6 h of intestinal ischemia in the experimental group;2D:the pathological image of intestinal ischemia after 2 h(HE×8).The ischemia was confined to the mucosal layer,the epithelial cells of the mucosal layer were exfoliated,and a small amount of bleeding was observed in the lamina propria;3D:the pathological image of intestinal ischemia 4.5 h(HE×8),there was a large amount of bleeding in the mucosal layer and submucosal layer,some glandular structure destruction in the mucosal layer,and intestinal ischemia further involved the muscular layer,with a small amount of bleeding and inflammatory cell infiltration;4D:the pathological image of intestinal ischemia after 5.5 h(HE×8),the mucosal layer is obviously destroyed,and the lamina propria and glands are almost completely destroyed and disappeared;the submucosal structure was destroyed,the number of cells was reduced,the bleeding of muscle layer was increased,a large number of inflammatory cells could be seen,and the muscle cells were seriously damaged;5D:the pathological image of intestinal ischemia 6 h(HE×8);the structure of each layer of intestinal wall is obviously damaged,with massive hemorrhage and inflammatory cell filling,disordered arrangement of muscle layer cells,and bleeding can be seen inside.
实验组:随着肠壁缺血程度的加重,肠管逐渐扩张、内可见积液,DWI呈高信号,相应ADC信号减低,并且随着缺血程度的加重,信号改变更加明显。在AMI早期,缺血仅累及黏膜层,部分黏膜层上皮细胞脱落,可见少许炎性细胞浸润及少量出血;随着缺血进一步加重,进一步累及黏膜下层,黏膜下层结构疏松,毛细血管充血、扩张明显,炎性细胞浸润,黏膜下层可见一定程度的出血;随后累及到肌层,内可见出血及炎性细胞浸润;最终会累及肠壁全层,发生透壁性坏死(图2~5)。
2.2 实验组与假手术组的IVIM定量参数值的结果及比较
实验组与假手术组的IVIM 定量参数值的测定结果见表2。通过单因素方差分析比较实验组与假手术组不同时间节点的IVIM 定量参数值(f 值、D 值、D*值),以P<0.05 为差异有统计学意义,结果显示在肠系膜缺血不足1.5 h 时,实验组IVIM 各参数值和假手术组比较,差异无统计学意义(P>0.05)。当AMI 约2 h 时,实验组f 值和D 值低于假手术组,差异有统计学意义(P<0.05),D*值实验组及假手术组差异无统计学意义(P>0.05)。当AMI 达到4 h 时,f 值、D 值及D*值在实验组与假手术组间的差异有统计学意义(P<0.05)。当AMI 达到5.5 h 时,f 值近似于0,D 值明显升高,D*值较前大致相同,D 值及D*值在实验组与假手术组间的差异无统计学意义(P>0.05)。

表2 实验组与假手术组IVIM定量参数值的结果及比较Tab.2 Results and comparison of IVIM quantitative parameters between experimental group and sham group
2.3 实验组及假手术组IVIM 各参数值的时间变化曲线
实验组IVIM 定量参数值变化趋势(图6~8):在肠系膜缺血1.5 h以内,f值趋于稳定状态,与假手术组近似,随着缺血程度的不断加重,f 值减低,呈现下降的趋势,当AMI 时间超过5 h 后,f 值进一步降低趋向于0。D值在1.5 h之前变化不明显,当AMI时间超过1.5 h 时明显下降,随后保持低值状态,当AMI 时间超过5 h 后D 值明显升高,与假手术组近似。D*值在肠系膜缺血约2.5 h之前趋于稳定,和假手术组近似,随后呈现降低的趋势,当AMI 时间超过5 h 之后略升高,但是此时D*值低于肠系膜缺血早期。
假手术组IVIM 各定量参数值变化趋势(图6~8):f 值在各时间节点呈现小范围的波动,但整体变化不大;D 值与f 值相似,各时间节点在小范围内波动,差异不明显。D*值整体呈现下降的趋势。

图6 IVIM 定量参数f值随时间变化曲线。 图7 IVIM 定量参数D 值随时间变化曲线。 图8 IVIM 定量参数D*值随时间变化曲线。注:IVIM:体素内不相干运动。Fig.6 Time variation curve of f-value of IVIM quantitative parameter.Fig.7 Time variation curve of D-value of IVIM quantitative parameter.Fig.8 Time variation curve of D*-value of IVIM quantitative parameter.Note:IVIM:intravoxel incoherent motion.
3 讨论
AMI 是一种复杂的、多因素参与的疾病,其进展较快、并发症多、预后差、死亡率较高。现阶段AMI主要通过肠管扩张、肠壁增厚(变薄)、肠梗阻、肠系膜血管充盈情况、腹水等间接征象进行定性诊断,尚缺乏有效的手段进行定量分析[13-15]。IVIM 是基于双指数模型,通过参数值进行定量分析组织内血液微循环灌注的特性[16]。本研究基于IVIM 对家兔前肠系膜动脉栓塞所致的AMI 进行相应的研究,结果显示IVIM各参数的测定值与病理具有良好的相关性,可反映微循环障碍的病理生理过程,识别AMI 累及黏膜层、肌层甚至肠壁全层,有助于临床对AMI进行早期定量评估与动态监测,对临床救治的时间窗有一定的指导意义。
3.1 AMI的影像学评价方法及IVIM的优势
在临床中,AMI 较为凶险,且易引起肠道坏疽、急性腹膜炎及中毒性休克等并发症,早期诊断及识别病变程度,有助于疾病的治疗。目前AMI常用的影像学检查手段包括超声、CT及MR等[17],不同的方法因其成像特点对AMI 的评估价值也各不相同。既往研究[18-19]通过使用新型微气泡对比剂,监测AMI 的微循环灌注。该方法对超声检查仪器分辨率的要求较高,而且多普勒超声易受到肠壁水肿以及肠胀气的影响,对于检查者要求也比较高。CT 血管成像或数字减影血管造影只能反映肠系膜及肠壁的血供情况,无法评估肠壁的缺血程度[20-21]。此外,有研究者[22]通过MR 常规序列(脂肪抑制和非脂肪抑制的快速自旋回波T2WI)对小肠肠壁结构及肠系膜缺血进行研究,发现MRI能够比较清晰地显示小肠肠壁的结构分层,并且可对肠系膜缺血时肠壁各层变化进行评估。部分学者[23-24]使用7.0 T 微MR 扫描仪在动物模型中评估绞窄性小肠梗阻、肠系膜动脉缺血和肠系膜静脉缺血,但7.0 T 微MR 扫描仪限制了其在临床中进一步应用。Inoue 等[25]基于MR 平扫对绞窄性小肠梗阻及肠系膜静脉闭塞引起的肠系膜缺血进行了研究,结果显示两种模型的肠壁增厚、信号升高,但无法准确评估AMI 的缺血程度。上述影像学方法可在一定程度上监测AMI的微循环灌注情况,但仅能直观地反映肠道血管的改变,在判断肠道缺血损伤情况及缺血程度方面仍具有一定的局限性。
IVIM 成像技术具有实时、无创的特点,可反映组织内血液微循环灌注情况,以及对急性肠系膜缺血性疾病进行动态监测及评估[26]。本实验结果显示IVIM 定量参数f 值、D 值及D*值可以客观地反映肠壁的水分子扩散情况及血管微循环灌注情况,定量分析AMI的缺血程度。其次,IVIM无需使用对比剂就可以对肠壁早期缺血进行评估,较其他增强检查手段避免了对比剂对于检查者的损害,同时也降低了检查成本。
3.2 IVIM定量参数值与AMI病理特征的关系
D值:在本研究中,在AMI约2 h时,通过病理检查可见肠系膜缺血主要局限在黏膜层,表现为黏膜层上皮细胞的局部脱落,毛细血管扩张、充血以及炎性细胞的浸润等,此时D 值有明显的下降(约<1.0×10-3mm2/s),推测与肠系膜缺血病变部位明显的水分子扩散受限有关。因此,在AMI发生仅2 h时,可通过D值评估病变程度。随着缺血时间的延长,D值进一步降低,表明病变部位的扩散受限程度有进展,且当AMI 达到4.5 h左右(D值约<1.0×10-3mm2/s),病理检查可观察到显示肠系膜缺血已累及到固有肌层,肌层内毛细血管扩张、充血,肌细胞排列紊乱,肌纤维受损。除此之外,黏膜层腺体也出现一定程度的破坏、崩解。当AMI达到5.5 h左右时,D值可见升高(>1.0×10-3mm2/s),与假手术组近似,表明肠壁扩散受限程度有减轻,通过病理检查观察到黏膜固有层及腺体结构几乎完全被破坏、正常结构消失,肠壁出现一定程度的坏死,肌层进一步受累,内可见出血及炎性细胞浸润,且当缺血6 h 时肠壁全层正常结构消失,出现透壁性坏死。因此,当AMI 的病变累及到黏膜层时,D 值降低,表明组织内水分子扩散功能受限,但在进一步区分病变累及肠壁范围方面具有一定的局限性。
f 值:在本研究中,在AMI 的前1.5 h,f 值的下降不明显,可能与机体在缺血早期有一定的代偿功能有关。在肠系膜缺血2 h,f 值有显著降低(f 值<0.3),可能与肠壁缺血一定时间后,微循环灌注减低,其占总体扩散效应的比例也相应减低有关。随着肠系膜缺血时间的延长,f值持续下降,在缺血4.5 h左右(0.1<f值<0.3),病理检查显示缺血累及到肌层;在缺血5.5 h 左右,f 值趋向于0,可观察到肠壁各层组织均出现一定程度的坏死,推测此时肠管可能完全丧失微循环灌注。因此,f 值可以反映AMI 不同发生发展阶段的累及范围,能够区分病变是否累及到黏膜层、肌层及浆膜层。
D*值:在实验组与假手术组间,D*值显著差异最早出现在肠系膜缺血后的4 h左右,此时肠壁缺血已累及到黏膜下层,因此D*值的敏感性不如f值和D值。
3.3 IVIM定量评估AMI的价值及对临床诊疗的意义
D 值及f 值可以反映AMI 的弥散和灌注特性,且二者的变化趋势与病理结果改变相关,表明IVIM 可用于AMI 的定量评估与动态监测,联合D 值及f 值诊断意义更大。当D值<1.0×10-3mm2/s且0.1<f值<0.3 时,肠壁缺血仅累及黏膜层或同时累及黏膜下层,尚未累及到肌层,此时及时进行相应的治疗,恢复肠道供血,肠壁损伤及肠道功能可恢复,一般不会引起肠道功能的紊乱,此时为临床最佳治疗时间[27-28]。当D值<1.0×10-3mm2/s且0<f值<0.1时,此时缺血已累及肌层,平滑肌痉挛进而瘫痪,出现肌纤维的中断、分离、核变性,进而出现凝固性坏死,此时若进行相应的治疗,由于肠道肌层对于缺血的耐受力较强,肌层由纤维组织和肉芽组织修复,最终引起肠壁的增厚、肠腔的狭窄进而引起肠道功能的减退。该阶段并发症相对较少,死亡率较低,仍然处在临床有效治疗的时间范围内[29-30]。当f 值近似于0 且D 值>1.0×10-3mm2/s 时,表示此时肠壁已完全失去血供,肠壁肌层破坏严重甚至累及全层,可发生坏疽甚至穿孔,引起急性腹膜炎甚至出现中毒性休克,死亡率极高[31]。因此,结合IVIM 定量参数中的D 值和f值,能够早期、无创评估AMI的病变程度,对临床救治的时间窗有一定的指导意义。
3.4 本研究的局限性
本研究的局限性有以下几点:(1)家兔肠管管壁较薄,选取ROI时肠管内积液及腹腔内脂肪组织对其会有一定的影响;(2)对于IVIM 图像ROI 选取及病理标本的选取在操作过程中虽尽量保持较高的一致性,但无法达到绝对的匹配;(3)本研究中各时间节点的样本量较少,结果存在一定的误差,有待扩大样本量做进一步研究。
综上所述,IVIM 定量参数中f 值及D 值能够反映微循环障碍的病理生理过程,与病理具有良好的相关性,有助于AMI的早期定量评估与动态监测,为临床早期、无创评估病变缺血程度提供理论依据和新手段。
作者利益冲突声明:全部作者均声明无利益冲突。