马兜铃酸Ⅰ对大鼠五脏的毒性及功能影响
汪 瑶,燕 鸽,刘智慧,王 玉,辛全超,曹新悦,于文会,2,姜晓文
(1.东北农业大学动物医学学院,哈尔滨150030;2.东北农业大学中兽医研究所,哈尔滨 150030)
马兜铃科属的植物大多数生长在温带或温热带,据统计,在全世界范围内生长的约有450多种,在中国现有56种[1]。大多数马兜铃科属中药都具有止咳平喘、行气活血、舒经止痛等功效[2]。马兜铃味苦,性微寒,归肺脏、大肠经,具有止咳、平喘、祛痰、抗炎、抗菌等功效[3]。一些马兜铃科属的植物具有毒性,毒性大小与自身所含的马兜铃酸(aristolochic acids,AA)密切相关。AA是一类硝基菲类有机酸类化合物,由于羟基和甲氧基在骨架上出现的位置不同,导致AA类化合物种类繁多[4],其毒性大小也不相同。最常见的AA类化合物是AA-Ⅰ和AA-Ⅱ(图1)及马兜铃内酰胺Ⅰ(aristololactams-Ⅰ,AL-Ⅰ),其中AA-Ⅰ与AL-Ⅰ为马兜铃属植物中毒性最强的成分[5]。AA-Ⅰ具有较强的毒性,而AL-Ⅰ的毒性更强[6-7]。AA-Ⅰ与DNA形成DNA加合物,使A/T碱基对发生易位[8],从而导致肿瘤发生[9]。尽管《中国药典》已将关木通、天仙藤等含AA含量较高的中药删除,但是《中国兽药典》第5版仍收录了关木通、天仙藤、马兜铃、朱砂莲等中药,其中以朱砂莲中AA-Ⅰ含量最高[10]。

图1 AA-Ⅰ(A)和AA-Ⅱ(B)结构图
有报道称,AA-Ⅰ是巴尔干地方性肾病临床综合征的病原体[11]。1962年,吴松寒[12]首次发现AA具有肾脏毒性,后来Vanherweghem将其命名为“中草药肾病”[13]。目前,AA肾脏损伤的发病机制研究尚不明确,但国内、外学者就AA造成慢性肾间质纤维化的结论较为一致[14-15]。氧化应激是AA-Ⅰ引起肾脏毒性的重要途径,AA-Ⅰ暴露会损害肾脏的抗氧化防御系统,导致肾小管上皮细胞线粒体损伤、细胞凋亡和自噬等,进而导致肾功能衰竭[16-20]。因此,马兜铃属类中药用药安全必须引起兽医师的高度关注。依据中药归经的特性,AA进入机体后在五脏的分布可能存在靶向性。为了探究AA进入机体后在五脏的含量及其相应的毒性关系,本试验以大鼠为研究对象,通过给大鼠灌服AA-Ⅰ检测AA-Ⅰ、AL-Ⅰ在五脏中出现的时间及含量,以及对五脏功能影响的评价,以期为今后含有AA类中药的临床用药安全提供参考。
1 材料与方法
1.1 材料
8周龄健康成年雄性SD大鼠33只(200 g±20 g)购自辽宁长生生物科技有限公司(No.SCXK 2020-0001)。在22 ℃±2 ℃下进行12 h光照/黑暗循环,自由进食标准颗粒饲料和饮用水。试验前适应性饲养1周。
AA-Ⅰ(纯度≥96%,CAS号313-67-7)和AL-Ⅰ(纯度≥98%,CAS号13395-02-3)均购自南京道斯夫生物科技有限公司。试验所用化学试剂均为色谱纯。
1.2 AA-Ⅰ及AL-Ⅰ在大鼠五脏中的方法学确定
用甲醇精准配制浓度为50 μg/mL的AA-Ⅰ和AL-Ⅰ储备液,密封后置于4 ℃保存备用。各取20 μL储备液及两者各10 μL混合储备液作为标准品,用于HPLC的检测。取AA-Ⅰ和AL-Ⅰ储备液适量,加甲醇稀释分别制得1.0、2.5、5.0、10.0、20.0和30.0 μg/mL的梯度溶液。取0.1 mL不同浓度AA-Ⅰ和AL-Ⅰ对照品储备液,分别加入到0.3 g空白对照组的五脏组织中进行匀浆,涡旋混匀10 s后分别按以下方法处理样品:取含有不同浓度对照品储备液的五脏组织匀浆,加入2 mol/L HCl 100 μL酸化,涡旋混匀10 s,加入50倍95%乙醇旋涡混匀3 min,再以3 000 r/min离心15 min,静置后吸取上清液于真空干燥箱中烘干,残渣以甲醇复溶并过滤,吸取20 μL用于HPLC检测。色谱条件为:色谱柱:Hypersil BDS(C18,5 μm);柱温:25 ℃;检测波长:390 nm;进样量:20 μL;流动相:甲醇∶水∶冰醋酸(70∶30∶0.5,V/V/V);流速:1 mL/min;时间:15 min。
1.3 高效液相法检测大鼠五脏中AA-Ⅰ及AL-Ⅰ含量
1.3.1 试验动物分组及样品采集 取健康雄性SD大鼠21只,分为2组,AA-Ⅰ组18只,空白对照组3只,试验前适应性饲养1周,给药前禁食至少12 h。AA-Ⅰ用聚乙二醇(PEG)进行稀释,以20 mg/kg体重剂量灌服大鼠[21],空白对照组只灌胃PEG,每天一次,连续给药7 d,分别在末次给药后0.2、0.5、1、2和24 h各随机剖杀3只大鼠,空白对照组于第8天剖杀,取心脏、肝脏、脾脏、肺脏、肾脏经预处理后采用HPLC法检测AA-Ⅰ及AL-Ⅰ在各组织中的浓度。停药后15 d[22],再剖杀3只大鼠,通过预处理后采用HPLC法测量AA-Ⅰ及AL-Ⅰ在各组织中的浓度。
1.3.2 组织样品前处理 取各组织0.3~1 g,按照1∶3(W/V)加入生理盐水进行研磨,制备组织匀浆液。取100 μL组织匀浆液,加入2 mol/L HCl 100 μL酸化,旋涡混匀10 s,加入50倍95%乙醇旋涡混匀3 min,8 000 r/min离心15 min,取上清液,45 ℃真空干燥回收,残渣以2 mL甲醇超声复溶,过0.22 μm滤膜,取20 μL进行HPLC分析。
1.3.3 色谱条件 色谱柱为Hypersil BDS C18(2.1 mm×50 mm,5 μm,美国赛默飞科技有限公司),流动相:甲醇∶水∶冰醋酸(70∶30∶0.5,V/V/V);检测波长:390 nm;柱温:25 ℃;进样量:20 μL。
1.4 AA-Ⅰ对大鼠五脏毒性检测
1.4.1 试验动物分组及样品采集 取健康雄性SD大鼠12只,分为2组,AA-Ⅰ组和空白对照组各6只。以20 mg/kg体重剂量连续给药7 d后,于第8天两组各随机取3只大鼠,眼眶取血,部分置于肝素锂管中留取全血进行血气和血常规检测;部分置于离心管室温静置30 min后,于4 ℃、3 000 r/min离心15 min,取血清进行生化检测。之后断颈处死,采集心脏、肝脏、脾脏、肺脏和肾脏,部分保存于4%甲醛溶液中备用;部分用生理盐水冲洗净后于―80 ℃保存备用。剩余大鼠停药15 d后,以相同方法采集全血,分离血清,采集五脏组织。
1.4.2 心脏、肝脏及肾脏功能检测 取50 μL血清于1 mL离心管中,用半自动生化测定仪(深圳市盛信康科技有限公司)检测肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、血清尿素氮(blood urea nitrogen,BUN)及肌酐(creatinine,Cre)指标。
1.4.3 肺脏功能检测 取1 mL动脉血于肝素锂离心管中,用血气分析仪(北京冠远科技有限公司)检测pH、动脉血氧分压(PaO2)和二氧化碳分压(PaCO2)指标。
1.4.4 脾脏功能检测 取脾脏组织进行组织匀浆,通过肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白细胞介素1(interleukin-1,IL-1)试剂盒(南京建成生物工程研究所)检测分析。
1.4.5 五脏氧化应激损伤的检测 分别取0.1 g组织样品,加入预冷的生理盐水900 μL,匀浆后得到10%组织匀浆,3 000 r/min离心10 min,收集上清。按照试剂盒(南京建成生物工程研究所)说明书检测各组织的丙二醛(malondialdehyde,MDA)含量(TBA法)、超氧化物歧化酶(superoxide dismutase,SOD)活性(羟胺法)、总抗氧化能力(total antioxidant capacity,T-AOC)及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性(比色法),测定相应的D值,并计算抗氧化指标。
1.4.6 五脏病理组织的检测 肉眼观察各组织样的组织病变,每组采集同一只大鼠的心脏、肝脏、脾脏、肺脏、肾脏,用4%甲醛溶液固定,制作石蜡切片,并进行HE染色,通过光学显微镜观察切片病理变化。
1.5 统计分析
使用SPSS 22.0软件对试验数据进行单因素方差法分析(One-Way ANOVA),结果用平均值±标准差表示。P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 AA-Ⅰ和AL-Ⅰ在大鼠五脏中的方法学结果
AA-Ⅰ和AL-Ⅰ标准品出峰时间分别约为7.1和8.9 min,且两者混合后测得相应时间段峰值可良好区分。AA-Ⅰ和AL-Ⅰ标准品浓度分别在12.5~50和6.25~25 μg/mL范围内,样品的峰面积与浓度均呈正相关,线性关系良好,R2均>0.99(表1),且五脏中AA-Ⅰ和AL-Ⅰ标准品的精密度、稳定性、回收率均符合要求。

表1 AA-Ⅰ和AL-Ⅰ在大鼠五脏中的回归方程
2.2 AA-Ⅰ和AL-Ⅰ在大鼠五脏中的含量
由表2可知,末次给药后0.25 h,在大鼠心脏、肝脏、脾脏及肺脏中均检测到AA-Ⅰ,其中肝脏中含量最高,此时在肝脏和脾脏中均检测到AL-Ⅰ,且肝脏中含量高于脾脏;末次给药后0.5 h,在五脏中均检测到AA-Ⅰ,其中在肝脏中含量最高,肾脏次之,此时肝脏、肺脏及肾脏中均检测到AL-Ⅰ,其中肝脏中含量最高,肾脏次之;末次给药后1 h,在肝脏和肺脏中检测到AA-Ⅰ,且肺脏中含量高于肝脏,此时只在肝脏中检测到AL-Ⅰ;末次给药后2 h,在心脏、肝脏、肺脏及肾脏中检测到AA-Ⅰ,其中肝脏中含量最高,此时只在肾脏中检测到AL-Ⅰ;末次给药后24 h,在心脏和肝脏中检测到AA-Ⅰ,此时只在肝脏中检测到AL-Ⅰ;停药后15 d,五脏中均未检测到AA-Ⅰ和AL-Ⅰ。
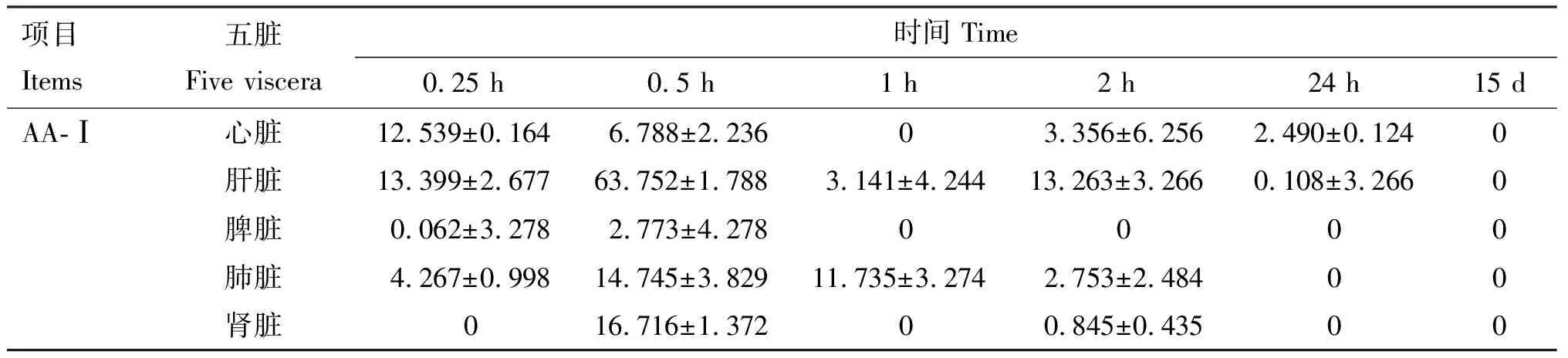
表2 大鼠五脏中AA-Ⅰ和AL-Ⅰ含量
2.3 AA-Ⅰ对大鼠五脏毒性检测结果
2.3.1 心脏毒性 由表3可知,连续给药7 d并停药15 d后,给药组大鼠心脏中CK含量极显著高于空白对照组(P<0.01),而停药后15 d与空白对照组间无显著差异(P>0.05);给药组与停药后15 d LDH含量均极显著高于空白对照组(P<0.01);给药组GSH-Px、SOD活性及T-AOC均极显著或显著低于空白对照组(P<0.01;P<0.05);停药后15 d GSH-Px活性显著低于空白对照组(P<0.05),SOD活性、T-AOC低于空白对照组,但无显著性差异(P>0.05);给药组MDA含量极显著高于空白对照组(P<0.01),停药后15 d低于空白对照组,但无显著性差异(P>0.05)。

表3 AA-Ⅰ对大鼠心脏毒性检测
2.3.2 肝脏毒性 由表4可知,连续给药7 d并停药15 d后,给药组与停药后15 d大鼠肝脏中AST、ALT活性均显著或极显著高于空白对照组(P<0.05;P<0.01);给药组与停药后15 d GSH-Px和SOD活性均显著或极显著低于空白对照组(P<0.05;P<0.01);给药组T-AOC显著低于正常对照组(P<0.05),而停药后15 d低于空白对照组,但无显著性差异(P>0.05);给药组MDA含量极显著高于空白对照组(P<0.01),而停药后15 d与空白对照组间无显著差异(P>0.05)。
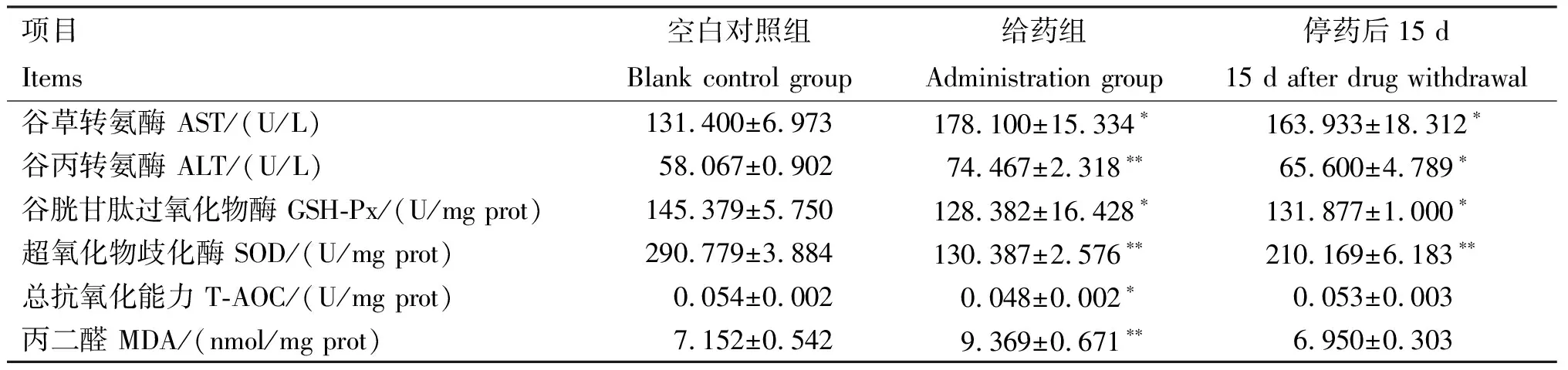
表4 AA-Ⅰ对大鼠肝脏毒性检测
2.3.3 脾脏毒性 由表5可知,连续给药7 d并停药15 d后,给药组大鼠脾脏中IL-1、TNF-α含量均极显著高于空白对照组(P<0.01);给药组与停药后15 d GSH-Px和SOD活性均极显著低于空白对照组(P<0.01),给药组T-AOC显著低于空白对照组(P<0.05),停药后15 d低于空白对照组,但无显著性差异(P>0.05);给药组MDA含量极显著高于空白对照组(P<0.01),停药后15 d高于空白对照组,但差异不显著(P>0.05)。
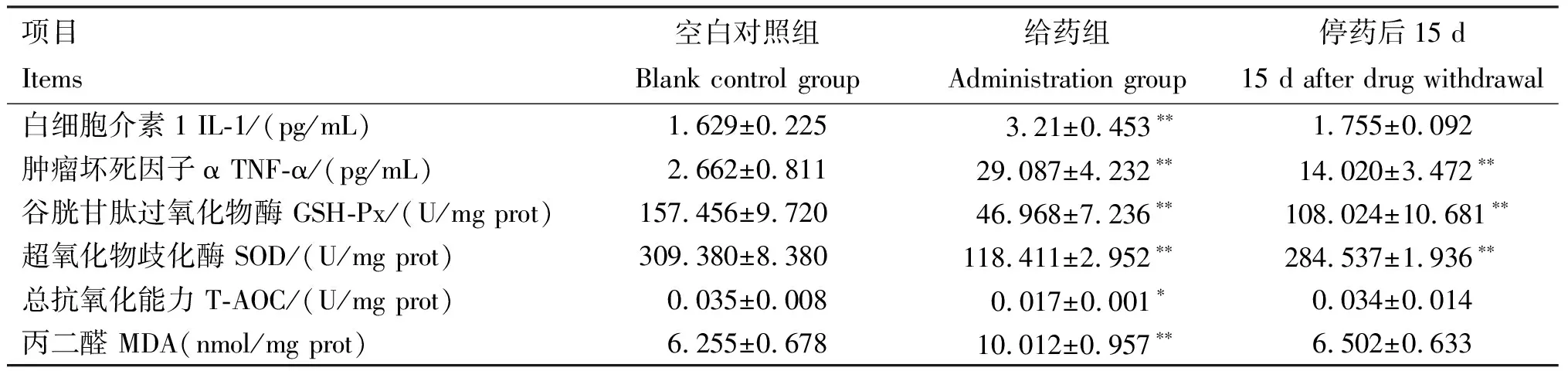
表5 AA-Ⅰ对大鼠脾脏毒性检测
2.3.4 肺脏毒性 由表6可知,连续给药7 d并停药15 d后,给药组和停药后15 d大鼠肺脏中PaCO2和PaO2均极显著或显著低于空白对照组(P<0.01;P<0.05);给药组与停药后15 d GSH-Px、SOD活性均极显著或显著低于空白对照组(P<0.01;P<0.05);给药组T-AOC极显著低于空白对照组(P<0.01),停药后15 d低于空白对照组,但无显著性差异(P>0.05);给药组MDA含量极显著高于空白对照组(P<0.01),停药后15 d高于空白对照组,但差异不显著(P>0.05)。

表6 AA-Ⅰ对大鼠肺脏毒性检测
2.3.5 肾脏毒性 由表7可知,连续给药7 d并停药15 d后,给药组与停药后15 d大鼠肾脏中BUN、CRE含量均极显著高于空白对照组(P<0.01);给药组与停药后15 d肾脏中GSH-Px、SOD活性均极显著低于空白对照组(P<0.01);给药组肾脏中T-AOC显著低于空白对照组(P<0.05),停药后15 d低于空白对照组,但无显著性差异(P>0.05);给药组肾脏中MDA含量显著高于空白对照组(P<0.05),而停药后15 d与空白对照组间无显著差异(P>0.05)。
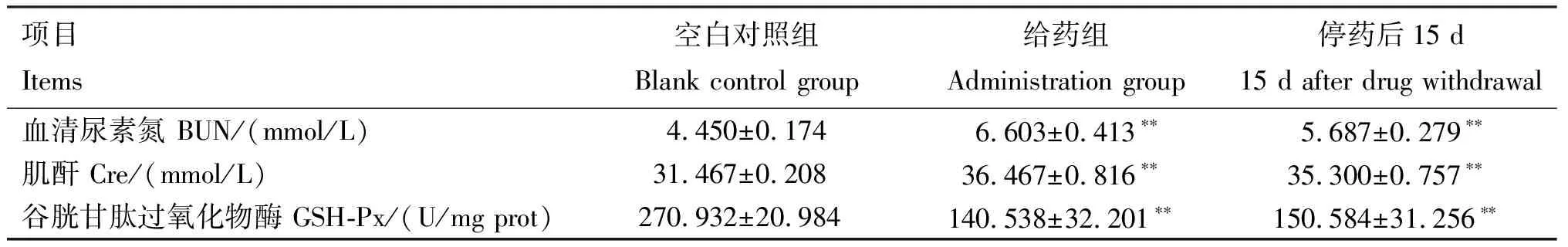
表7 AA-Ⅰ对大鼠肾脏毒性检测
2.3.6 大鼠五脏组织学检测结果 由图2可知,给药组大鼠心脏偶见颗粒变性和空泡变性,而停药后15 d大鼠心脏心肌肥大;给药组大鼠肝细胞水样变性,胞浆呈空壳状,可见小灶状坏死和胞浆浸润,少量肝细胞弥漫性气球样变,胞质呈颗粒状变性,而停药后15 d肝小叶排列清楚,周围肝细胞出现弥漫性水样变性;给药组大鼠和停药后15 d大鼠同空白对照组的脾脏相比未见异常;给药组大鼠部分肺脏组织可见肺间质炎性改变,肺泡壁增厚并有炎性细胞浸润,并可见炎症,肺脏组织代偿性肺气肿,肺泡壁断裂,融合成大腔,而停药后15 d大鼠肺脏偶见肺泡壁增厚,有炎性细胞浸润,局部有代偿性肺气肿;给药组大鼠肾小管上皮细胞水样变性,停药后15 d大鼠肾间质炎症,有炎性细胞浸润,肾小管结构消失,也可见肾小管上皮细胞水样变性。
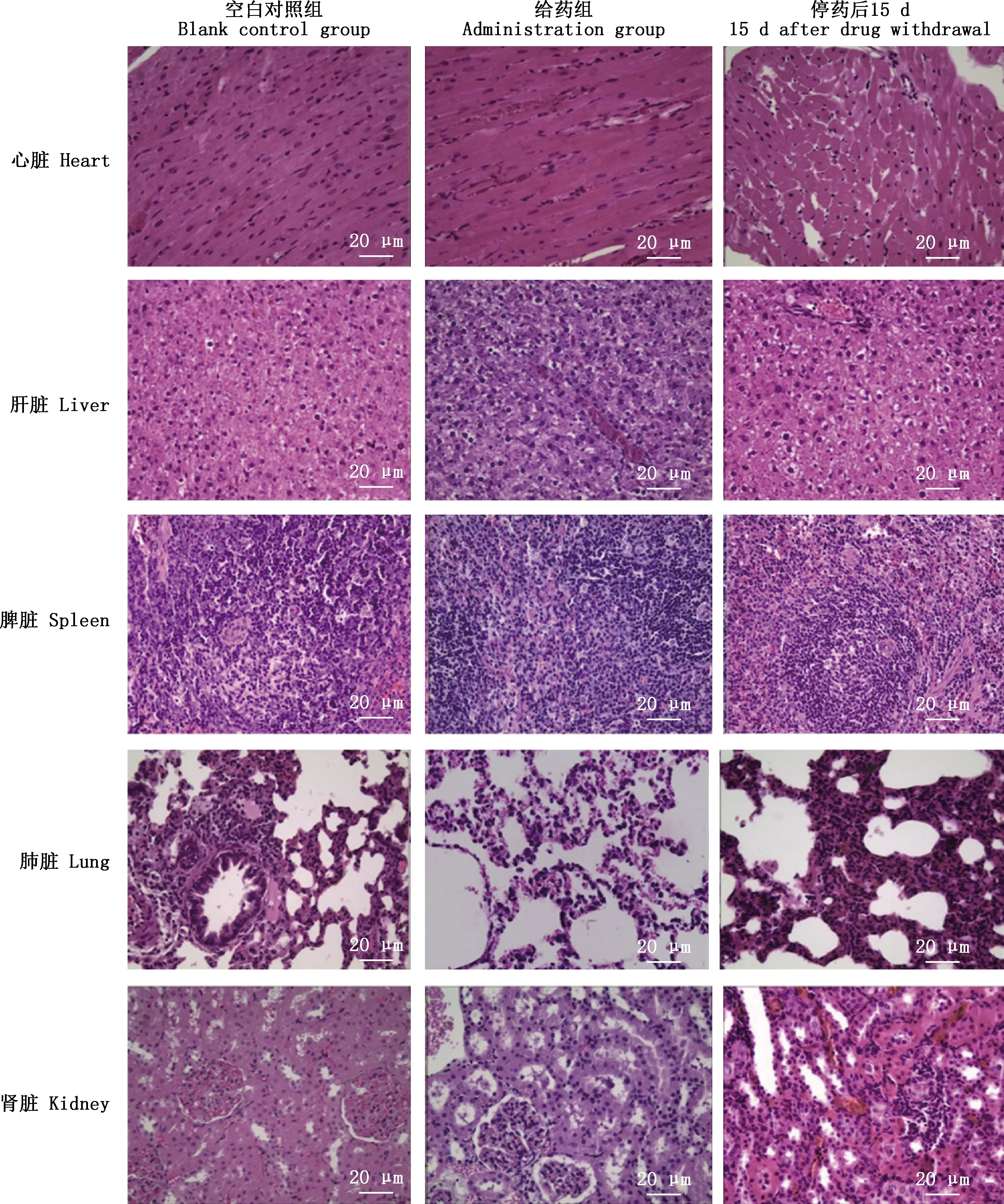
图2 大鼠五脏组织病理学观察(400×)
3 讨 论
用建立的HPLC方法测定大鼠五脏中的AA-Ⅰ及AL-Ⅰ,结果表明,在相应浓度范围内各标准品峰面积与浓度线性关系良好,能反映给药后不同时间点AA-Ⅰ及AL-Ⅰ在体内的归经和代谢情况,同时通过方法学验证,其精密度、稳定性和回收率均符合要求,因此AA-Ⅰ及AL-Ⅰ体内检测方法准确可行。末次给药后0.25 h,除肾脏外,其余四脏均检测到AA-Ⅰ,其中肝脏含量最高,而AL-Ⅰ只在肝脏与脾脏中检测到,肝脏中含量依然高于脾脏;末次给药后0.5 h,五脏中均检测到AA-Ⅰ,其中肝脏中含量最高,肾脏中含量次之;而AL-Ⅰ在肝脏、肺脏与肾脏中均可检测到,其中肝脏含量最高,其次是肾脏,AA-Ⅰ在肾脏内积聚会造成肾功能损害;末次给药后1 h,只在肝脏和肺脏检测到AA-Ⅰ,此时肺脏中含量高于肝脏,而AL-Ⅰ在肝脏中可检测到;末次给药后2 h,除脾脏外,其余四脏均可检测到AA-Ⅰ,含量最高的为肝脏,而AL-Ⅰ只在肾脏中检测到;末次给药后24 h,AA-Ⅰ只在心脏与肝脏中检测到,此时AL-Ⅰ只在肝脏中检测到;停药后15 d,五脏中虽然检测不到AA-Ⅰ及AL-Ⅰ,但五脏损伤没有得到较好修复,与空白对照组相比仍差异显著。马兜铃酸的主要靶器官为肝脏和肾脏,本试验中,末次给药后1 h在心脏、肾脏中均没有检测到AA-Ⅰ,而在末次给药后2 h检测到AA-Ⅰ;末次给药后2 h在肝脏中没有检测到AL-Ⅰ,而在末次给药后24 h却检测到AL-Ⅰ;末次给药后1 h在肾脏中没有检测到AA-Ⅰ,而在末次给药后2 h检测到AA-Ⅰ。推测是AA-Ⅰ转化成AL-Ⅰ的酶存在于肝脏中。研究表明,在NADPH∶醌氧化还原酶1(NQO1)作用下,AA-Ⅰ在肝脏中转化为N羟基马兜铃内酰胺,然后在硫酸基转移酶(SULTs)的作用下再次硫酸化,并被多药耐药相关蛋白(MRP)转运到肾脏发挥肾毒性[22-23]。这可能是在肾脏和心脏中有些时间点没有检出AA-Ⅰ的原因。从AA-Ⅰ及AL-Ⅰ在五脏中的检测结果看,AA-Ⅰ及AL-Ⅰ主要蓄积在肝脏和肾脏,AA-Ⅰ可能在肝脏或肾脏发生生物转化[16],但是否在肝脏和/或肾脏均可发生生物转化鲜见报道,有待进一步研究。停药15 d后检测发现,各个脏器中均检测不到AA-Ⅰ和AL-Ⅰ,可能原因就是检测限限制或者是AL-Ⅰ形成了DNA加合物,无法通过HPLC检测出来,因此还需要今后进一步的检测。
有毒物质诱发的氧化应激可破坏细胞的抗氧化系统,诱导活性氧(ROS)大量蓄积,从而引起机体一系列的自我调控,导致细胞产生损伤和抵御能力的加强[24-25]。机体利用自身抗氧化酶系统能够很好地对抗氧自由基,实现抗氧化目的,而机体中主要的抗氧化酶就是SOD、T-AOC和GSH-Px,这类抗氧化酶能够很大程度地平衡抗氧化系统和氧化系统,也是最常见的衡量抗氧化能力指标[26];作为细胞质过氧化的直接产物,MDA含量是说明机体氧化应激损伤程度的指标[27]。本研究发现,给药组与停药后15 d五脏中GSH-Px、SOD活性及T-AOC均低于空白对照组,说明AA-Ⅰ会导致机体抗氧化酶活性降低,从而诱发五脏出现明显损伤。研究表明,AA-Ⅰ通过氧化应激诱导了DNA损伤,AA-Ⅰ治疗人早幼粒细胞白血病细胞(HL-60)和人肾近端小管细胞(HK-2)导致ROS的剂量依赖性增加[28]。AA导致的肾小管坏死属肾阳虚证,机体的氧化应激损伤是其主要致病机制[29]。给药组五脏中MDA含量均极显著高于空白对照组,也同样说明AA-Ⅰ可诱导机体氧化应激。
AA-Ⅰ可导致肝脏、肾脏、心脏损伤,这些损伤在其组织病理学上得到了认证。有报道表明,AA-Ⅰ引起氧化应激导致肝脏损伤[30]和肾脏损伤[31];AA-Ⅰ可通过炎症介导引起石斑鱼的心脏衰竭[32-33]。血气指标PaCO2、PaO2反映了肺脏的呼吸功能[34],给药组与停药后15 d均极显著或显著低于空白对照组,说明AA-Ⅰ可致肺脏损伤;肺脏的病理切片可见肺间质炎性细胞浸润,肺泡壁增厚,局部有代偿性肺气肿,肺泡壁断裂,融合成大腔等病理变化;且AA-Ⅰ可能会引起肺肿瘤的发生[35-36]。脾脏是机体最大的外周免疫器官,与炎症密切相关。AA-Ⅰ可引起脾脏中炎症指标IL-1和TNF-α含量增加,但给药期和停药后15 d大鼠与空白对照组相比脾脏均未见异常,表明AA-Ⅰ虽然诱发了炎性反应,但脾脏并不是AA-Ⅰ的靶器官。因此,AA-Ⅰ主要归肺、肝、肾、心经,用量过大,可造成肺脏、肝脏、肾脏和心脏产生一定的损伤。本研究在肝脏、肾脏及肺脏中均检测到了AL-Ⅰ,特别是在肝脏和肾脏中多次检测到了AL-Ⅰ,表明AA-Ⅰ在大鼠体内转化成AL-Ⅰ,推测肝脏或肾脏可能是AA-Ⅰ转化AL-Ⅰ的主要场所。研究报道,AA-Ⅰ在肝脏或肾脏中可发生DNA加成,这是AA-Ⅰ引起肝脏和肾脏发生癌变的主要原因[37]。因此,探究AA-Ⅰ的作用靶点、AL-Ⅰ生物转化部位与转化条件,以及AL-Ⅰ与DNA加成的作用靶点,将是未来AA-Ⅰ毒性研究的重点与难点,对马兜铃酸类中药在畜禽中的用药安全具有重要意义。
4 结 论
给大鼠连续7 d灌服20 mg/kg AA-Ⅰ,在五脏中均可检测到不同含量的AA-Ⅰ,且在肝脏、肾脏、肺脏、脾脏中可检测到AL-Ⅰ;口服AA-Ⅰ可能对大鼠五脏造成不同程度的损伤,其损伤与AA-Ⅰ诱发的氧化应激相关。

