宽谱大肠杆菌O157∶H7 CVCC4050噬菌体vB_EcoM_GXBP08的分离鉴定及特性分析
周雨晴,马东鑫,吴 洁,王晓晔
(1.广西大学动物科学技术学院,南宁530004;2.防城港市行政审批服务中心,防城港 538000)
肠出血性大肠杆菌(EHEC)是近年来新发现的可引起较严重的健康危害的致病菌。大肠杆菌O157∶H7是EHEC中最常见的致病性大肠杆菌血清型,能引起人类出血性腹泻,并发溶血性尿毒综合征(HUS)、血栓性血小板减少性紫癜(TTP)等,老人和儿童并发HUS时病死率可高达50%[1]。自20世纪80年代初,首起由大肠杆菌O157∶H7引发的食源性疾病暴发以来,大肠杆菌O157∶H7引起学者的广泛关注。大肠杆菌O157∶H7在被污染的水、乳制品、果蔬中的检出率较高,导致食源性疾病的频繁发生[2]。近年来,由于抗生素的滥用,大肠杆菌O157∶H7对于抗生素的耐药性日趋严重[3],迫切需要开发一种有效的替代抗生素的新方法来控制大肠杆菌的污染和危害。目前,噬菌体的生物防治方法越来越被认为是减少细菌污染的前瞻性策略。与传统的抗菌剂相比,噬菌体具有易获得性、特异性、无毒性和对环境无害等优点[4],但大多数噬菌体只能抑制一株宿主菌的生长,从而限制了噬菌体的广泛应用。因此,宽谱噬菌体的概念(即一株噬菌体能够裂解多株细菌)被提出。目前,已知的宽谱大肠杆菌O157∶H7噬菌体相对较少。本研究分离并鉴定了1株宽谱大肠杆菌O157∶H7噬菌体vB_EcoM_GXBP08,并测定了该噬菌体的生物学特性和全基因组特征,为深入研究噬菌体与细菌的相互作用机制奠定理论基础,为防治大肠杆菌O157∶H7在食品业、养殖业中的感染提供新方法。
1 材料与方法
1.1 材料
1.1.1 菌株和噬菌体来源 宿主菌大肠杆菌O157∶H7 CVCC4050和用于宿主谱测定的大肠杆菌O8∶K88 CVCC1527、肠炎沙门氏菌CVCC1806、鼠伤寒沙门氏菌CVCC3384均购自中国兽医微生物菌种保藏管理中心(CVCC);用于宿主谱分析的其他菌株为广西大学动物科学技术学院临床实验室保存;分离噬菌体的污水采集自广西壮族自治区南宁市某猪场。
1.1.2 主要试剂 LB固/液体培养基、伊红美蓝培养基、SS琼脂培养基、PEG8000、脱氧核糖核酸酶Ⅰ均购自北京索莱宝科技有限公司;NaCl和MgSO4均购自天津市科密欧化学试剂有限公司;细菌DNA提取试剂盒购自天根生化科技(北京)有限公司;0.22 μm微孔滤膜购自天津津腾实验设备有限公司;肠道致病性大肠杆菌诊断血清购自宁波天润生物药业有限公司。
1.2 方法
1.2.1 噬菌体分离纯化 采集猪场化粪池中污水样品,利用不同滤膜孔径大小除菌的方法获得含有噬菌体的原液[5]。采用双层琼脂平板法检测和筛选裂解性噬菌体,挑取单个噬菌斑反复进行多次单斑分离以纯化噬菌体,直至双层琼脂平板上的噬菌斑透亮,形态、大小一致,即纯化完成。采用双层琼脂平板法测定纯化后噬菌体的效价[6]。
1.2.2 噬菌体透射电镜观察 噬菌体浓缩方法参考《分子克隆实验指南》中的聚乙二醇沉淀法[7]。将纯化浓缩后的噬菌体采用2%磷钨酸(PTA,W/V)染色后,使用透射电子显微镜观察形态学特征[8]。
1.2.3 噬菌体宿主谱的测定 将35株大肠杆菌和4株沙门氏菌用于噬菌体宿主谱的分析,采用空斑试验进行测定,具体方法为:将100 μL大肠杆菌菌液加入到3 mL LB半固体培养基中,颠倒混匀后均匀倒入LB固体培养基上,待其晾干后,吸取10 μL噬菌体悬液滴加在菌苔表面,滴加等量生理盐水作为对照,待液滴干燥后倒置于37 ℃培养箱中培养10~12 h[9],观察结果。
1.2.4 噬菌体生物学特性分析 取新鲜培养的宿主菌菌液,按照感染复数(multiplicity of infection,MOI)分别为100、10、1、0.1、0.01和0.001加入噬菌体裂解液和宿主菌菌液,利用双层琼脂平板法测定效价并评估噬菌体最佳MOI[10]。参考Shende等[11]方法测定噬菌体的一步生长曲线;参考Zhang等[12]方法测定温度稳定性及不同pH条件下噬菌体的酸碱稳定性。
1.2.5 噬菌体杀菌效力测定 根据Zhang等[13]方法研究不同MOI下噬菌体在液体培养基中的杀菌效果。以大肠杆菌O157∶H7 CVCC4050为宿主菌,培养过夜并稀释到1×108CFU/mL,取无菌试管12根,对照组(无噬菌体组)加入4 mL菌液和4 mL培养液,试验组按照MOI为1、0.1、0.01分别加入4 mL菌液和4 mL不同浓度的噬菌体悬液,混匀后置于摇床中(37 ℃、180 r/min)震荡,每隔1 h测一次细菌浓度D600 nm值。每个MOI做3个平行,测16 h。
1.2.6 噬菌体全基因组分析 运用碱裂法提取噬菌体DNA[13],并用1.2%琼脂糖凝胶电泳检测基因组的完整性。基因文库构建和全基因测序均由北京化工大学实验室完成。使用GeneMarkS软件对噬菌体全基因组进行基因预测。非编码RNA的预测主要通过与Rfam数据库进行比对获得;使用RAST server[14]和BLASTN[15]对开放阅读框(ORF)和蛋白质编码(CDS)序列进行预测和注释;通过毒力因子数据库[16]和抗生素耐药综合数据库[17]筛选假定的毒力因子和抗生素耐药性基因等;使用CGView Server[18]软件绘制噬菌体全基因组圈图;基于包括分离噬菌体在内的20个噬菌体的主要衣壳蛋白构建系统发育进化树;利用MegaX软件对噬菌体进行进化分析;利用Easyfig_2.2.5_win软件绘制噬菌体基因组多重线性比对图。
2 结 果
2.1 噬菌体形态鉴定
以大肠杆菌O157∶H7 CVCC4050为宿主菌分离得到1株噬菌体,经过6~8次纯化后能形成大小一致、清澈透亮、边缘整齐无晕圈的噬菌斑,直径约为4 mm(图1A)。经透射电镜观察发现,该噬菌体有1个呈多面体对称的头部,直径约为72 nm;有一个长约140 nm、宽约10 nm的尾部,尾鞘可收缩(图1B)。根据国际病毒分类委员会分类规则判定,该噬菌体属于有尾病毒目肌尾病毒科T4-like噬菌体属,将该噬菌体命名为vB_EcoM_GXBP08。
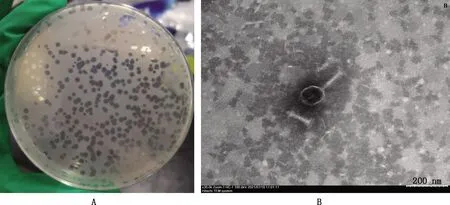
A,噬菌体vB_EcoM_GXBP08的噬菌斑;B,噬菌体vB_EcoM_GXBP08的透射电镜图(30 000×)
2.2 噬菌体vB_EcoM_GXBP08的宿主谱测定
通过35株大肠杆菌和4株沙门氏菌对噬菌体vB_EcoM_GXBP08进行裂解能力评估,结果显示,噬菌体vB_EcoM_GXBP08可裂解14株大肠杆菌,且只对大肠杆菌起裂解作用,特异性较强(表1)。
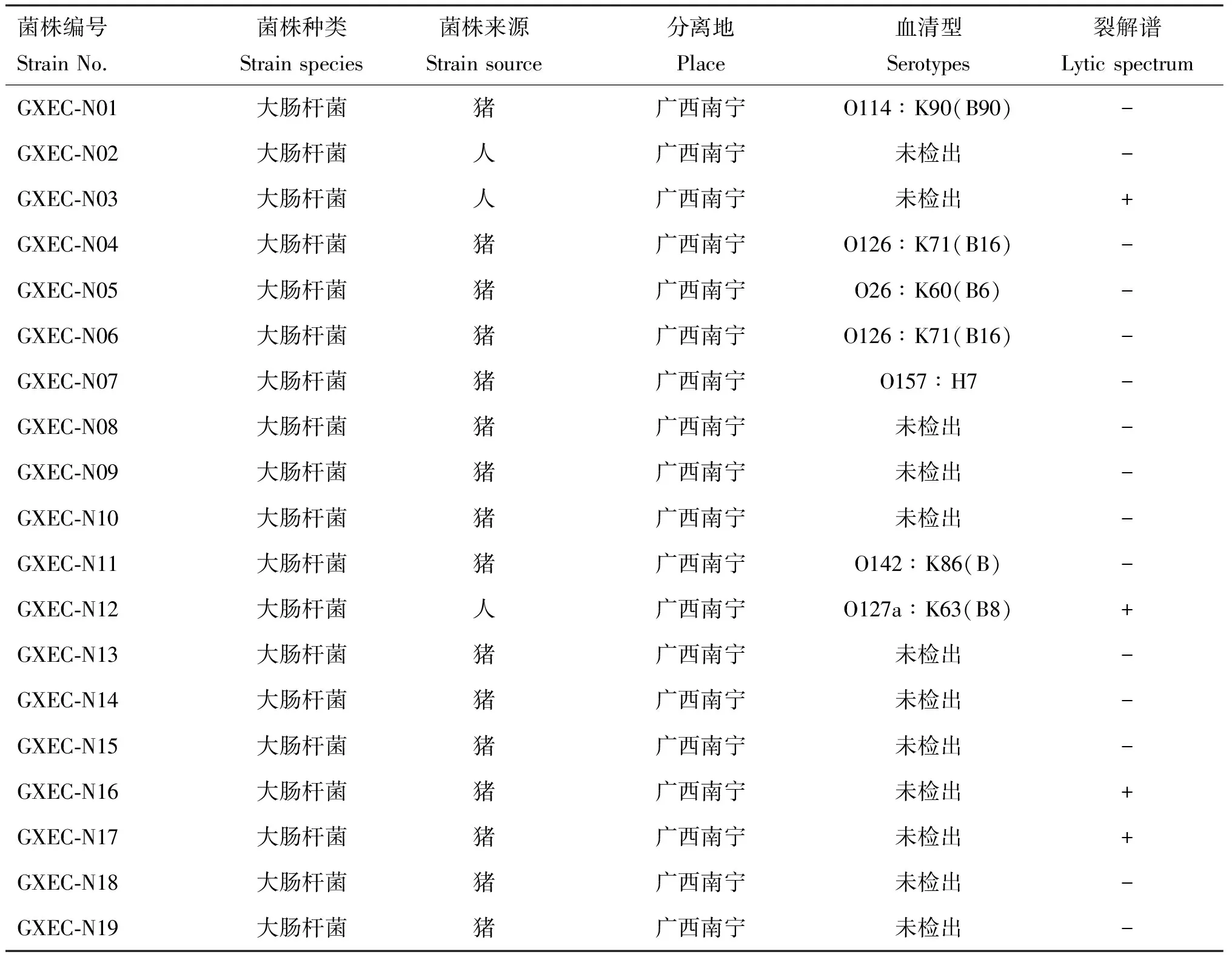
表1 噬菌体vB_EcoM_GXBP08的宿主谱
2.3 噬菌体vB_EcoM_GXBP08的生物学特性分析
MOI测定结果显示,当MOI为1时,噬菌体的效价最高,为5.1×108PFU/mL,故噬菌体vB_EcoM_GXBP08的最佳MOI为1(图2A)。一步生长曲线显示,在0~20 min内噬菌体效价基本不变,在20~70 min内噬菌体迅速增长,之后效价基本维持在109PFU/mL,故噬菌体vB_EcoM_GXBP08的潜伏期约为20 min,爆发期约为50 min(图2B)。经计算,噬菌体vB_EcoM_GXBP08的爆发量约为154 PFU/cell。表明噬菌体vB_EcoM_GXBP08在感染宿主菌的过程中潜伏期较短、裂解期长、裂解能力强。酸碱稳定性测定结果显示,噬菌体vB_EcoM_GXBP08的活性在pH 4.0~10.0时相对稳定;在强酸性(pH 2.0~4.0)或强碱性(pH 10.0~12.0)条件下噬菌体的活性急剧下降;当pH≥11.0或pH≤3.0时,噬菌体处于失活状态,即该噬菌体在强酸、强碱的条件下无法存活(图2C)。热稳定性测定结果显示,当温度在30~60 ℃时,噬菌体的效价可维持在108~109PFU/mL;当温度≥60 ℃时,随温度的升高噬菌体活性逐渐下降;当温度达到80 ℃时,培养1 h后噬菌体完全失活(图2D)。
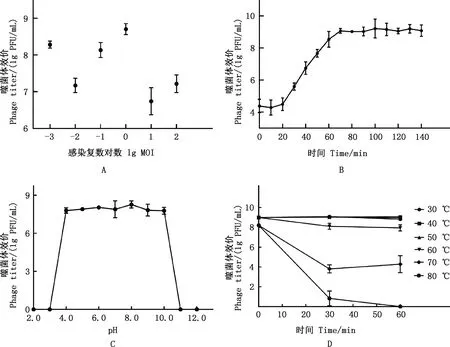
A,最佳感染复数;B,一步生长曲线;C,酸碱稳定性;D,温度稳定性
2.4 噬菌体vB_EcoM_GXBP08的杀菌效力测定
通过将噬菌体vB_EcoM_GXBP08与宿主菌CVCC4050共培养测定D600nm值的方法来评估噬菌体在液体培养基中的杀菌效力,结果见图3。由图3可知,对照组即培养液中仅有宿主菌没有噬菌体时,在培养16 h的过程中D600 nm值呈上升趋势,并维持在一个较高水平;在培养液中加入噬菌体,当感染复数MOI为0.01和0.1时,D600 nm值先逐渐降低,培养5 h后又缓慢上升,最后维持在一个较低的水平,这可能是由于在最开始的5 h内噬菌体发挥抑菌作用,细菌浓度降低;培养5 h后,由于噬菌体抗性菌株的生长,噬菌体不能很好地抑制细菌的生长繁殖,细菌浓度逐渐上升;当MOI为1时,细菌浓度先迅速下降再缓慢上升,最后维持在一个极低水平(D600 nm值≈0.3),表明噬菌体能有效抑制细菌增殖,且杀菌效果明显。相较于MOI为0.01和0.1,MOI为1时杀菌效果更为显著。
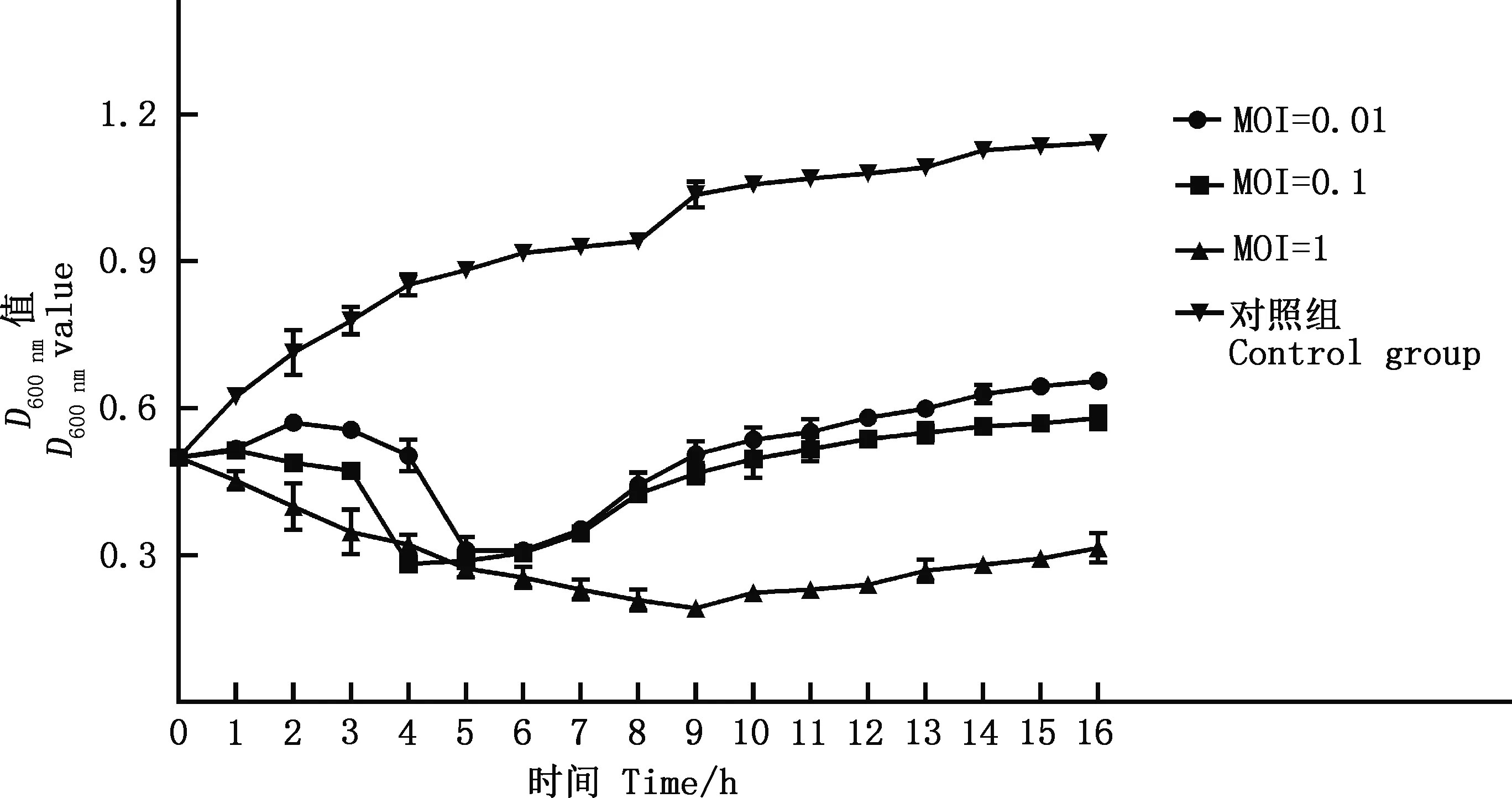
图3 噬菌体vB_EcoM_GXBP08的杀菌效果
2.5 噬菌体vB_EcoM_GXBP08全基因组分析
2.5.1 噬菌体vB_EcoM_GXBP08基因预测与功能注释 噬菌体vB_EcoM_GXBP08具有双链DNA的基因组,总长度为108 114 bp,GC含量为36.23%(图4)。该噬菌体基因组中未发现与抗生素抗性、毒素、毒力因子有关的基因,说明噬菌体vB_EcoM_GXBP08在基因水平上是相对安全的。噬菌体vB_EcoM_GXBP08基因组共预测到177个CDS,有96个CDS(54.24%)编码功能蛋白(图4)。其中56个CDS编码与DNA复制、修复、核苷酸修复有关的蛋白;14个CDS参与编码噬菌体结构、包装相关蛋白;8个CDS与噬菌体裂解相关;7个CDS负责编码与转录调控有关的蛋白;11个CDS编码其他功能蛋白(如硫氧还蛋白、谷氧还蛋白等)。
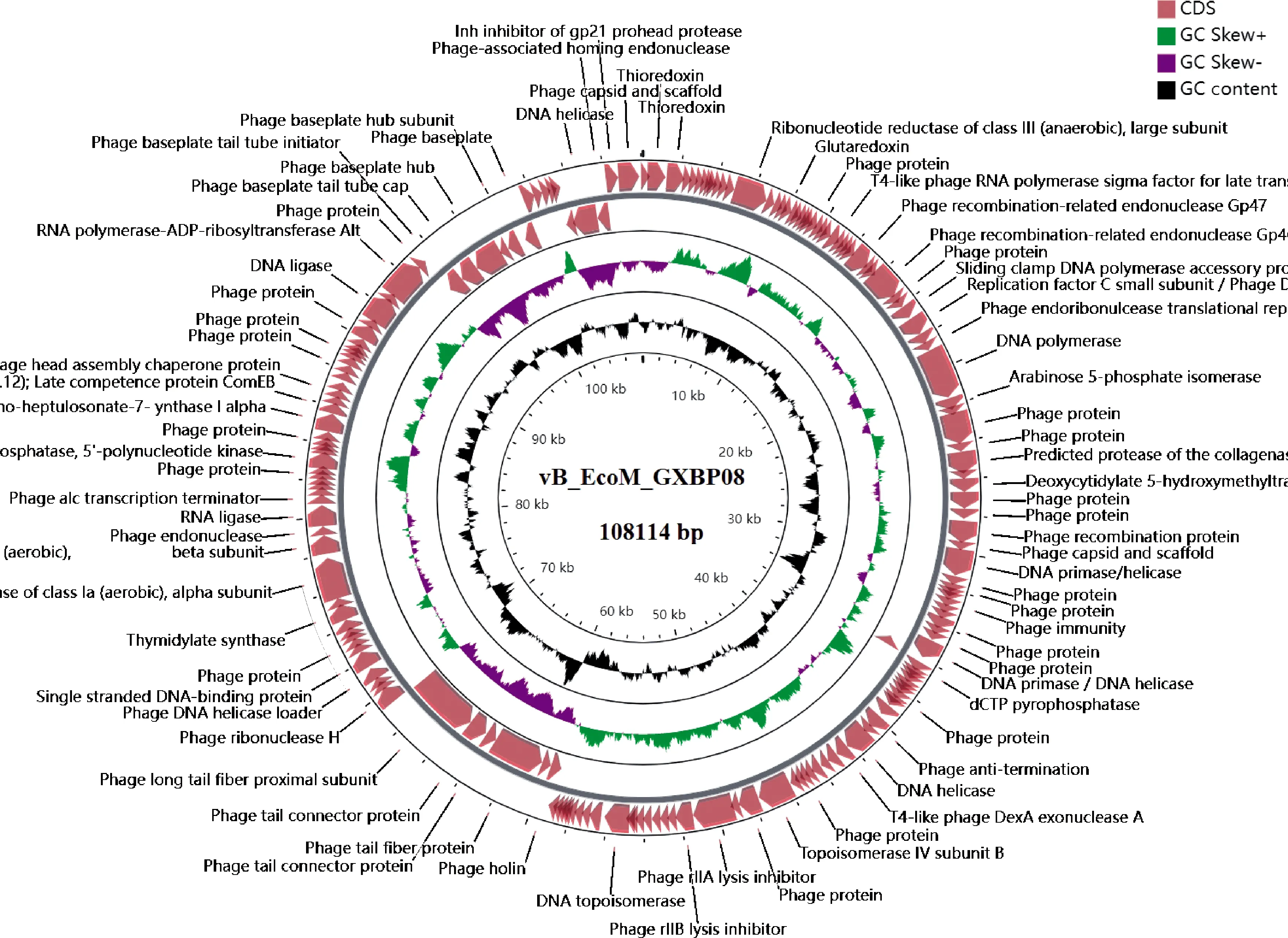
图4 噬菌体vB_EcoM_GXBP08全基因组圈图
2.5.2 噬菌体vB_EcoM_GXBP08基因组进化分析 根据NCBI数据库中BLASTN比对,噬菌体vB_EcoM_GXBP08的基因组DNA与大肠杆菌噬菌体vB_EcoM_JS09的基因组DNA(登录号:NC_024124.2)具有高度相似性(96.88%);与肠杆菌噬菌体phiC600P9的基因组DNA(登录号:MZ681930.1)也具有较高的相似性(89.99%)。基于编码尾纤维蛋白的CDS112构建的系统发育进化树分析结果显示,噬菌体vB_EcoM_GXBP08与噬菌体vB_EcoM_JS09和phiC600P9位于同一分支,都属于有尾噬菌体目肌尾噬菌体科(图5),与BLASTN比对结果一致。
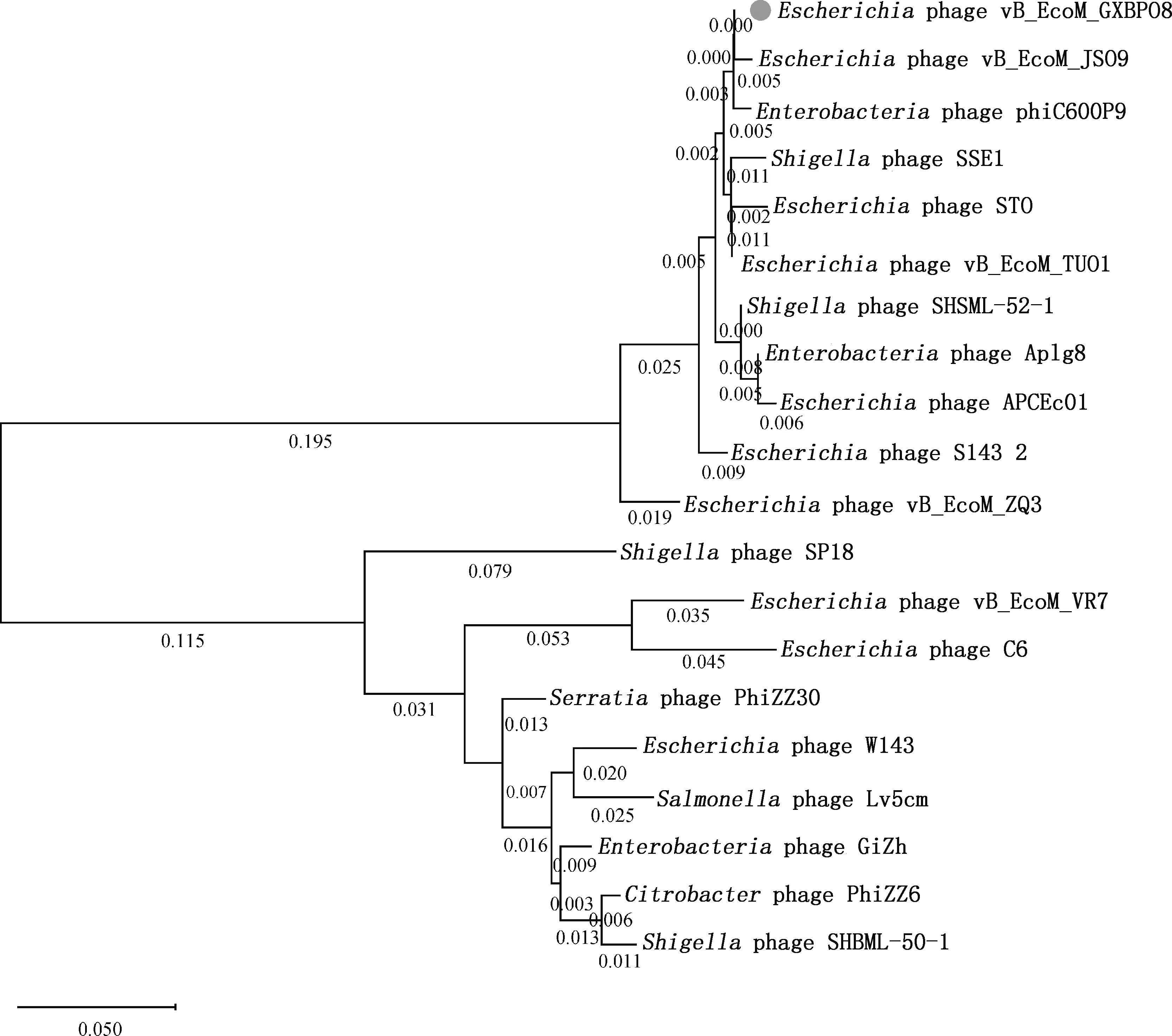
图5 噬菌体vB_EcoM_GXBP08系统进化树
2.5.3 噬菌体vB_EcoM_GXBP08基因组多重线性比对 将大肠杆菌噬菌体vB_EcoM_GXBP08与肠杆菌噬菌体phiC600P9、大肠杆菌噬菌体vB_EcoM_JS09进行基因组多重线性比对,结果显示,在大肠杆菌噬菌体vB_EcoM_GXBP08基因组中,共有176个保守蛋白与肠杆菌噬菌体phiC600P9基因组中的相应蛋白具有较高的相似性(>64%);有154个保守蛋白与大肠杆菌噬菌体vB_EcoM_JS09基因组中的相应蛋白具有较高的相似性(>64%)。同源的蛋白主要包括DNA连接酶、DNA解旋酶、DNA聚合酶、噬菌体尾纤维蛋白和主要衣壳蛋白(图6)。

图6 噬菌体vB_EcoM_GXBP08基因组的多重线性比对图
3 讨 论
噬菌体广泛应用的主要限制之一是宿主范围窄,较难获得能够有效裂解多个菌株的噬菌体,因此噬菌体鸡尾酒和宽谱噬菌体被提出解决这一问题。然而,多个噬菌体联合使用可能产生颉颃作用,导致复杂的药理作用,从而影响抑菌效果。因此,分离宽谱噬菌体是一种较为可行的策略。本研究分离得到1株大肠杆菌O157∶H7 CVCC4050宽谱噬菌体vB_EcoM_GXBP08,可裂解不同来源(包括人源、猪源、牛源、禽源、犬猫源)和不同血清型(包括O157∶H7、O127a∶K63(B8)、O8∶K88)的大肠杆菌,但不能裂解不同种属的细菌如沙门氏菌,表现出明显的宿主特异性。也有研究报道了能够同时裂解沙门氏菌和大肠杆菌的多价宽谱噬菌体[19-21],这可能与噬菌体吸附细菌的尾纤维结构有关。单株噬菌体能够同时侵染不同种属的细菌可能是由于具有共同受体导致的[22]。
噬菌体利用其受体结合蛋白(RBPs)与细菌表面的特定受体结合,包括尾纤维蛋白和尾刺蛋白。噬菌体vB_EcoM_GXBP08基因组中有8个负责编码RBPs的CDS。由于RBPs与抗原的结合具有高度的特异性,噬菌体编码不同的RBPs以匹配O抗原的多样性[23]。这些RBPs使噬菌体能够与脂多糖(LPS)的不同O抗原结合,使它们能够识别不同的受体[24],这可能是噬菌体vB_EcoM_GXBP08能够裂解多种血清型大肠杆菌的重要原因之一。根据NCBI数据库BLASTN比对结果,vB_EcoM_GXBP08基因组中编码RBPs的8个CDS与大肠杆菌噬菌体对应蛋白的相似性较高(98.98%),与沙门氏菌对应蛋白的相似性较低(69.07%),这或许可以解释该噬菌体为什么只能感染大肠杆菌,而不能感染沙门氏菌。
全基因组分析表明,裂解性噬菌体vB_EcoM_GXBP08属于肌病毒科Tevenvirinae亚科Tequatrovirus属。噬菌体vB_EcoM_GXBP08的基因组中未发现与毒力、溶源性和耐药性相关的基因,反映了噬菌体vB_EcoM_GXBP08在病原菌生物防控应用中的安全性。噬菌体vB_EcoM_GXBP08的基因组巨大,共预测了177个CDS,其中96个CDS可编码功能性蛋白。噬菌体vB_EcoM_GXBP08基因组编码多种裂解蛋白,包括尾纤维蛋白(由CDS112、CDS113、CDS114、CDS115和CDS146编码)、基板枢纽亚基(由CDS116编码)、溶菌酶(由CDS148编码)和穿孔素(由CDS111编码)。穿孔素在裂解过程中与诱导宿主细胞膜去极化有关,并负责调节裂解时间[25]。这些蛋白与噬菌体裂解密切相关,协助噬菌体完成吸附、入侵、裂解和去除生物被膜,它们的存在使得噬菌体vB_EcoM_GXBP08具有广泛的宿主范围,并能够高效抵抗浮游生物和生物被膜细胞[26]。在DNA复制、修复和核苷酸代谢方面,CDS54和CDS64编码DNA连接酶,CDS65、CDS80、CDS120和CDS173编码DNA解旋酶等。核酸内切酶在DNA复制和调控中发挥着重要作用,该酶由CDS175编码。
研究表明,在60 ℃、pH 4.0~10.0范围内一些噬菌体仍然具有活性[27-28]。本研究中,噬菌体vB_EcoM_GXBP08在pH 4.0~10.0范围内相对稳定,与前人研究结果一致。同时,vB_EcoM_GXBP08具有较强的热稳定性,在80 ℃高温条件下培养0.5 h时仍能检测到。相比之前报道的许多噬菌体而言,该噬菌体具有更强的耐热性。这有利于将该噬菌体添加到高温条件下灭菌,如与巴氏杀菌法结合应用于乳制品灭菌,应用前景广泛。一步生长曲线反映了噬菌体的潜伏期和爆发量,是评价噬菌体应用潜力最有价值的指标之一。噬菌体vB_EcoM_GXBP08的潜伏期较短、爆发量较大,说明该噬菌体的感染和增殖速度快,而潜伏时间较短的噬菌体在一定时间内能够裂解更多的细菌,更适合于生物防治应用[29]。
4 结 论
本研究从猪场污水中分离到1株宽谱噬菌体vB_EcoM_GXBP08,能够高效裂解14株大肠杆菌,对于不同宿主菌的裂解效价可达109~1010PFU/mL。噬菌体vB_EcoM_GXBP08热稳定性强、pH耐受范围较宽、潜伏期短、爆发量大,全基因组中不含与抗生素抗性、毒素、溶源性和毒力因子相关的基因。此外,噬菌体vB_EcoM_GXBP08在MOI为1时能有效抑制液体培养基中大肠杆菌O157∶H7 CVCC4050的增殖,杀菌效果明显,表明噬菌体vB_EcoM_GXBP08作为一种新型抗菌剂具有很大的应用潜力。

