miR-140-5p对前脂肪细胞3T3-L1成脂分化的机制研究
原佳慧,张鹏翔,吉树森,卢嘉茵,罗小毛,闫 艺,王海东
(山西农业大学动物医学学院,太谷 030801)
肌内脂肪是反映动物肉品质的重要指标,其含量直接影响动物肉的风味、嫩度、多汁性及大理石花纹的分布[1]。脂肪组织是动物体内重要的分泌组织,脂肪细胞会分泌瘦素、脂联素等[2-3]。哺乳动物脂肪组织主要分为白色脂肪组织、棕色脂肪组织和米色脂肪组织。3种脂肪组织来源不同,功能也各不相同。白色脂肪组织内含有较多的甘油三酯,可以储存机体多余的能量。由于白色脂肪细胞中线粒体含量较低,所以其虽储存能量能力较强,但脂肪消耗能量的能力较差[4-5]。因此,脂肪干细胞的形成及代谢过程的直接或间接调控因子已成为研究热点。
多种miRNA可直接或间接参与脂肪细胞分化的转录与翻译过程,且其可通过与下游靶基因结合的方式参与调控脂肪干细胞的分化及发育[6]。研究表明,内源性miR-140-5p在小鼠骨髓基质细胞(ST2)分化过程中表达较高,miR-140-5p可靶向转化生长因子β受体Ⅰ(TGFBR1)调节脂肪细胞分化[7],miR-140-5p能够靶向且正调控长链非编码RNA 核副斑点装配转录物1(LnoRNA NEAT1)促进脂肪衍生干细胞(ADSCs)成脂分化[8]。此外,研究表明,CCAAT增强子结合蛋白家族(C/EBPs)与miR-140-5p的近端启动子结合正调控miR-140-5p的表达[7],表明miR-140-5p与C/EBPs可能是正反馈模式,miR-140-5p可能在脂肪分化过程中发挥着重要的作用。通过查找miRBase等网站发现了可能靶向miR-140-5p的基因,一部分已经被验证参与脂肪干细胞的分化过程,其中P300/CBP相关因子(PCAF)又名KAT2B,是组蛋白乙酰转移酶,具有乙酰转移活性,能通过乙酰化组蛋白和非组蛋白的方式参与基因的转录调控[9]。P300/CBP与细胞周期调控、细胞凋亡和癌症的发生有着直接的关系[10]。研究表明,PCAF基因在3T3-L1细胞成脂分化过程中具有重要作用[11],同时关于PCAF基因在成脂分化方面相关文献较少,PCAF基因影响成脂分化的具体机制还不清晰。
过氧化物酶体增殖物激活受体(PPAR)是调节目标基因表达的核内受体转录因子超家族成员。PPAR可分为α、β(或δ)和γ 3种类型,其中PPARγ主要表达于脂肪组织及免疫系统,与脂肪细胞分化、机体免疫及胰岛素抵抗关系密切,是一种可由多种脂肪酸及其衍生物激活的核转录因子[12]。PPARγ参与脂肪细胞分化,并与肥胖密切相关,是公认的脂肪分化的标志因子[13]。C/EBPs家族是碱性亮氨酸拉链蛋白家族的一个亚家族,具有多种功能,在细胞增殖、分化、信号传导、肿瘤发生及机体的免疫、应激反应、能量代谢、血液生成等方面发挥着重要的作用[14-15]。目前发现的C/EBPs家族有C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ、C/EBPε、C/EBPζ 6类,且C/EBPs家族是第一个被证明在脂肪细胞分化过程中起重要作用的家族[16]。研究表明,在前脂肪细胞3T3-L1分化过程中C/EBPβ的表达在脂肪分化初期瞬时增强,而后C/EBPα与PPARγ转录激活[17]。基于PPARs与C/EBPs家族互相影响且在细胞成脂分化中起到重要的作用,本试验选择C/EBPβ、C/EBPδ与PPARγ作为3T3-L1细胞成脂分化机制的下游基因进行深入研究,探索miR-140-5p对3T3-L1细胞成脂分化的调控作用。
1 材料与方法
1.1 材料
高糖DMEM购自上海帝博思生物科技有限公司;胎牛血清(FBS)购自Sciencell公司;Promega Dual-Luciferase®Reporter Assay System E1910购自Abcam公司;Lipofectamine®2000转染试剂、质粒中提试剂盒均购自Thermo公司;PGLO载体、PGLO-PCAF 3′-UTR载体、PEGFP-N1载体、PEGFP-N1-PCAF载体均购自武汉淼灵生物科技有限公司;RNAiso Plus,PrimeScriptTMRT Reagent Kit、SYBR®Primix ExTaqⅡ均购自TaKaRa公司;BCA蛋白浓度检测试剂盒购自北京普利莱基因技术有限公司;PrimeScriptTMRT Reagent Kit with gDNA Eraser、Adipogenesis Assay试剂盒均购自Abcam公司;PCAF、C/EBPβ、C/EBPδ、PPARγ抗体购自Proteintech Group公司;限制性内切酶XhoⅠ、KpnⅠ、NheⅠ均购自NEB公司;大肠杆菌DH5α感受态细胞购自深圳康体生命科技有限公司。
1.2 分子材料的设计及合成
1.2.1 miR-140-5p模拟物、抑制物的合成 根据miRBase网站miR-140-5p全序列(登录号:KT921569.1),由吉玛基因公司设计并合成miR-140-5p的模拟物、抑制物及对照序列(miR-140-5p mimics、inhibitor、NC)(表1)。

表1 模拟物、抑制物及siRNA信息
1.2.2 siRNA设计及合成 根据GenBank中PCAF基因完整CDS区序列(登录号:NM_001190846.1),由吉玛基因公司设计并合成PCAF基因的3条siRNA(siRNA1、siRNA2、siRNA3)(表1)。
1.2.3 载体构建 根据GenBank中PCAF基因完整CDS区序列(登录号:NM_001190846.1),采用Primer Premier 5.0软件设计PCAF过表达引物,以3T3-L1细胞cDNA为模板进行PCR扩增。PCR反应体系50 μL:cDNA 5 μL,2×TaqMasterMix 25 μL,上、下游引物各1.5 μL,ddH2O 17 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸15 s,共35个循环;72 ℃终延伸5 min。PCR产物经1.0%琼脂糖凝胶电泳后胶回收,与PEGFP-N1空载体同时使用限制性内切酶XhoⅠ、KpnⅠ双酶切,将二者双酶切产物连接,连接产物转入大肠杆菌DH5α感受态细胞中,对转化后的大肠杆菌进行摇菌、涂板、挑单克隆菌、摇菌,将得到的菌液送往生工生物工程(上海)股份有限公司进行测序,测序成功后对菌液进行质粒提取,重组质粒命名为PEGFP-N1-PCAF。
根据miRDB网站得到PCAF基因的3′-UTR序列,采用Primer Premier 5.0软件设计PCAF 3′-UTR引物(表2),其中包含miR-140-5p与PCAF基因预测结合位点,使用上述方法构建PGLO-PCAF 3′-UTR载体。
1.2.4 引物设计及合成 根据miRBase、GenBank中miR-140-5p、PCAF、C/EBPβ、C/EBPδ、PPARγ基因序列,利用Primer Premier 5.0软件设计实时荧光定量PCR引物,引物信息见表2。引物均由生工生物工程(上海)股份有限公司合成。

表2 引物信息
1.3 miR-140-5p对3T3-L1细胞成脂分化的影响
1.3.1 3T3-L1细胞转染及分化 3T3-L1细胞解冻后用含10%胎牛血清的DMEM高糖培养基培养,按照2×105/mL接种到6孔板中,待汇合度达到70%左右时进行细胞转染。用250 μL DMEM培养基(不含血清和双抗)分别稀释miR-140-5p mimics(mimics)、NC和Lipofectamine®2000转染试剂,室温静置5 min,将NC与miR-140-5p mimics分别与转染试剂混匀后静置20 min;静置期间,将6孔板里的旧培养基弃掉,用PBS清洗细胞2次,加入800 μL新鲜DMEM培养基(不含血清和双抗);静置结束后将500 μL转染混合液均匀滴加到培养板中,轻轻晃动培养板使溶液混合均匀;培养箱中静置6 h,更换为含10%胎牛血清的DMEM培养基(不含双抗)继续培养。待细胞汇合度达70%时进行诱导分化,将完全培养基换为诱导培养基(将胰岛素、IBMX、地塞米松试剂按照说明书1 000倍稀释,1 mL完全培养基加入1 μL各试剂配制诱导培养基),诱导3 d后换为分化培养基(将胰岛素试剂按照说明书1 000倍稀释,1 mL完全培养基加入1 μL配制分化培养基)继续培养,2 d换1次分化液。
1.3.2 油红O染色鉴定 在诱导分化第7天进行油红O染色。将3T3-L1细胞每孔加入100 μL稀释的脂滴分析固定剂,并孵育15 min;用100 μL洗涤液洗2次,每次5 min;干燥培养板;将75 μL油红O工作液添加到所有孔中,包括不含细胞的空白孔,并孵育20 min;移除所有油红O溶液,用蒸馏水清洗细胞数次,至蒸馏水清澈;用100 μL洗涤液洗2次,每次5 min。显微镜下观察并拍照。
1.3.3 实时荧光定量PCR检测基因的表达 在诱导分化的第―1(分化前1 d)、0、1、2、3、5、7天收集3T3-L1细胞,用于实时荧光定量PCR检测miR-140-5p mRNA相对表达量;在诱导分化第7天收集细胞进行C/EBPβ、C/EBPδ和PPARγ mRNA相对表达量检测。用TRIzol提取诱导分化第―1、0、1、2、3、5、7天的3T3-L1细胞、转染miR-140-5p mimics和NC组诱导分化7 d的3T3-L1细胞总RNA并反转录合成cDNA。PCR反应体系10 μL:2×TaqMaster Mix 5 μL,上、下游引物各0.4 μL,cDNA 200 ng,ddH2O补足10 μL。PCR反应程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸15 s,共40个循环;72 ℃延伸5 min。
1.4 miR-140-5p靶基因筛选及靶基因序列保守性分析
采用miRandn(http:∥mirdb.org/)和TargetScan(http:∥www.targetscan.org/vert_70/)2个miRNA数据库预测miR-140-5p的靶基因,在数据库中挑选与脂肪分化相关的靶基因作为潜在靶基因。通过在miRBase(https:∥www.mirbase.org/)数据库得到小鼠、人、黑猩猩、恒河猴、松鼠、大鼠、兔子、猪、牛、猫、犬、棕蝠、大象、负鼠、金刚鹦鹉和鸡的miR-140-5p及其靶基因结合位点序列,通过比对各物种miRNA序列,分析其结合位点序列的保守性。
1.5 miR-140-5p对其预测靶基因表达的影响
1.5.1 3T3-L1细胞培养、细胞转染及细胞分化 将miR-140-5p mimics(mimics)、miR-140-5p inhibitor(inhibitor)与NC按照1.3.1方法转染到3T3-L1细胞中,细胞培养与诱导分化方式同1.3.1。
1.5.2 实时荧光定量PCR检测靶基因的表达 在诱导的第2天收集1.5.1各组细胞进行实时荧光定量PCR。试验方法同1.3.3,检测mimics、inhibitor与mimics NC组的miR-140-5p的靶基因mRNA相对表达水平。
1.5.3 Western blotting检测蛋白的表达 在诱导的第2天收集1.5.1各组细胞进行Western blotting检测。用蛋白裂解液收集mimics、inhibitor与mimics NC组的细胞后,冰上裂解40 min,13 000 r/min离心15 min,吸取上清液,检测蛋白浓度后进行SDS-PAGE凝胶电泳,经过转膜、室温封闭1 h、孵育一抗(4 ℃孵育过夜)、洗膜、孵育二抗(37 ℃孵育1 h)、洗膜后,涂抹发光液后在凝胶成像系统中曝光。检测miR-140-5p靶基因的蛋白表达水平。
1.6 过表达或敲低PCAF对3T3-L1细胞成脂分化的影响
1.6.1 3T3-L1细胞培养、细胞转染及细胞分化 将PEGFP-N1-PCAF载体、PEGFP-N1载体、NC、PCAF siRNA1、PCAF siRNA2和PCAF siRNA3、PCAF NC与PCAF siRNA3按照1.3.1的方法转染到3T3-L1细胞,细胞培养与诱导分化方式同1.3.1。在诱导第2天时收集各组细胞进行实时荧光定量PCR和Western blotting检测,在诱导分化第7天进行油红O染色鉴定。
1.6.2 油红O染色 试验方法同1.3.2,观察PEGFP-N1-PCAF与PEGFP-N1组及PCAF siRNA与NC组细胞中脂滴的染色情况。
1.6.3 实时荧光定量PCR检测基因的表达 试验方法同1.3.3,检测PEGFP-N1-PCAF、PEGFP-N1组细胞PCAF、C/EBPδ、PPARγ基因的相对表达水平;检测PCAF siRNA、NC组PCAF、C/EBPβ、C/EBPδ、PPARγ基因的相对表达水平。
1.6.4 Western blotting检测蛋白的表达 试验方法同1.5.3,检测PEGFP-N1-PCAF、PEGFP-N1组细胞C/EBPβ、C/EBPδ、PPARγ与GAPDH蛋白表达水平;检测PCAF siRNA1、PCAF siRNA2、PCAF siRNA3和NC组细胞中PCAF蛋白表达水平;检测PCAF siRNA组与NC组C/EBPβ、PPARγ与GAPDH蛋白表达水平。
1.7 miR-140-5p与PCAF靶向关系验证
将293T细胞分为mimics+PCAF 3′-UTR、NC+PCAF 3′-UTR、mimics+PGLO空载(mimics+vehicle)和空白+PCAF 3′-UTR(Blank+3′-UTR PCAF)4组,待293T细胞汇合度达到70%~80%进行转染,用125 μL DMEM培养基(不含血清和双抗)分别稀释PCAF 3′-UTR质粒、mimics,用250 μL DMEM培养基稀释Lipo2000转染试剂(6 μL/孔),室温静置5 min,将质粒和mimics与转染试剂分别混匀再静置20 min,按照1.3.1的方法进行转染,培养72 h后收集细胞,用于双荧光素酶报告试验检测。试验前需按照Promega Dual-Luciferase®Reporter Assay System E1910试剂盒说明书制备裂解液1×PLB、LAR Ⅱ、Stop & Glo试剂、1×Stop & Glo Raegent。除去培养基,用PBS清洗细胞后,将1×PLB加入到培养孔中。在室温轻缓晃动培养板15 min,将裂解液转移到检测板中,加入20 μL PLB裂解液/孔,加入100 μL LAR Ⅱ,检测样本荧火虫荧光素酶活性;加入100 μL Stop & Glo试剂,检测样本海肾荧光素酶活性。
1.8 数据统计分析
用2-△△Ct法计算各基因相对表达量,采用ImageJ 1.48软件计算蛋白灰度值,用GraphPad Prism 8.0软件绘图,用SPSS 26.0软件进行单因素方差分析,组间差异采用t检验,结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 miR-140-5p对3T3-L1细胞成脂分化的影响
在3T3-L1细胞分化过程中,miR-140-5p的表达量有明显变化趋势。与诱导分化前1 d(-1 d)相比,在细胞汇合至100%时miR-140-5p表达水平极显著上升(P<0.01),在添加诱导培养基第1天时,miR-140-5p表达水平极显著上升(P<0.01),而后在分化过程中下降,分化至第3天miR-140-5p表达水平显著上升(P<0.05),分化至第5天后miR-140-5p表达水平已降低到未分化之前的水平(图1A)。油红O染色发现,mimics组脂滴明显多于NC组(图1B)。与NC组相比,mimics组成脂标志性基因C/EBPδ、PPARγ转录水平极显著升高(P<0.01),C/EBPβ基因的转录水平有升高趋势,但差异不显著(P>0.05)(图1C~1E)。
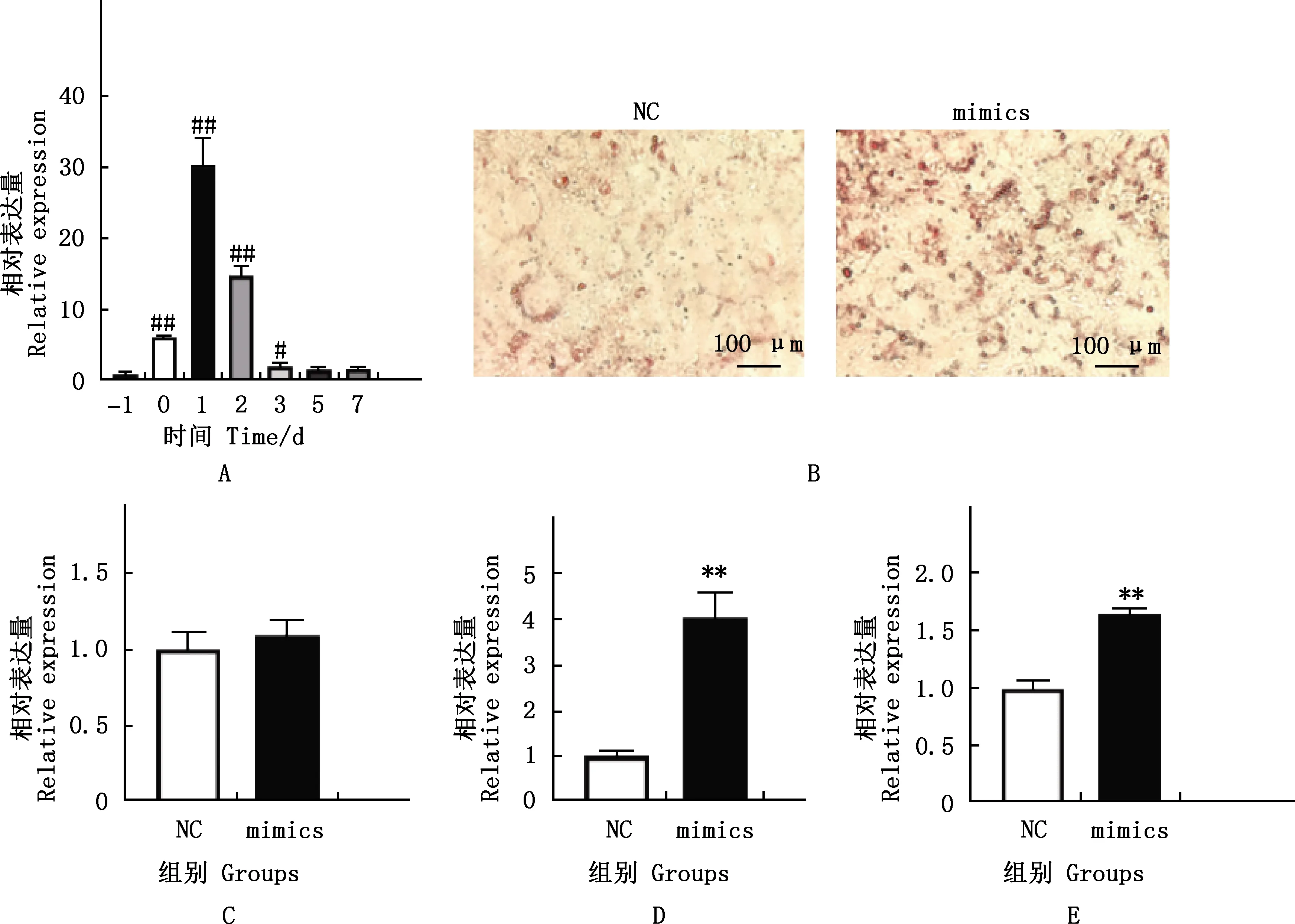
①A,3T3-L1细胞分化第-1、0、1、2、3、5、7天miR-140-5p表达水平;B,miR-140-5p NC组与mimics组油红O染色结果(40×);C~E,C/EBPβ、C/EBPδ、PPARγ mRNA相对表达量。②与―1 d相比,#,差异显著(P<0.05);##,差异极显著(P<0.01);无#,差异不显著(P>0.05)。③与NC/PEGFP-N1组相比,*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)。下同
2.2 miR-140-5p靶基因预测及PCAF序列保守性分析
利用TargetScan网站预测发现,miR-140-5p与PCAF 3′-UTR区含有预测结合位点,在674-681 bp处(图2A)。预测结合位点在小鼠、人、黑猩猩、恒河猴、松鼠、大鼠、兔子、猪、牛、猫、犬、棕蝠、大象、负鼠、金刚鹦鹉和鸡物种间的保守性比对发现,在不同物种间此结合位点保守性较高(图2B)。
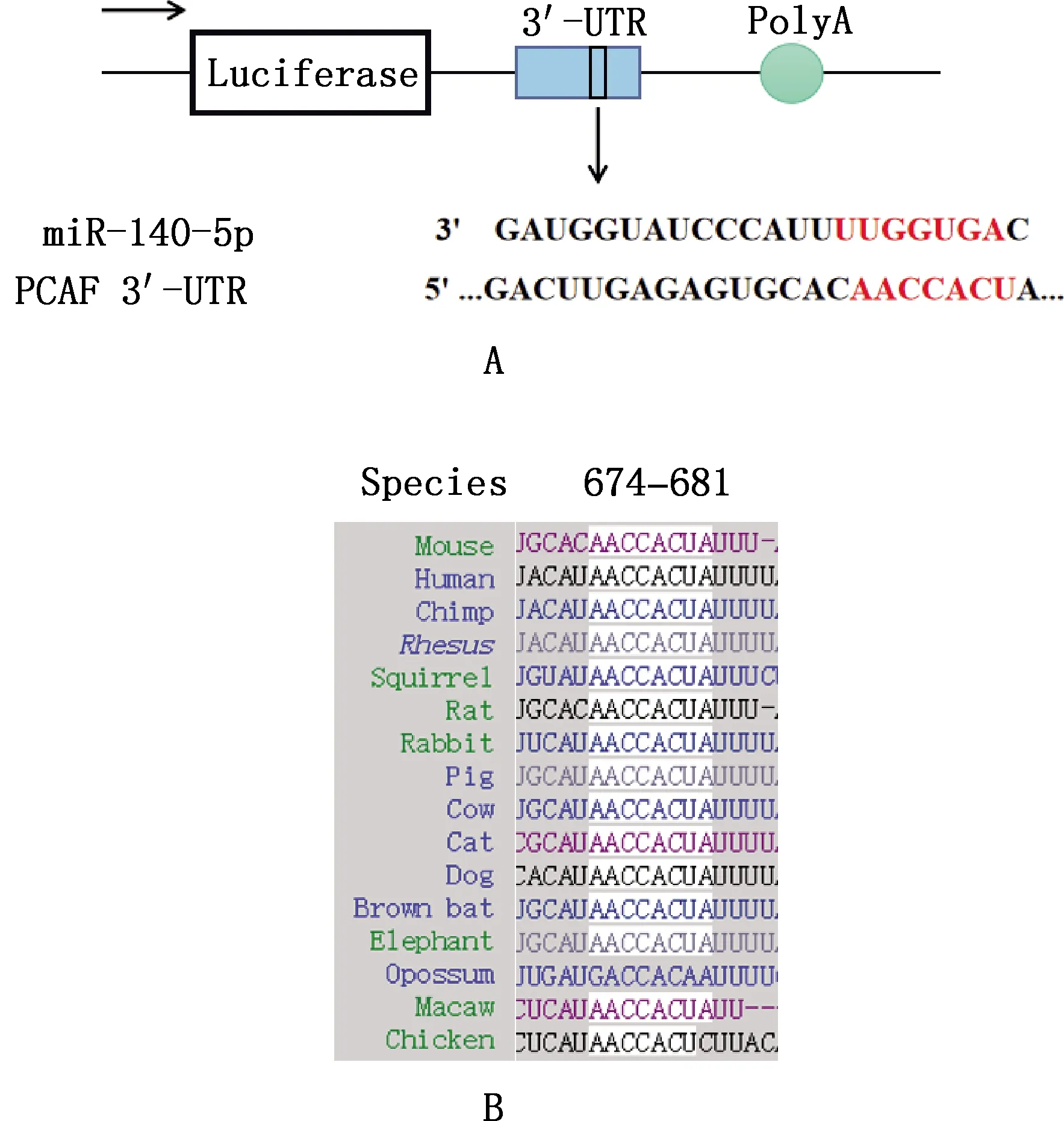
A,miR-140-5p和PCAF 3′-UTR区的预测结合位点;B,PCAF 3′-UTR区序列保守性分析
2.3 miR-140-5p对PCAF表达的影响
由图3可知,与NC组相比,mimics组miR-140-5p、PCAF的表达量均极显著增加(P<0.01),inhibitor组miR-140-5p的表达量极显著降低(P<0.01)、PCAF的表达量显著降低(P<0.05)。由图4可知,与NC组相比,mimics组PCAF蛋白的表达量显著增加(P<0.05),inhibitor组PCAF蛋白的表达量无显著变化(P>0.05)。
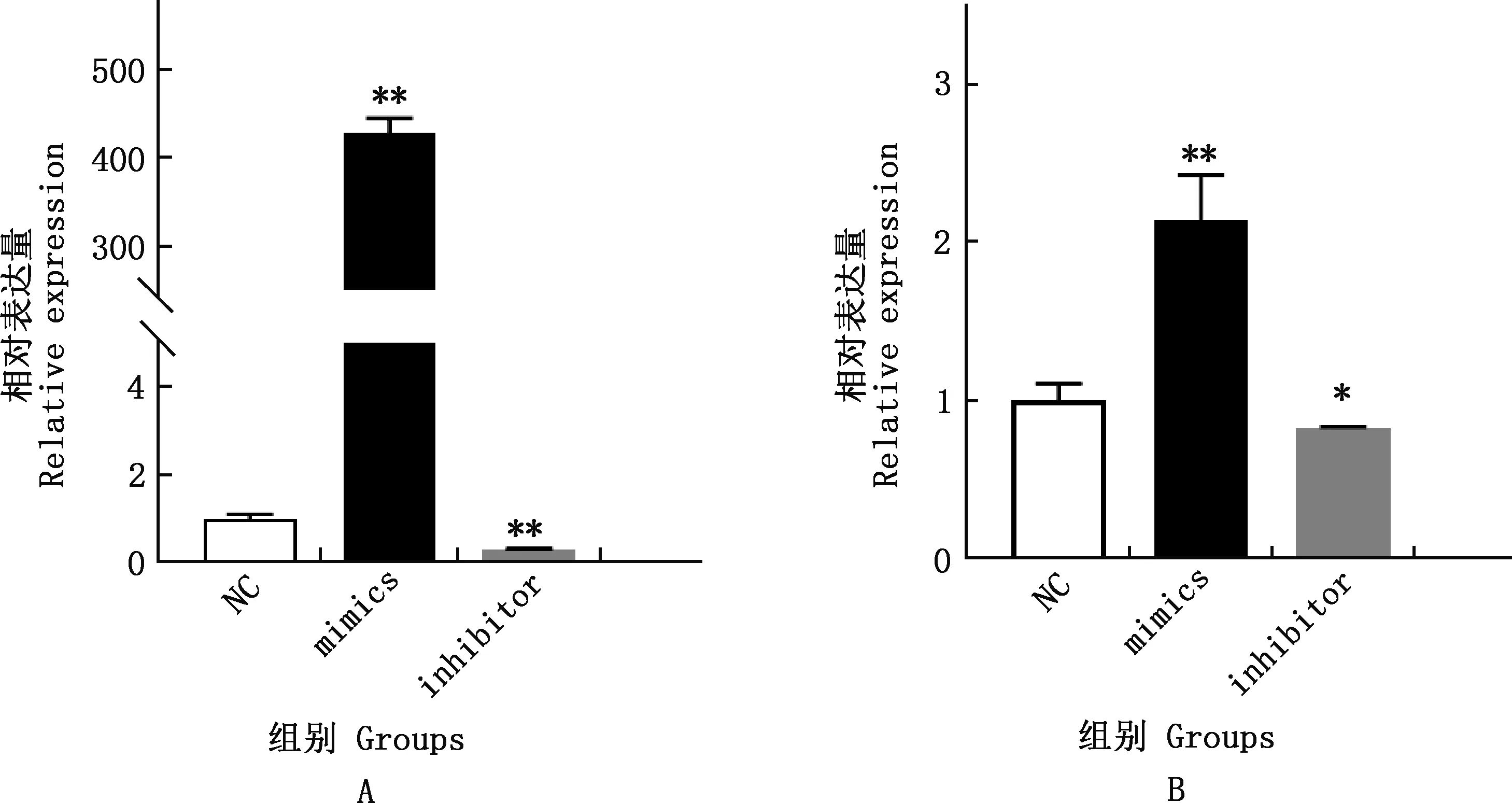
图3 各组miR-140-5p(A)与PCAF(B)基因的相对表达量
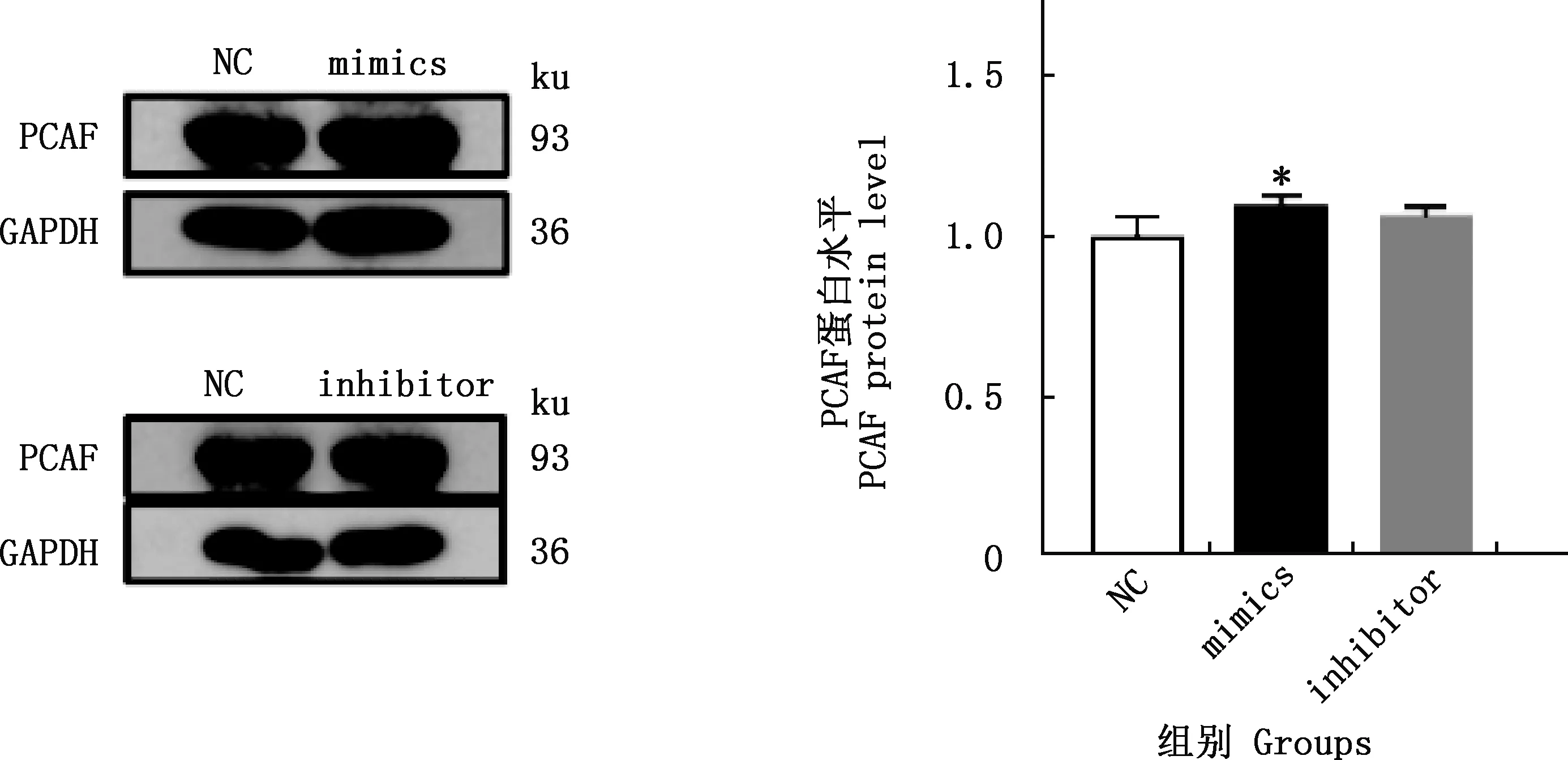
图4 各组PCAF蛋白表达量
2.4 过表达PCAF对3T3-L1细胞成脂分化的影响
由图5可知,与PEGFP-N1组相比,PEGFP-N1-PCAF组细胞脂滴明显增加。由图6可知,与PEGFP-N1组相比,PCAF、PPARγ基因相对表达量均极显著增加(P<0.01),C/EBPδ基因相对表达量有上升趋势,但差异不显著(P>0.05)。由图7可知,与PEGFP-N1组相比,PEGFP-N1-PCAF组C/EBPβ、C/EBPδ蛋白表达水平极显著上升(P<0.01),PPARγ蛋白表达水平显著上升(P<0.05)。
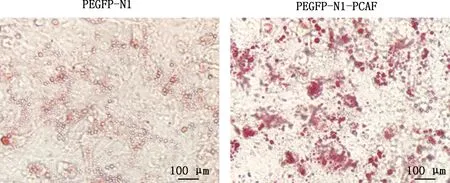
图5 油红O染色结果(40×)
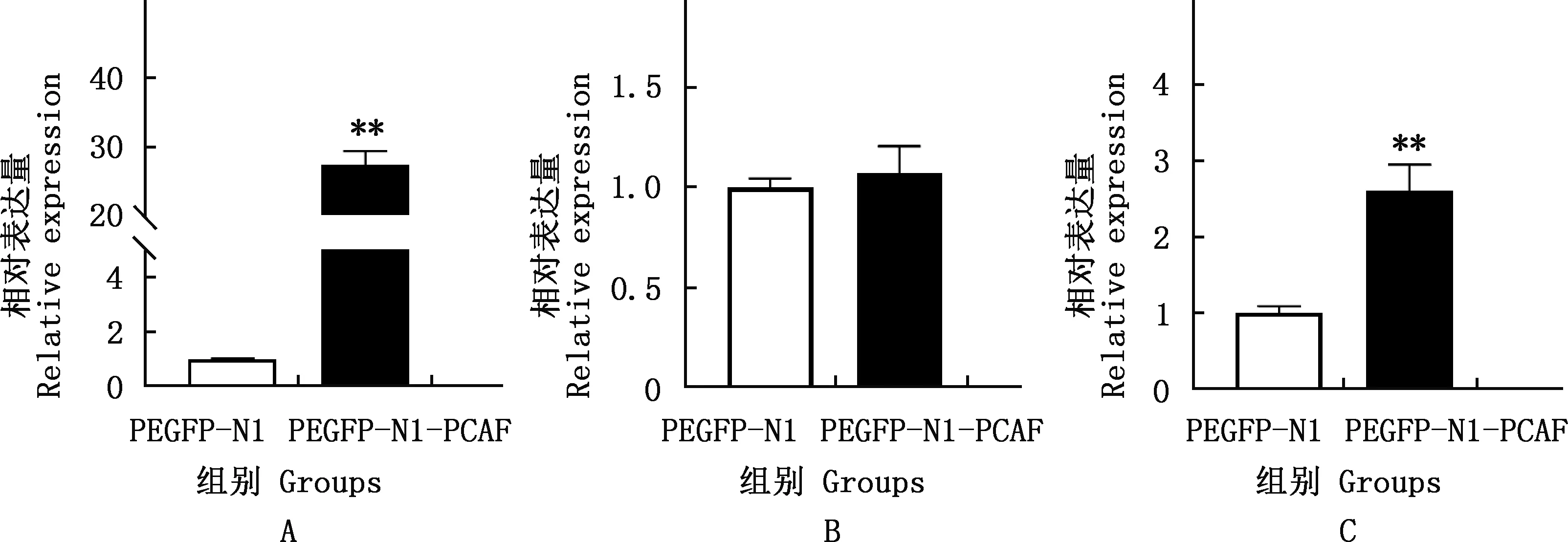
图6 各组PCAF(A)、C/EBPδ(B)和PPARγ(C)基因相对表达量

A,C/EBPβ、C/EBPδ和PPARγ蛋白Western blotting条带;B~D,C/EBPβ、C/EBPδ和PPARγ蛋白灰度值
2.5 敲低PCAF基因对3T3-L1细胞成脂分化的影响
由图8可知,与NC组相比,3条siRNA均极显著抑制PCAF蛋白的表达水平(P<0.01),由于siRNA3组PCAF蛋白水平降低最显著,所以选用siRNA3进行后续PCAF敲低试验。由图9可知,siRNA3组脂滴明显少于NC照组。与NC组相比,siRNA3组C/EBPβ、C/EBPδ与PPARγ基因相对表达量均极显著下降(P<0.01)(图10);与NC组相比,siRNA3组C/EBPβ蛋白表达水平极显著降低(P<0.01),PPARγ蛋白表达水平无显著变化(P>0.05)(图11)。
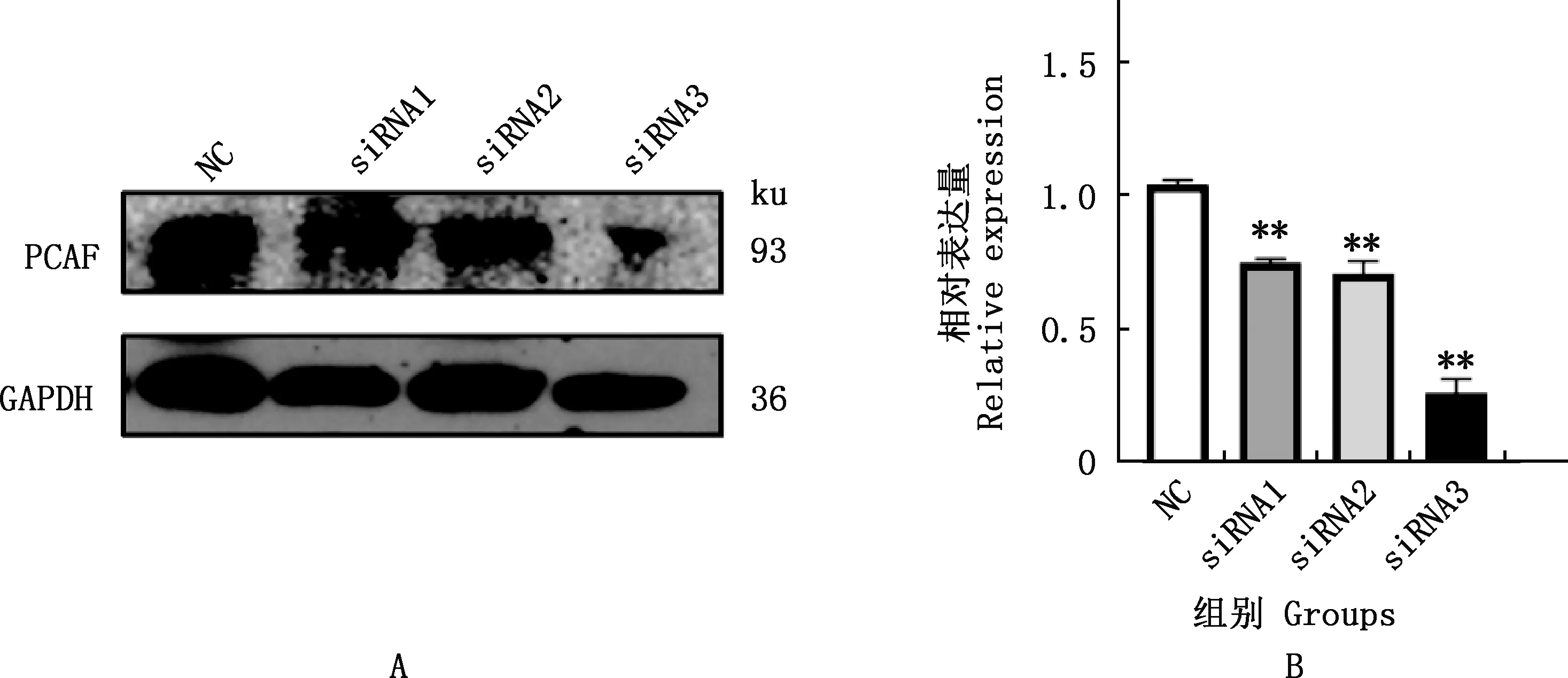
A、B,在3T3-L1细胞中分别转染3条PCAF siRNA后PCAF蛋白的表达水平

图9 油红O染色结果(40×)
2.5 miR-140-5p与PCAF基因靶向关系验证
双荧光素酶报告试验结果显示,与Blank+PCAF 3′-UTR、mimics+vehicle和NC+PCAF 3′-UTR相比较,mimics+PCAF 3′-UTR组中双荧光素酶活性均无显著差异(P>0.05)(图12),说明miR-140-5p与PCAF基因无靶标关系。
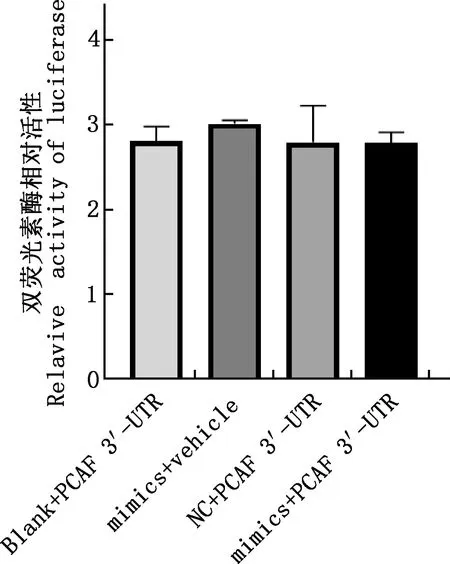
图12 各组双荧光素酶相对活性
3 讨 论
脂肪代谢及分化与动物的生长发育息息相关,miRNA在脂肪分化过程中的作用与功能具有重要意义。研究表明,在ST2细胞成脂分化过程中,在细胞汇合至100%的第2天添加诱导分化液,miR-140-5p的表达水平在诱导分化前1 d升高,在诱导分化后第1天达到最高值[7]。本研究在细胞汇合至100%当天添加诱导分化液,结果显示,3T3-L1细胞在诱导分化当天miR-140-5p表达水平极显著升高,在诱导后第1天miR-140-5p表达量达到峰值,与ST2细胞的研究结果基本一致。其原因可能在于:当细胞汇合100%时,3T3-L1细胞达到了细胞接触抑制时期,这时期为前体脂肪细胞分化第一阶段(克隆增殖阶段),且细胞在接触抑制后很快进入第二阶段(终末分化阶段),为了避免错过分化第一阶段,所以本研究中诱导分化时间选择在这一时期。但本试验结果显示,在诱导分化后第1天miR-140-5p水平达到峰值,与上述文献一致,这个峰值可能代表着细胞进入了分化的第二阶段,而造成细胞分化第一阶段到第二阶段的原因可能是添加诱导分化试剂引起的。miR-140-5p在细胞分化第一阶段与第二阶段均显著增高,这说明miR-140-5p在3T3-L1细胞分化过程中扮演重要角色。本研究通过过表达miR-140-5p,发现miR-140-5p能够促进3T3-L1细胞的成脂分化,并且上调成脂分化相关基因PPARγ、C/EBPβ和C/EBPδ的表达。
为了探究miR-140-5p的成脂调控作用,利用TargetScan与miRBase等靶基因预测网站预测miR-140-5p的下游靶基因,从中选择与脂肪分化相关的PCAF基因作为研究对象。有研究表明,PCAF基因在3T3-L1细胞分化中发挥重要作用[11]。本研究结果证明,与NC组相比,miR-140-5p mimics组PCAF基因的表达量上调,miR-140-5p inhibitor组PCAF基因表达量下降,说明miR-140-5p可影响PCAF基因的表达。与转染空载体对照组相比,PCAF基因高表达后脂滴明显增多,且C/EBPβ、C/EBPδ与PPARγ的转录与蛋白表达水平均上升;相反,敲低PCAF抑制3T3-L1细胞分化为脂滴,且C/EBPβ、C/EBPδ与PPARγ的转录与蛋白表达水平均不同程度地下降,说明PCAF是通过正调控C/EBPβ、C/EBPδ与PPARγ基因促进3T3-L1细胞成脂分化的。尽管组蛋白乙酰化对脂肪细胞分化调控的研究较少,但目前的文章显示组蛋白乙酰化修饰水平与成脂分化水平呈正相关[18]。Jin等[19]研究发现,PCAF通过调节PPARγ的表达来促进脂肪的发生,并通过影响Prdm16的表达来调节棕色脂肪的发生。除此之外,C/EBPβ转录活性也受PCAF的调节,PCAF可促进前脂肪细胞中C/EBPβ乙酰化[20],且增强前脂肪细胞分化过程中C/EBPα的转录激活,从而提高分化效率[21]。以上结果说明,PCAF在细胞分化过程中的功能是通过调控PPARγ与C/EBPs来实现的,由此可得,miR-140-5p可通过miR-140-5p/PCAF/C/EBPs、PPARγ促进细胞成脂分化。
由于miR-140-5p和PCAF的正相关关系与miRNA对靶基因的调控作用机制不一致,PCAF 3′-UTR与miR-140-5p的预测结合位点序列比对结果显示,其预测结合位点在多物种间序列保守性较高,但双荧光素酶试验验证结果却显示二者并无靶标关系。因此,miR-140-5p可能是通过靶向其他基因间接影响了PCAF的表达,但具体通路并不清晰。利用TargetScan与miRBase等预测靶基因的网站,预测miR-140-5p的其他靶基因,其中一些靶基因可能在miR-140-5p与PCAF基因之间具有一些作用,如E3泛素蛋白连接酶-1(siah E3 ubiquitin protein ligase 1,Siah1)、E3泛素蛋白连接酶UBR5(ubiquitin protein ligase E3 component n-recognin 5,UBR5)、组蛋白脱乙酰酶4(histone deacetylase 4,HDAC4)、组蛋白脱乙酰酶7(histone deacetylase7,HDAC7)等基因。Siah1是一种泛素连接酶,通过降解蛋白调节细胞内蛋白平衡,且是miR-140-5p的预测靶基因,如若Siah1可泛素化PCAF使其降解,而miR-140-5p又成功靶向且负调控Siah1,这时Siah1就具有了在miR-140-5p与PCAF之间发挥作用的潜质。而UBR5也是泛素蛋白连接酶之一,可能与Siah1具有类似功能。HDAC4和HDAC7是组蛋白脱乙酰酶,其作用与组蛋白乙酰转移酶PCAF相反,且在细胞核内组蛋白乙酰化与组蛋白去乙酰化过程处于动态平衡,并由这2种酶共同调控。miR-140-5p的预测靶基因中有HDAC4和HDAC7,所以miR-140-5p极有可能通过负调控HDAC4或HDAC7的表达而间接影响了PCAF基因的表达。
4 结 论
本研究结果发现,内源性miR-140-5p在成脂分化的克隆增殖阶段与终末分化阶段都明显升高,miR-140-5p通过上调PCAF的表达促进PPARγ和C/EBPs表达而促进前脂肪细胞成脂分化。双荧光素酶试验结果显示,miR-140-5p与PCAF之间无靶标关系,说明miR-140-5p可能通过间接作用于PCAF而促进前脂肪细胞的分化。

