银耳多糖-壳寡糖纳米复合体系构建及其对BSA释放特性的影响
王欢,赵永亮,安星亮,姚启悦,李飞寰,任军华,赵春杰
(河南工业大学生物工程学院,河南 郑州 450001)
近年来,功能性蛋白质或多肽类食品因其安全、无毒且在疾病预防与健康改善方面的功效突出而受到学者的广泛关注。然而,由于蛋白质与多肽类产品在胃部耐受性差,遇酸易变性,小肠吸收率低,导致其功能性严重损耗[1]。研究者为提高蛋白质及多肽类的生物利用度,构建了诸多递送体系。聚电解质纳米载药体系主要是指带相反电荷的聚离子电解质通过静电作用力形成纳米尺寸(10 nm~1 000 nm)的复合物,具有对活性物质缓释以及pH值响应释放的优良特性,对蛋白质进行负载,可以实现提高其稳定性与利用率[2],现已成为近年来国内外学者研究热点。
多糖纳米载体体系除具有安全无毒、价格低廉等优点外,还具有靶向特异性酶降解以及酸碱环境触发性解离的性质,使其在蛋白质递送系统领域有较高的应用价值[3-4]。壳寡糖(chitooligosaccharides,COS)是自然界少有的天然碱性寡糖,除具有分子量低、空间位阻小的结构特点外,还具有低溶血活性、低细胞毒性与易被人体吸收利用等特性[5-6]。银耳多糖(Tremella fuciformis polysaccharides,TFP)由葡萄糖醛酸、木糖以及少量葡萄糖组成,是一种具有良好的抗炎、抗肿瘤、成膜性等多种生物活性的天然多糖,并且进入体内很少引起副反应[7-11]。除此之外,葡萄糖醛酸的存在使银耳多糖在水溶液中具有负电荷,使其容易与带正电荷的聚电解质通过静电自组装形成复合物。近年来,对于壳寡糖和银耳多糖,分别出现了许多以其复合物负载功能性食品的研究:Chebl等[12]研究发现,壳寡糖与乳酸可通过自组装作用形成包含5个特殊疏水微区的纳米聚集体,并利用疏水微区对姜黄素实现了负载;Wang等[13]制备了纳米结构的银耳多糖-壳聚糖复合物,并证实其具有良好的控释性能;蒋艳荣等[14]研究发现壳寡糖与黄芩苷的复合物可用于保护稳定性较低的活性物质;Tian等[15]证明玉米醇溶蛋白和银耳多糖可作为胃肠道输送药物的硬胶囊材料。目前,尚无学者对银耳多糖-壳寡糖(Tremella fuciformis polysaccharide and chitosan oligosaccharide,TFP-COS) 纳米复合体系的构建以及控释特性进行研究。
因此,本研究将壳寡糖与银耳多糖通过聚电解质络合法复合,并对复合物稳定性进行研究;以牛血清蛋白为模型蛋白质,探究COS-TFP纳米复合物对牛血清蛋白(bovine serum protein,BSA)的包埋率以及在不同pH值缓冲溶液(pH值分别为2.0、4.0与7.0)释放情况的载药与释药特性,以期提高功能性蛋白质的生物利用度,为相关功能性产品的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
银耳多糖(多糖含量不低于74%):河北韩美生物科技有限公司;壳寡糖(脱乙酰度90.14%):上海麦克林生化科技有限公司;牛血清蛋白(纯度不低于96%):白鲨生物科技有限公司;氢氧化钠、盐酸、氯化钠(均为分析纯):天津市科密欧化学试剂有限公司。
1.2 仪器与设备
台式pH计(FiveEasy):上海梅特勒-托利多仪器有限公司;电子天平(ALC-2103):北京赛多利斯仪器系统有限公司;多功能酶标仪(Tecan Infinite M1000 PRO):上海新领生物科技发展有限公司;纳米粒度仪(Nano S90)、电位分析仪(Zetasizer NanoZ):英国马尔文仪器有限公司;台式恒温振荡摇床(THZ-312):上海精宏实验设备有限公司;台式高速离心机(TGL-16C):上海菲恰尔分析仪器有限公司。
1.3 方法
1.3.1 COS-TFP复合物的合成
参考Ye等[16]的制备方法并稍作改进:首先,准确称取一定质量的TFP、COS样品,分别溶于去离子水中,得到浓度分别为10 mg/mL的TFP和COS溶液,备用。其次,制备COS-TFP复合物,具体制备过程如下:控制 COS 与 TFP 总浓度(1、2、3、4、5、6、7 mg/mL,固定COS 与 TFP 浓度比为 1∶3,NaCl浓度为 20 mmol/L,pH值为4.0)为一定值,按照一定COS与TFP浓度比(2∶1、1∶1、1∶2、1∶3、1∶4、1∶5、1∶6,固定 COS 与 TFP 总浓度为 2 mg/mL,NaCl浓度为 20 mmol/L,pH 值为 4.0)加入TFP贮藏溶液,按照对应比例缓慢滴加COS贮藏溶液,混匀后加入一定浓度 NaCl溶液(0、2.5、5、10、20、30、50 mmol/L,固定 COS 与 TFP 浓度比为 1∶3,COS 与TFP总浓度为2 mg/mL,pH值为 4.0),调节 pH值(3.0、3.5、4.0、4.5、5.0、5.5、6.0,固定 COS 与 TFP 浓度比为 1∶3,COS 与 TFP 总浓度为 2 mg/mL,NaCl浓度为30 mmol/L),在转速为 300 r/min、25 ℃的条件下,搅拌30 min,2 500 r/min离心10 min,取上层清液,即得到COS-TFP分散溶液,以研究COS与TFP浓度比、COS与TFP总浓度、NaCl浓度、pH值对COS-TFP复合物稳定性的影响。
1.3.2 电位、粒径、分散性指数的测定
将复合物溶液进行稀释并分散均匀后,取1 mL放入样品池,采用纳米粒度分析仪与Zeta电位分析仪分别测定COS-TFP复合物的电位、粒径、分散性指数[17]。
1.3.3 COS-TFP-BSA复合物的合成
称取一定量BSA溶解于去离子水中,以200 r/min的速度于25℃条件下搅拌30min,得到浓度为25mg/mL的 BSA 溶液,按照一定浓度比(1∶0.1、1∶0.2、1∶0.4、1∶0.6、1∶0.8、1∶1、1∶2、1∶4)将 BSA 与 1.3.1 中制备的 COS-TFP分散溶液混合得到COS-TFP-BSA复合物。
1.3.4 BSA包埋率以及释放率的测定
1.3.4.1 BSA标准曲线的测定
配制不同浓度的BSA标准溶液,采用Bradford法[18]测上清液BSA的浓度,绘制吸光度-牛血清蛋白质量浓度标准曲线,得到线性回归方程(1)。
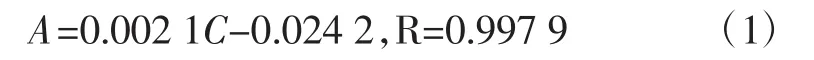
式中:A为上清液吸光度;C为牛血清蛋白质量浓度,mg/L;R为相关系数。
1.3.4.2 包埋率的测定
将COS-TFP-BSA溶液高速离心获得上清液,并以高速离心后的COS-TFP复合物溶液作为空白对照组,采用1.3.4.1所示方法测上清液BSA溶液的质量浓度;按照公式(2)计算BSA的包埋率[18]。
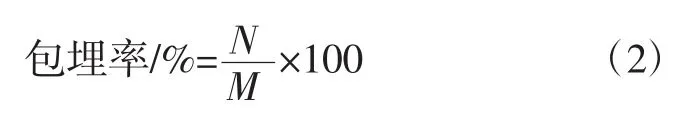
式中:N为COS-TFP复合物负载BSA的质量,μg;M为溶液中总BSA的质量,μg。
1.3.4.3 不同pH值缓冲溶液释放曲线测定
取COS-TFP-BSA样品溶液100 mL,离心后向沉淀中加入100 mL不同pH值缓冲溶液(模拟胃液pH4.0磷酸盐缓冲溶液,模拟肠液pH7.0磷酸盐缓冲溶液),混合均匀后分装于离心管中,在37℃、100 r/min条件下恒温振荡6 h,每间隔0.5 h取样,按照1.3.4.1所示方法测定蛋白含量,并用公式(3)计算累计释放率[19]。
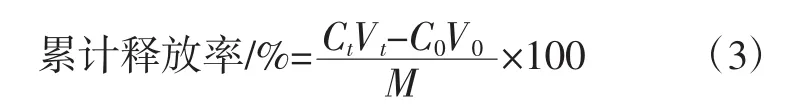
式中:Ct为t时刻溶液中游离BSA的浓度,μg/mL;Vt为t时刻溶液体积,mL;C0为0时刻溶液中游离BSA 的浓度,μg/mL;V0为 0 时刻溶液体积,mL;M 为在COS-TFP复合物负载BSA全部溶解时的pH值条件下BSA最大释放量,μg。
1.4 数据处理
采用SPSS 20.0对数据进行统计分析,Origin 2021与Excel 2016进行绘图,以上所有试验均重复3次,结果取平均值,并以平均值±标准差表示。
2 结果与分析
2.1 COS与TFP溶液的电位随pH值变化趋势
图1为在不同pH值条件下COS与TFP溶液电位变化趋势。
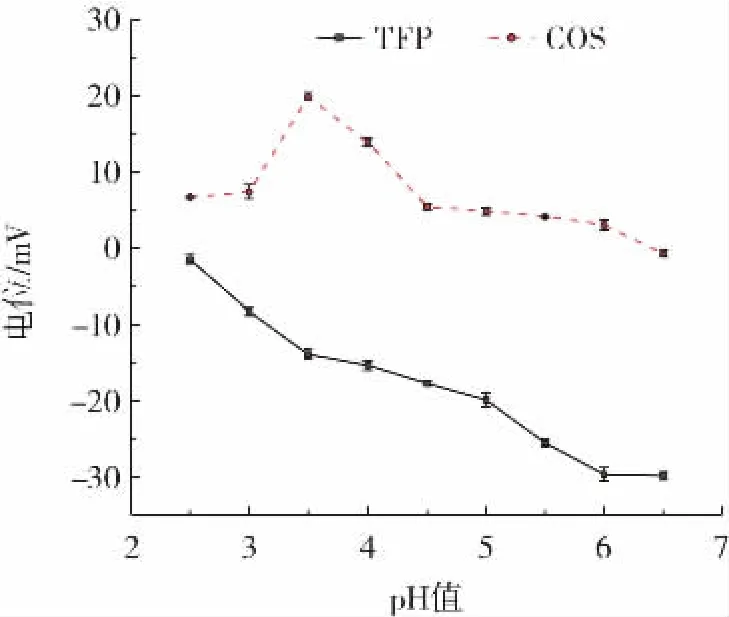
图1 不同pH值条件下COS溶液与TFP溶液电位变化曲线Fig.1 The electric of chitooligosaccharide and Tremella fuciformis polysaccharide solution at different pH
由图1可知,在pH值小于6.0的溶液中,COS分子的-NH2被质子化形成-NH3而带有正电荷,pH值范围为2.5~3.5时,COS溶液电位随pH值升高而逐渐增加,从6.64 mV升高至19.83 mV,推测是壳寡糖在此pH值范围溶液中呈现球形,表面暴露的氨基数目少;当pH值继续增大至4.5时,溶液中质子的逐渐减少导致壳寡糖电位逐渐降低至接近0 mV。随着溶液pH值的升高,TFP分子所带负电荷先缓慢增加后迅速增加,电位绝对值呈现上升趋势,分析其原因,可能是由于TFP的羧基基团酸度系数pKa≈3.5,当pH值小于3.5时,羧基基团电离程度低,TFP溶液电位较低[20]。
2.2 不同TFP与COS总浓度对COS-TFP复合物的影响
不同TFP与COS总浓度对复合物粒径、分散性指数、电位的影响见图2。

图2 不同TFP与COS总浓度对复合物粒径、分散性指数、电位的影响Fig.2 The effect of biopolymer concentrations of TFP and COS in the particle size,PDI,zeta-potential of the COS-TFP nanocomposites
由图2可知,随着TFP与COS总浓度从1 mg/mL升高到7 mg/mL,形成的复合物粒径逐渐增大,且浓度为1 mg/mL与2 mg/mL时不存在显著性差异(p>0.05);这可能是由于随着浓度增高,单位体积溶液中存在的复合物越多,分子间静电结合作用更易发生,从而形成粒径较大的聚集体[21]。随总浓度增大,分散性指数变化程度小,且在2 mg/mL时达到最低值0.21;电位绝对值随总浓度升高而降低,当总浓度小于2 mg/mL时,电位绝对值高于15 mV(体系处于稳定状态[22]);综上,复合物形成的最适合TFP与COS总浓度为2 mg/mL。Coelho等[23]也发现,只有当溶液中多糖浓度较低时,才会形成尺寸较小且稳定的复合物。
2.3 不同COS与TFP浓度比对COS-TFP复合物的影响
不同COS与TFP浓度比对COS-TFP复合物电位、粒径、分散性指数如图3所示。
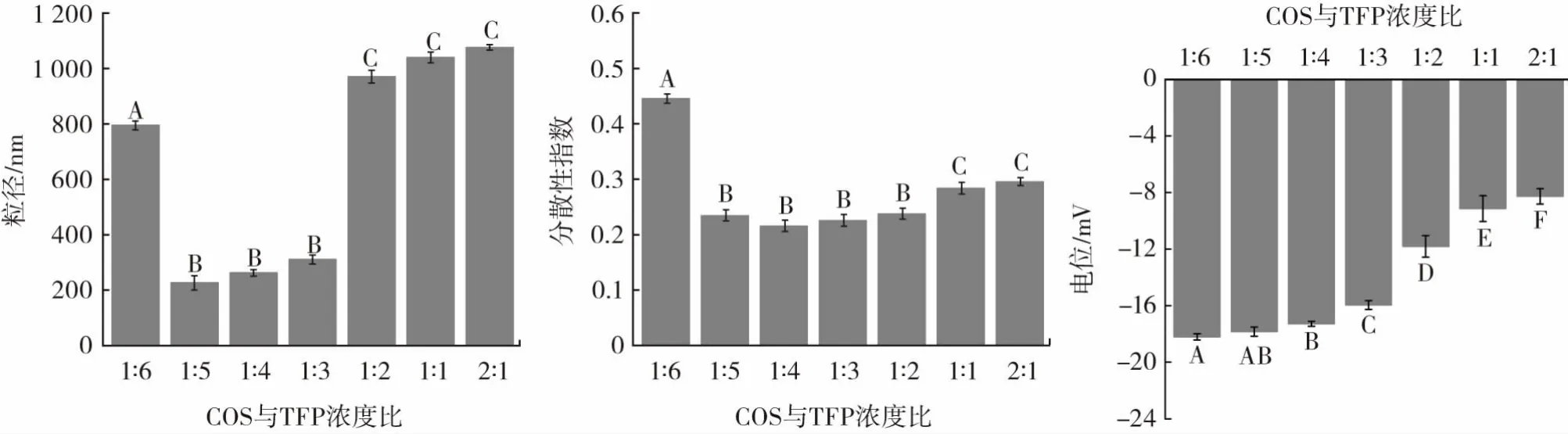
图3 不同COS与TFP浓度比对复合物粒径、分散性指数、电位的影响Fig.3 The effect of concentration ratios of COS and TFP in the particle size,PDI,zeta-potential of the COS-TFP nanocomposites
随着COS与TFP浓度比增加,复合物的粒径呈现出先下降后上升的趋势,其中COS与TFP浓度比范围为1∶5~1∶3粒径尺寸低于400 nm且无显著性差异(p>0.05);COS 与 TFP 浓度比范围为 1∶5~1∶2 时,分散性指数均低于0.3且无显著性差异(p>0.05);电位绝对值随COS与TFP浓度比增加而呈现出降低趋势,当 COS 与 TFP 浓度比范围为 1∶6~1∶3 时,电位绝对值超过15 mV。
COS/TFP浓度比增加时,复合物的电位绝对值降低,这归因于TFP所带负电荷逐渐被越来越多的COS正电荷中和,导致复合物所带电荷逐渐减少[24]。而COS与TFP浓度比高于1∶3时,可与COS结合的TFP负电荷处于稀少状态,导致粒子间静电斥力降低,出现聚集状态[25],粒径从311 nm迅速增加到1 076 nm。体系均一分布状态也被破坏,多分散指数大。杜志阳[26]研究壳寡糖静电结合三聚磷酸钠时也发现相同结论。综上所述,COS 与 TFP 浓度比为 1∶5~1∶3 时,体系分布更均一,粒径更小,更加稳定。
2.4 不同NaCl浓度对COS-TFP复合物的影响
不同NaCl浓度对复合物粒径、分散性指数、电位的影响见图4。

图4 不同NaCl浓度对复合物粒径、分散性指数、电位的影响Fig.4 The effects of NaCl concentrations in the particle size,PDI,zeta-potential of the COS-TFP nanocomposites
从图4中可以看出,粒径随NaCl浓度增加出现先增大后降低的趋势,其中,当20 mmol/L<NaCl浓度≤50 mmol/L时,粒径处于300 nm附近,并且无显著差异(p>0.05)。随着 NaCl浓度增加,电位绝对值增加,且当20 mmol/L≤NaCl浓度≤50 mmol/L时,电位绝对值超过15 mV。随着NaCl浓度增大,分散性指数逐渐增大,在NaCl浓度为50 mmol/L时增大较多,分散性指数超过0.3,体系均一性较差。分析其原因,NaCl浓度<5 mmol/L时,TFP分子的-COO-基团被屏蔽,分子链趋于柔软,更易于与COS形成聚集,粒径增大[20]。5 mmol/L≤NaCl浓度≤10 mmol/L时,TFP分子可能进一步弯曲,同时颗粒间静电斥力增大,不易聚集,粒径降低[27];之后,NaCl浓度>10 mmol/L 时,NaCl在溶液中解离出的正负离子会静电结合到TFP与COS上的相反电荷上,引起静电作用的竞争效应,少了TFP与COS结合位点,导致COS-TFP复合物形成能力随离子浓度增加而降低,表现为分散性指数增大[28]。
综上,NaCl浓度为20 mmol/L~50 mmol/L,电位绝对值处于复合物稳定范围,分散性指数小于0.3,粒径分布无显著差异。该结果与张立彦等[29]研究NaCl对壳寡糖/果胶静电自组装作用影响的结论相似。
2.5 不同pH值对COS-TFP复合物的影响
不同pH值对复合物粒径、分散性指数、电位的影响如图5所示。

图5 不同pH值对复合物粒径、分散性指数、电位的影响Fig.5 The effect of pH in the particle size,PDI,zeta-potential of the COS-TFP nanocomposites
随着pH值升高,粒径先升高后降低,且pH值范围为3.0~4.0时不存在显著性差异(p>0.05);随着pH值升高由3.0至4.0时,分散性指数由0.317降低达到0.221;复合物电位的绝对值随pH值增大而增加。pH值为3.0时,分散性指数高于0.3,可能是由于此时COS与TFP所带电荷数目低,复合物形成程度低,体系存在不同尺寸物质。随着pH值升高,带有相反电荷的TFP与COS通过静电相互作用形成一定尺寸的聚电解质复合物,表现为粒径增加[20],分散性指数降低,体系趋于均一化。随着pH值继续升高至5.0,体系中电位绝对值突然增大,复合物之间排斥力增大,复合物进一步卷曲,致使粒径呈现降低趋势[30]。综合考虑分散性指数、电位、粒径,选择pH值为4.0时作为制备稳定复合物的pH值。
2.6 负载BSA的COS-TFP复合物包埋率
表1是负载不同BSA含量的COS-TFP复合物的包埋率情况。
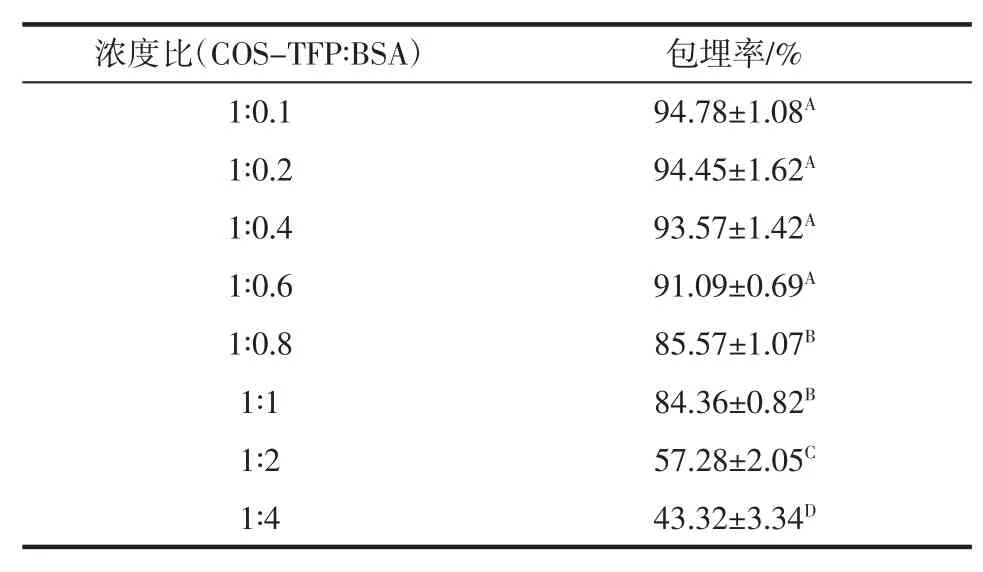
表1 不同COS-TFP与BSA浓度比下银耳多糖-壳寡糖复合物对牛血清蛋白的包埋率Table 1 The effect of COS/TFP∶BSA of the encapsulation efficiency of BSA
随着BSA浓度的增加,BSA包埋率逐渐降低。其中当 COS-TFP 与 BSA 浓度比为 1∶0.1、1∶0.2、1∶0.4、1∶0.6时,COS-TFP复合物对BSA的包埋率均达到90%以上,且无显著性,该结果与之前研究结果相同[31];当BSA浓度继续增加,可能由于过量添加BSA超出COS-TFP包埋能力,包埋率继续降低。综上所述,选择1∶0.6的浓度比更具有经济效益。
2.7 负载BSA的COS-TFP复合物在不同pH值缓冲溶液中的释放
图6显示了负载BSA复合物在不同pH值缓冲液条件下的累计释放率变化情况。
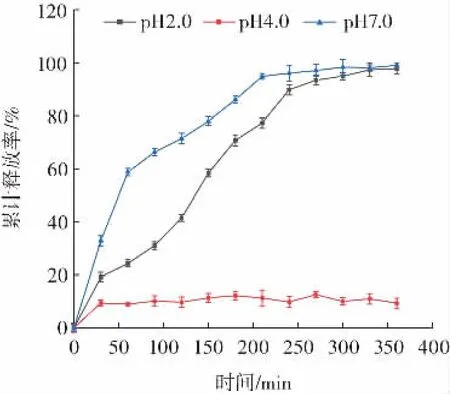
图6 不同pH值缓冲溶液中BSA的释放情况Fig.6 Release of BSA in buffer solutions with different pH values
pH值为4.0(体外模拟饱食胃部pH值)时,累计释放率随时间变化而围绕10%释放率呈现平稳波动状态,说明此条件下,BSA几乎不被释放。分析其原因,COS分子在pH值低于6.2时氨基质子化形成-NH3+,可与TFP分子上的-COO-通过静电相互作用形成复合物,而BSA在等电点(PI=4.7)以下溶液中带负电荷,也可与TFP形成复合物。因此,饱食(胃部pH值为3.0~4.0后服用可保护蛋白质不被胃酸破坏[32]。pH值为2.0(体外模拟空腹胃部pH值)时,BSA释放情况可以分为两个阶段:第一阶段为释放时间≤240 min,BSA释放率从0%上升至89.87%,释放时间>240 min,BSA几乎全部释放。分析其原因,在pH值为2.0时,BSA与COS带正电荷,且TFP所带负电荷较少,导致三者静电作用减弱,BSA游离。pH值为7.0(体外模拟小肠pH值)时,随时间变化载BSA释放情况分为3个阶段:释放时间≤60 min时,为快速释放阶段,释放率由0变为58.74%。60 min<释放时间≤210 min时,为慢速释放阶段,释放率由58.74%变为94.97%。释放时间>210min时,剩余BSA极缓慢释放至完全。壳寡糖几乎不带电,且BSA带负电荷,此时复合物解离,BSA游离[25]。
3 结论
本文讨论了COS与TFP浓度及质量比、盐离子浓度、溶液pH值对COS-TFP聚电解质复合体系分散性指数、粒径、电位的影响。结果表明,TFP与COS相互作用形成稳定复合物的条件:TFP与COS总浓度为 2 mg/mL、TFP 与 COS 浓度比为 1∶5~1∶3、NaCl浓度为20 mmol/L~50 mmol/L、pH值为4.0。利用此条件下形成的复合物对BSA进行负载,当COS-TFP复合物与BSA浓度比为时1∶0.6,BSA包埋率达到91%,pH值为4.0时,BSA几乎不被释放,pH值为7.0时,BSA释放速率较快,60 min累计释放率达到58.75%,在一定程度上提高蛋白质及多肽类的生物利用率。因此,COS-TFP实现对蛋白以及多肽类的控释,可作为潜在的蛋白质类控释运载体系,同时也为银耳多糖的综合应用开辟了新途径。

