荞麦种子高萌发率虫生真菌菌株的筛选
彭雪,吴煜,张晓娜*,陈万浩,朱丽伟,陈庆富*,邓娇
荞麦种子高萌发率虫生真菌菌株的筛选
彭雪1,吴煜1,张晓娜1*,陈万浩2,朱丽伟1,陈庆富1*,邓娇1
1. 贵州师范大学 荞麦产业技术研究中心, 贵州 贵阳 550001 2. 贵州中医药大学基础医学院 菌物药研究中心, 贵州 贵阳 550025
筛选促进荞麦种子萌发效果最佳的虫生真菌菌株,为研究虫生真菌对荞麦的促生机制提供理论基础,本文采用4种虫生真菌16株菌株的芽孢子和分生孢子悬液以1×106个/mL的浓度浸种2个品种6个品系的荞麦种子,获得对荞麦种子萌发效果最佳的虫生真菌菌株。结果表明,16株虫生真菌菌株均可提高荞麦种子的萌发率、芽长和芽直径长度,且对米苦荞种子的促生作用大于甜荞;多数分生孢子对萌发率、芽直径的促生作用较芽孢子效果好,多数芽孢子对荞麦芽长的促生作用较好。
荞麦; 种子萌发; 虫生真菌
荞麦属于蓼科(Polygonaceae)荞麦属(),约有23个物种,其中甜荞()和苦荞()是两个主要的粮用栽培种。目前荞麦的消费产品主要以其种子加工后的食品为主,如馒头、面包、面条、糕点[1]等食物,其富含的淀粉、黄酮类物质、矿物质等保健成分,具有“三降”(降血压、降血糖、降血脂)、“三抗”(抗氧化、抗炎、抗癌)等功能[2-4],使其成为集营养、医疗、保健为一体的重要粮药兼用作物[5]。
种子萌发是预测后续植株发育和农业产量的关键阶段。如何在保证安全的情况下既能提高其萌发率、出苗率,又能促进其芽苗的生长,成为研究者关注最高的问题。目前,用于促进荞麦种子萌发的技术与方法主要有超声波处理[6]、添加赤霉素、吲哚乙酸[7]等植物生长调节剂,使用硼肥溶液[8],改变温度和光照[9],去果皮[10]等,但化学添加剂对生物和环境有一定的负面影响,其它方法耗时耗力且不能大规模有效的应用于生产实践中,因此迫切需要寻找新的安全的生物技术来促进种子萌发。
虫生真菌(Entomopathogenic fungi)以其能够寄生于昆虫、蜘蛛等节肢动物中致其死亡,又对人畜无危害、环境无污染[11],且在自然状态下或通过人工接种的方式(如叶面喷施、伤口涂抹、注射法、浸种法、根茎浸没、种子包衣等)定殖于植物中,促进植物生长、免受病虫害侵扰而备受青睐[12-15]。
因此,本文拟研究环链棒束孢、粉棒束孢、蝙蝠蛾拟青霉、玫烟色棒束孢4种虫生真菌的16株菌株对米13、米18、米55、1412-16、贵甜2号、红甜1号6个荞麦品系种子的浸种实验,获得对荞麦种子萌发效果最佳的虫生真菌菌种和菌株,探究虫生真菌对荞麦种子萌发的影响,以期为进一步研究虫生真菌与荞麦的相互作用机制提供材料及理论依据。
1 材料与方法
1.1 试验材料
供试荞麦品种:共2个品种6个品系,分别为米苦荞(米13、米18、米55),甜荞(贵甜2号、1412-16、红甜1号),均由贵州师范大学荞麦产业技术研究中心提供。
供试菌株:此试验中菌株1、6号为贵州中医药大学陈万浩博士馈赠,其他菌株均由贵州师范大学荞麦产业技术研究中心提供(表1)。
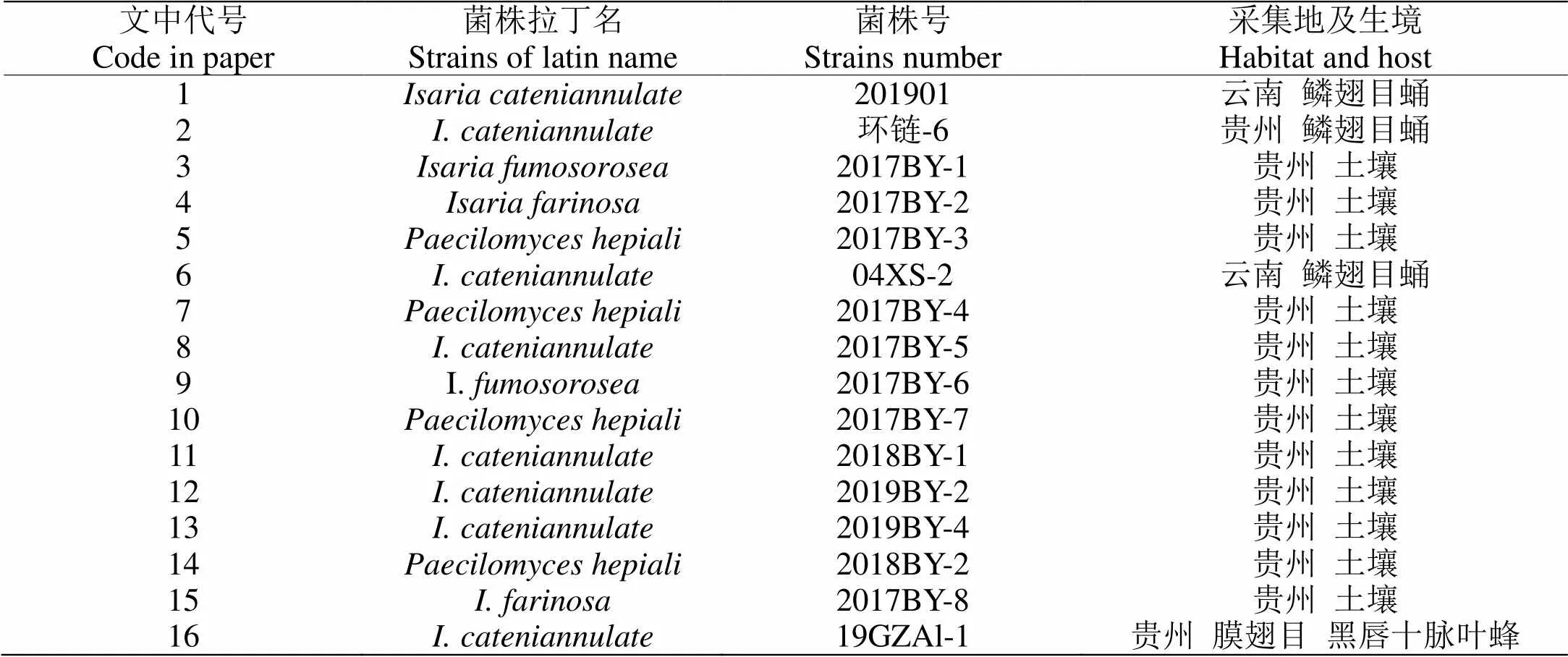
表 1 供试虫生真菌菌株
1.2 试验方法
1.2.1 材料预处理芽孢子悬液制备:在试管中挑取菌丝接种到150 mL PDA液体培养基的250 mL锥形瓶中,在150 r/min、25 ℃的恒温摇床中培养5 d,用双层擦镜纸过滤菌悬液,获得芽孢子悬液。用血球计数板计数,测定孢子浓度,用无菌水将孢子悬液浓度稀释至1×106个/mL。
分生孢子悬液制备:将供试菌株接种于PDA固体培养基上,于25 ℃培养箱培养20 d,待培养基上长满菌落,用0.05%吐温-80无菌水洗涤,并用双层擦镜纸过滤,获得分生孢子悬液。用血球计数板测定孢子浓度,用0.05%吐温-80无菌水将孢子悬液浓度稀释至1×106个/mL。
1.2.2 消毒将选取的荞麦种子进行表面消毒,先用无菌水清洗1遍,再用70%的无水乙醇浸泡1 min,25%的次氯酸钠表面消毒1 min,最后用无菌水清洗表面的次氯酸钠残留液,清洗3次,将最后一次清洗种子的无菌水取1滴进行培养,连续观察5 d发现无菌长出,则为消毒成功。
1.2.3 浸种将每种荞麦的30粒种子置于1.2.1中制备的15 mL孢子悬液中完全浸没,于室温下浸种2h,对照组分别用液体培养基和0.05%吐温-80无菌水浸种,条件与实验组一致。
1.2.4 培养将浸种后的种子以每种30粒,5颗/每行*6行的方式置于发芽盒(12×12 cm)中,3个重复,在温度为25±1 ℃,相对湿度为70±5%,光照周期L:D=12:12的培养箱中连续培养3 d,露白即视为萌发,每天记录萌发数,第3 d用游标卡尺测量其芽长和芽直径。
1.3 数据分析
萌发率(%)=(萌发种子总数/供试种子总数)×100%。
萌发指数()=∑(/),为第日的萌发种子数,为相应的萌发天数。
用Excel 2010进行基础数据统计分析和作图,SPSS 24.0软件进行统计分析,应用独立样本检验方法在0.05水平对两组数据进行差异显著性分析,采用Tukey法在0.05水平对多组数据进行差异显著性分析。
2 结果与分析
2.1 16株虫生真菌菌株的孢子悬液对荞麦种子萌发率的影响
如表2、3、4、5、6、7所示,用16株虫生真菌菌株的芽孢子、分生孢子悬液分别对米苦荞和甜荞进行浸种后,种子萌发率随时间的延长而增加,除贵甜2号与对照组无显著性差异外,实验组的萌发率、萌发指数均高于对照组,同一天同一菌株对比芽孢子、分生孢子悬液对米苦荞种子萌发率结果发现差异不显著。
第3 d菌株4、7号芽孢子悬液和菌株13号分生孢子悬液浸种的米13种子萌发率最高,分别为96.67±3.33%和97.78±1.92%,分别是对照组的1.13倍和1.17倍(表2);菌株1、5号的芽孢子和菌株12号分生孢子浸种的米18种子萌发率达100%,分别是对照组的1.07倍和1.09倍(表3);菌株10号芽孢子悬液和菌株12号分生孢子悬液浸种的米55种子萌发率最高,分别为100.00±0.00%和98.89±1.92%,分别是对照组的1.11倍和1.21倍(表4)。
相较米苦荞种子,甜荞种子前3 d萌发率、萌发指数均较低,其中菌株5号芽孢子悬液和菌株3号分生孢子悬液浸种的1412-16种子萌发率最高,分别为31.67±2.36%和35.00±2.36%,分别是对照组的14.27倍和15.77倍(表6);菌株5号芽孢子悬液和菌株8号分生孢子悬液浸种的红甜1号种子萌发率最高,分别为48.33±7.07%和56.67±4.72%,分别是对照组的3.63倍和3.64倍(表7)。

表 2 16株虫生真菌菌株的孢子悬液对米13萌发率的影响
注:表中所有数据为平均值±标准误,同列不同小写字母表示同列不同菌株之间差异显著(<0.05),“*”表示同一天同一菌株分生孢子与芽孢子之间差异显著(<0.05)。下同。
Note: The data are presented as the mean ± SE.The different lowercase letters in the same column present significant differences among the different strains in the same column at<0.05. “*”presents the significant differences between the aerial conidia and submerge conidia of the same srains on the same day at< 0.05. The same as follows.
2.2 16株虫生真菌菌株的孢子悬液对荞麦种子芽长的影响
如图1所示,用16株虫生真菌的孢子悬液浸种后,不同菌株、不同孢子悬液对不同品种种子芽长的影响不同,米苦荞中,除菌株2号的芽孢子悬液和菌株5、9号分生孢子悬液外,其他菌株实验组芽长均高于对照组,其中菌株8号芽孢子悬液和菌株6号的分生孢子悬液对米13、米18的促生效果最好,菌株5号的芽孢子悬液和菌株6号的分生孢子悬液对米55芽长促生效果最好(图1A、1B、1C);相较米苦荞,虫生真菌对甜荞种子芽长的促生效果较小,其中菌株15号、8号的芽孢子和菌株6号、7号、4号的分生孢子分别对红甜1号、贵甜2号、1412-16的促生效果最好(图1D、1E、1F);芽孢子和分生孢子相较,除1412-16和贵甜2号,多数芽孢子对荞麦芽长的促生作用较好。
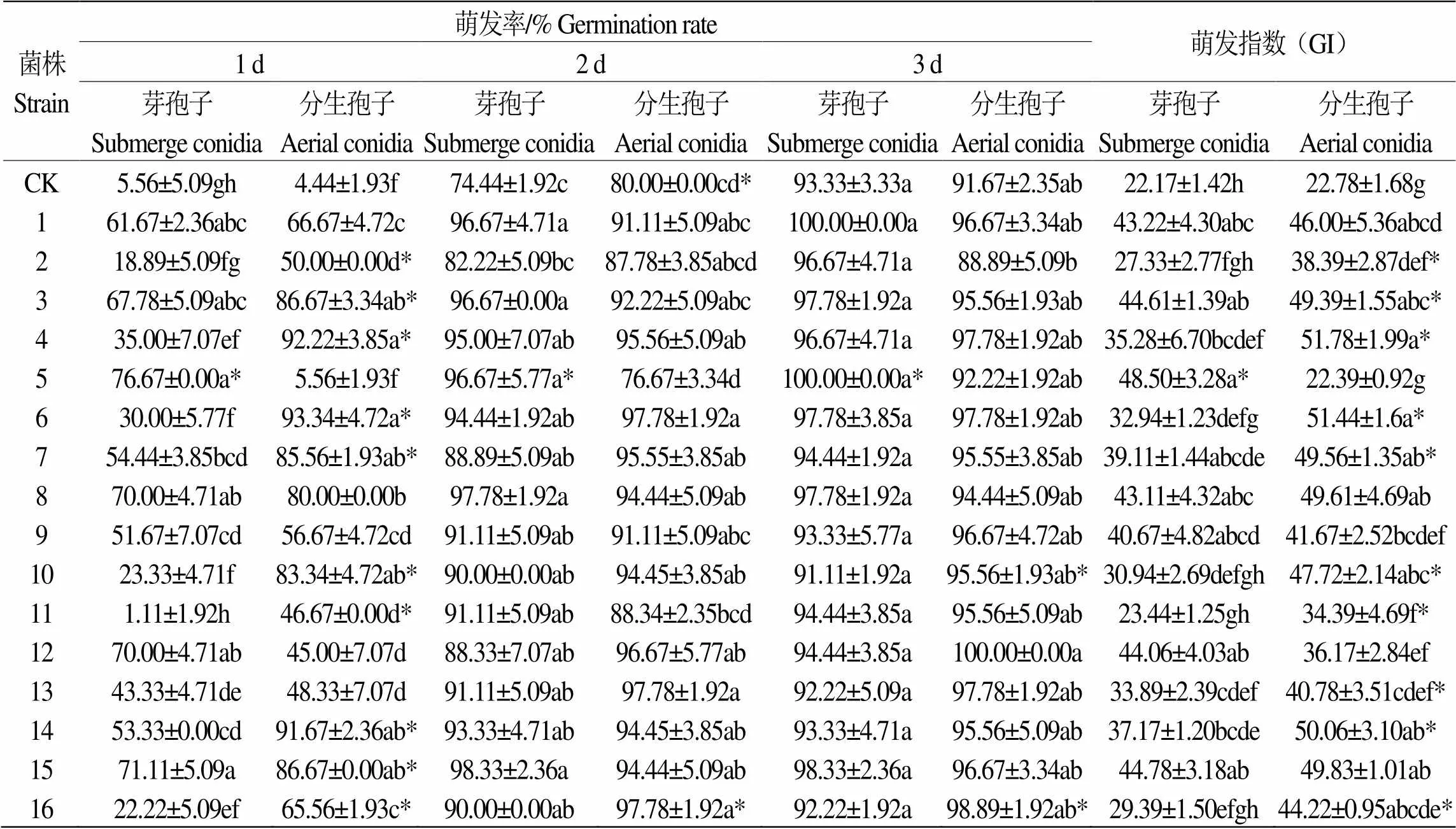
表 3 16株虫生真菌菌株的孢子悬液对米18萌发率的影响
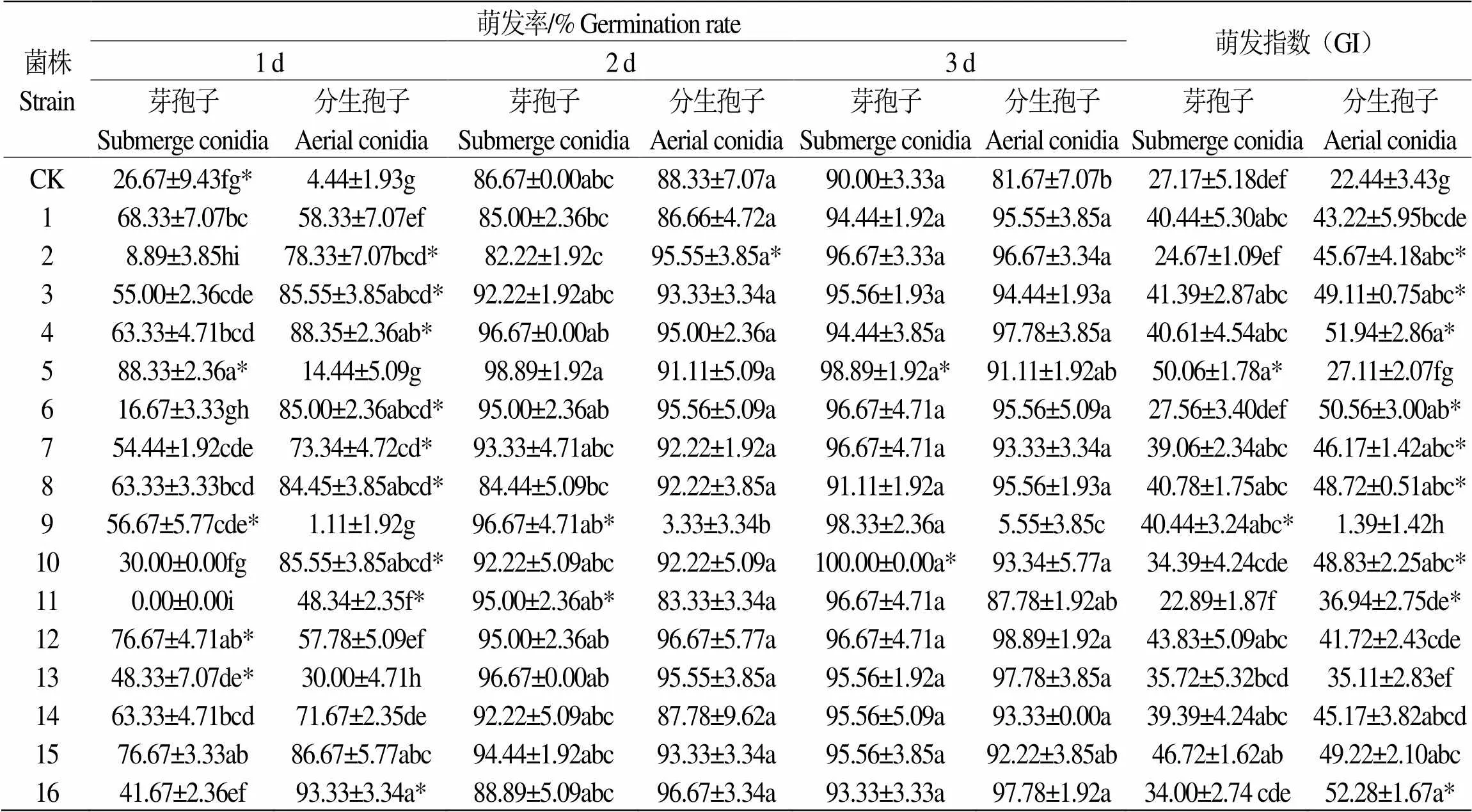
表 4 16株虫生真菌菌株的孢子悬液对米55萌发率的影响

表 5 16株虫生真菌菌株的孢子悬液对贵甜2号萌发率的影响
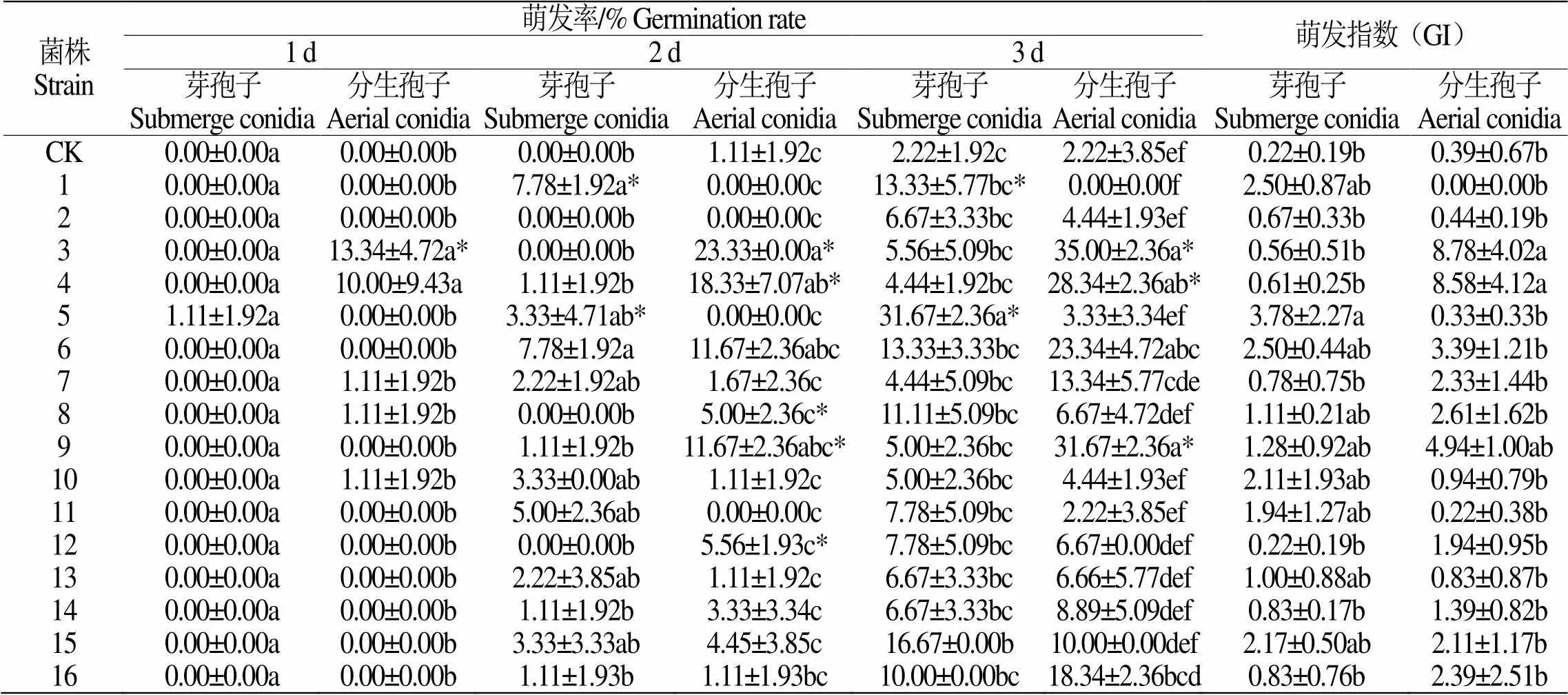
表 6 16株虫生真菌菌株的孢子悬液对1412-16萌发率的影响
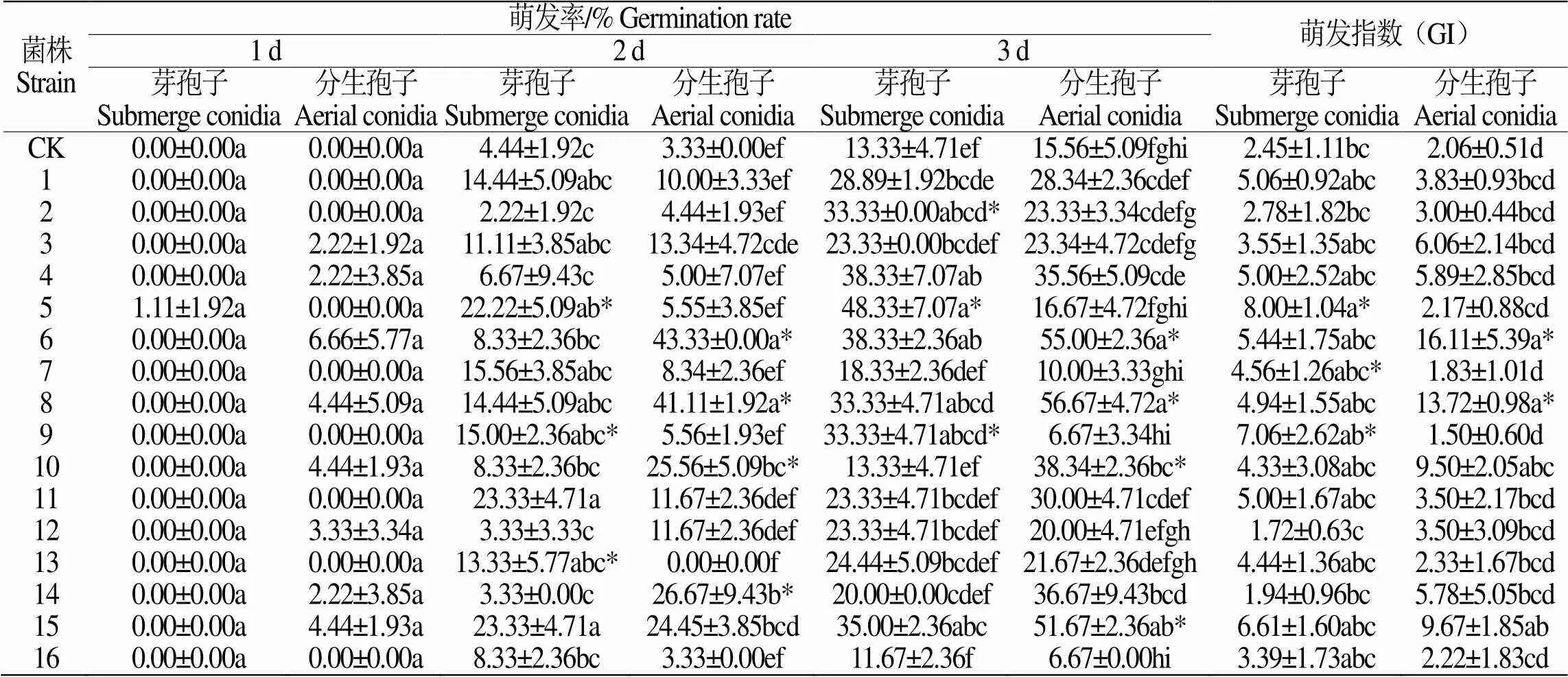
表 7 16株虫生真菌菌株的孢子悬液对红甜1号萌发率的影响

注:“*”表示同一菌株分生孢子与芽孢子差异显著(˂0.05)。
Note: “*”presents the significant differences between the aerial conidia and submerge conidia of the same srains on the same day at the< 0.05.
2.3 16株虫生真菌菌株的孢子悬液对荞麦种子芽直径的影响
如图2所示,用16株虫生真菌菌株的孢子悬液浸种后,不同菌株、不同孢子悬液对不同品种种子芽直径的影响不同。米苦荞中,多数菌株的分生孢子较芽孢子效果好,菌株1号的芽孢子和菌株9号的分生孢子对米13的芽直径促生最快;菌株2号的芽孢子和菌株14、15号的分生孢子对米18的芽直径促生最快;菌株1、2号的芽孢子和菌株16号的分生孢子对米55芽直径促生最快(图2A、2B、2C)。
相较米苦荞,虫生真菌对甜荞芽直径的作用较弱,但多数虫生真菌对芽直径有促进作用,极少数(如2号、12号)不显著,且多数分生孢子效果较芽孢子好,菌株9号的芽孢子悬液和菌株6号的分生孢子悬液对红甜1号芽直径促生最快;菌株5号的芽孢子悬液和菌株3号的分生孢子悬液对1412-16的芽直径促生最快;菌株5号的芽孢子悬液和菌株7号的分生孢子悬液对贵甜2号的芽直径促生最快(图2D、2E、2F)。

图 2 16株虫生真菌菌株的孢子悬液对荞麦种子芽直径的影响
注:“*”表示同一菌株分生孢子与芽孢子差异显著(˂0.05)。
Note: “*”presents the significant differences between the aerial conidia and submerge conidia of the same srains on the same day at< 0.05.
3 结论与讨论
虫生真菌可通过浸种的方式定殖于植物促进其生长。用球孢白僵菌孢子悬液浸种牛蒡,可促进其生长[16];用白僵菌、玫烟色棒束孢浸种大豆,可提高植株的株高和地上、地下部分的干鲜重[17];用环链虫草浸种番茄,对其生长有显著促进作用[18];本文用环链棒束孢、粉棒束孢、蝙蝠蛾拟青霉、玫烟色棒束孢4个菌种的孢子悬液浸种荞麦种子,不仅能够提高荞麦种子的萌发率,还可促进芽长的生长,与前者研究相似,这也进一步验证了虫生真菌的促生作用。
虽然虫生真菌对作物有促生作用,但不同菌种、不同菌株、不同孢子悬液对不同作物品种的促生效果不同。Qayyum MA等的研究表明2株白僵菌可促进番茄生长,1株白僵菌则表现出减少地上部分干重和果实重量的副作用[19]。本文中菌株9号分生孢子悬液浸种的种子萌发率、芽长、芽直径都显著低于对照组,其余大部分菌株均能不同程度的促进种子萌发、芽长、芽直径的生长。芽孢子与分生孢子悬液相比,多数分生孢子对萌发率、芽直径促生作用较芽孢子效果好,多数芽孢子对荞麦芽长的促生作用较好。用不同虫生真菌对甜荞和米苦荞进行浸种后,米苦荞全部萌发了,甜荞种子并未全部萌发,这可能与荞麦种子壳薄厚有关,以及菌株芽孢子和分生孢子所含碳水化合物的不同有关,但有待进一步验证。
本研究首次证明了虫生真菌对荞麦种子的萌发有促进作用,且筛选出菌株12号的分生孢子悬液对米55种子的萌发效果最好,这将为研究虫生真菌促进植物生长提供新的材料,为理解互作作用提供了新的思路。
[1] 李可心,周冉冉,陈茂彬,等.荞麦功能性成分及相关食品开发[J].现代农业科技,2021(7):236-240
[2] 冉盼,杨丽娟,崔娅松,等.自交可育甜荞、金苦荞、米苦荞17株品系总黄酮、粗蛋白及其蛋白组分含量研究[J/OL]. 广西植物.https://kns.cnki.net/kcms/detail/45.1134.Q.20201104.1338.010.html
[3] 张晓娜,吴煜,李斌,等.贵州省荞麦地上节肢动物种类的调查研究[J].贵州师范大学学报(自然科学版),2020,38(3):45-52
[4] 周飘,张晓娜,陈庆富.水活度和温度对苦荞麦黄曲霉菌株MI18-S1生长和产毒的影响[J/OL].福建农业学 报:1-10[2021-03-15].http://kns.cnki.net/kcms/detail/35.1195.S.20200508.1724.002.html.
[5] 张启迪.不同荞麦品种种子蛋白质组分的比较研究[D].贵州:贵州师范大学,2017
[6] 卞紫秀,汪建飞,王顺民.超声波处理下苦荞麦萌发及富集黄酮工艺优化研究[J].安徽工程大学学报,2018,33(5):7-13
[7] 王宏信,杨素丹,刘红梅.17株植物生长调节剂对金荞麦种子萌发及幼苗生长的影响[J].种子,2017,36(5):19-22
[8] 蔡天革,胡智馨,杜春明,等.不同质量浓度硼肥对荞麦种子萌发及幼苗生长的影响[J].沈阳大学学报(自然科学 版),2021,33(3):213-219
[9] 何俊星,何平,张益锋,等.温度和盐胁迫对金荞麦和荞麦种子萌发的影响[J].西南师范大学学报(自然科学版),2010,35(3):181-185
[10] 周兵,闫小红,杨芳珍,等.果皮对17株甜荞和苦荞品种种子萌发特性的影响[J].井冈山大学学报(自然科学 版),2016,37(6):42-47
[11] 张杰,赵丹晨,张丽红,等.环链棒束孢()杀虫缓释剂的制作[J].江苏农业科学,2020,48(3):119-124
[12] 路杨,徐文静,隋丽,等.球孢白僵菌植物内生性及其应用研究进展[J].东北农业科学,2016,41(1):73-77
[13] Quesada-Moraga E, López-Díaz C, Landa BB. The hidden habit of the entomopathogenic fungus Beauveria bassiana: first demonstration of vertical plant transmission [J]. PLoS ONE, 2017,9(2):e89278
[14] Vega FE. Insect pathology and fungal endophytes [J]. Journal of Invertebrate Pathology, 2008,98(3):277-279
[15] Sasan RK, Bidochka MJ. The insect-pathogenic fungus(Clavicipitaceae) is also an endophyte that stimulates plant root development [J]. American Journal of Botany, 2012,99(1):101-107
[16] 蒙怡,查锦宏,朱蕴兰,等.球孢白僵菌定殖对牛蒡苗生长特性的影响[J].安徽农业科学,2021,49(10):134-137
[17] Dash CK, Bamisile BS, Keppanan R,. Endophytic entomopathogenic fungi enhance the growth ofL. (Fabaceae) and negatively affect the development and reproduction ofKoch (Acari: Tetranychidae) [J]. Microbial Pathogenesis, 2018,125:385-392
[18] 管景强,许忠顺,刘京,等.环链虫草对番茄生长和抗氧化酶活性的影响[J/OL].微生物学 报:1-15[2022-03-05].DOI:10.13343/j.cnki.wsxb.20210408.
[19] Qayyum MA, Wakil W, Arif MJ,. Infection of Helicoverpa armigera by endophytic Beauveria bassiana colonizing tomato plants [J]. Biological Control, 2015,90:200-207
Screening of High Germination Rate Strains of Entomopathogenic Fungi against Buckwheat Seeds
PENG Xue1, WU Yu1, ZHANG Xiao-na1*, CHEN Wan-hao2, ZHU Li-wei1, CHEN Qing-fu1*, DENG Jiao1
1.550001,2.550025,
To provide a theoretical foundation for studying the mechanism by which entomopathogenic fungi promote buckwheat seed germination by screening the best entomopathogenic fungi strains. The submerged conidia and aerial conidia suspensions of 16 strains of 4 entomogenic fungi were used in the present study to infiltrate 6 varieties of 2 strains of buckwheat seeds at a concentration of 1×106conidia/mL, and the best entomogenic fungi strains with the best germination effect on buckwheat seeds were obtained. It was found that 16 entomopathogenic fungi strains could improve the germination rate, bud length, and bud diameter of buckwheat seeds, withseeds having a more significant effect on growth thanseeds. In general, aerial conidia exhibited a greater growth-promoting effect on germination rate and bud diameter than submerged conidia. However, most of the submerged conidia exhibited a greater growth-promoting effect on the buckwheat bud.
Buckwheat; seed germination; entomopathogenic fungi
S517
A
1000-2324(2022)03-0393-08
10.3969/j.issn.1000-2324.2022.03.009
2022-04-15
2022-07-01
教育部重点实验室开放课题基金(黔教合KY字[2020]246);贵州师范大学资助博士科研项目(11904/0517052)
彭雪(1998-),女,在读研究生,研究方向:害虫生物防治研究及病原微生物利用. E-mail:2286839081@qq.com
Author for correspondence. E-mail:1263432172@qq.com; cqf1966@163.com.

