丁字湾盐沼湿地不同植被生境大型底栖动物群落结构研究
纪莹璐,蒲思潮,陶卉卉,张绍萍,张亮,王智
丁字湾盐沼湿地不同植被生境大型底栖动物群落结构研究
纪莹璐1,2,蒲思潮1,2,陶卉卉1,2,张绍萍1,2,张亮1,2,王智3*
1. 山东省海洋生态环境与防灾减灾重点实验室, 山东 青岛 266061 2. 国家海洋局北海预报中心, 山东 青岛 266061 3. 厦门大学近海海洋环境科学国家重点实验室, 福建 厦门 361102
为了解丁字湾盐沼湿地不同生境大型底栖动物群落多样性,于2020年10月对盐沼植物芦苇、碱蓬、大米草及互花米草4种生境开展大型底栖动物调查。共鉴定出大型底栖动物47种,隶属于5门7纲35科,以多毛纲(17种)和软甲纲(13种)种类较多。大型底栖动物平均丰度芦苇生境最高,大米草生境最低,平均生物量则反之。Shannon-Wiener物种多样性指数显示大米草生境大型底栖动物的多样性高于其他生境。4种盐沼植物生境间大型底栖动物群落相似性程度较低,互花米草生境的大型底栖动物群落率先聚类到一起,且与芦苇生境差异较大,芦苇生境以浮游生物食性功能群占优势,互花米草生境多为碎屑食性。Pearson相关性分析和典范对应分析结果表明大型底栖动物群落受植被、沉积物有机碳含量和沉积物粒度的共同影响。
湿地;植被; 动物群落
盐沼湿地是由耐盐灌木和草本植物,一般为草本植物主导的潮间带区域,具有丰富的生物资源和重要的生态服务价值[1],光滩、潮沟和植被覆盖区是盐沼湿地三种典型的亚生境类型[2,3]。底栖动物是盐沼湿地重要的消费者类群,既以浮游生物、底栖藻类和有机碎屑为食,又被鱼类和鸟类所捕食,是湿地生态系统能量流动和物质循环的关键环节[4-6]。盐沼湿地亚生境可以为底栖动物提供多样化的栖息环境,从而影响其群落组成,三种亚生境中盐沼植被覆盖区具有范围广、根丛结构复杂和增加滩涂生境异质性的特点[7],其与底栖动物群落间的相互关系一直是盐沼湿地研究的热点[8-10]。
本研究选取丁字湾为研究对象,丁字湾位于山东半岛南部沿海,北起丁字咀(36°34′56″N,121°00′48″E),南至栲栳岛(36°32′23″N,120°57′30″E),湾口与黄海相接,海湾狭长形如丁字,仅有一条潮汐汊道贯穿其中,湾内有五龙河、白沙河、莲阴河等河流汇入。海湾属于暖温带季风型大陆性气候,潮汐类型为正规半日潮,潮流的运动形式以北西-南东向往复流为主[11],入湾的细粒泥沙在径流、潮流作用下在潮汐汊道两侧及湾顶形成宽阔平缓的潮滩[12]。两岸滩涂有典型的盐沼湿地发育,且沿高程梯度具有明显的植被成带分布,区域原生盐沼植被有碱蓬群落和芦苇群落,2010年起由于外来物种互花米草的侵入,也形成了典型的互花米草群落。目前丁字湾的研究集中于湾内水质环境监测、水动力和沉积动力领域[12-14],潮间带生物调查要追溯至上世纪90年代[15],且暂无盐沼湿地植被和底栖生物的调查资料。本研究于2020年10月在丁字湾盐沼湿地植被覆盖区开展生态调查,分析不同植被生境大型底栖动物群落组成和多样性差异,以及大型底栖动物与多种生境因子之间的关系,为保护盐沼湿地生物多样性提供基础资料和科学依据。
1 材料与方法
1.1 样品采集
于2020年10月19~23日在丁字湾盐沼湿地设置3条采样断面,每条断面沿高程梯度在不同植被带设置采样站点(图1)。D1断面位于麻姑岛西侧湾顶滩涂,两侧被围堰养殖包围,有一条潮沟垂直于岸滩,植被分布低潮带为互花米草占据,中潮带分布有碱蓬和少量米草类,高潮带则主要为碱蓬,偶见大米草,断面设置碱蓬带(D1SsH)、碱蓬带(D1SsM)和互花米草带(D1Sal)3个采样站点;D2、D3断面分别位于白沙河感潮河段和丰城河感潮河段,沿潮带植被分布低潮带为互花米草,中潮带以碱蓬或大米草为主,高潮带以芦苇为主,D2 断面设置了芦苇带(D2Pa)、碱蓬带(D2Ss)和互花米草带(D2Sal)3个采样站点;D3断面设置了芦苇带(D3Pa)、大米草带(D3San)和互花米草(D3Sal)3个采样站点。
每个站点设4个植被取样样方(1 m×1 m)、4个大型底栖动物取样样方(25 cm×25 cm,采样深度为30 cm)和1个表层沉积物样方。现场记录植株盖度、密度、高度,齐地剪取样方内植物带回实验室,于60 ℃烘干称取干重。在植被样方内设置大型底栖动物取样样方,泥样通过0.5 mm孔径的网筛分选,将留在网筛上的样品装瓶用10%的福尔马林溶液现场固定。在表层沉积物样方用土壤环刀采集约100 cm3的沉积物样品用自封袋保存,测定沉积物全盐含量、有机碳、粒度。实验室中样品的鉴定、计数、称量和分析等均按照《海洋监测规范》[16]进行。

图 1 采样站位示意图
1.2 数据处理
相对重要性指数()计算公式:=(+)×,式中,为某一物种生物量占大型底栖动物总生物量的百分比,为该物种丰度占大型底栖动物总丰度的百分比,为该物种出现的频率[17],将值>1000的种定为优势种[18]。多样性分析采用Margalef物种丰富度指数()、Shannon-Wiener物种多样性指数()以及Pielou物种均匀度指数(),公式如下:=(-1)/log2,=–ΣPlog2(P),=/log2。式中,为样品的总种数,为样品的总个体数,P为样品中第种的个体数与总个体数的比值[19]。
大型底栖动物丰度数据经四次方根转换后,使用PRIMER 6.0软件包对大型底栖动物群落结构进行分析,比较群组间的相似性并筛选各群落特征种[20]。大型底栖动物参照食性分为5个功能群:肉食性、植食性、浮游生物食性、碎屑食性和杂食性功能群[21]。运用SPSS 25.0对大型底栖动物的丰度、生物量进行差异显著性分析,并对大型底栖动物和环境因子进行相关性分析。采用CANOCO 5中典范对应分析(Canonical correspondence analysis,CCA)解析大型底栖动物与环境因子的关系,分析前将环境数据转换成log(+1)形式[22]。大型底栖动物变量进行去趋势对应分析(Detrended correspondence analysis,DCA),以确定群落属于单峰型分布或线型分布[23],结果表明所有轴中梯度最大值大于5.0,选用典范对应分析方法。
2 结果与分析
2.1 不同站点生境特征
丁字湾盐沼植被总体呈斑块化分布,植被带宽度约165 m。不同站点的植被特征和沉积物理化指标如表1所示。调查站点以大米草和互花米草的盖度最高(均为95.0%),碱蓬的盖度最低(41.7%-76.7%);互花米草的植株高度最高,平均为177.6 cm,芦苇次之,平均为118.5 cm,碱蓬最低(27.3 cm);植株密度上大米草最高(615.0株/m2),碱蓬最低,D1SgM站位碱蓬密度仅为26.0株/m2;不同植被地上生物量(干重)的大小顺序为互花米草(1922.8 g)>芦苇(1498.4 g)>大米草(512.1 g)>碱蓬(184.2 g),变化趋势与植株高度一致。沉积物理化结果显示芦苇和碱蓬植被带的站点全盐含量较其他站点偏高,大米草植被带的D3San站点有机碳含量最高,底质类型除D3Pa站点为砂质粉砂外,其余调查站点均为粉砂,感潮河道站点的沉积物中值粒径高于湾顶滩涂。
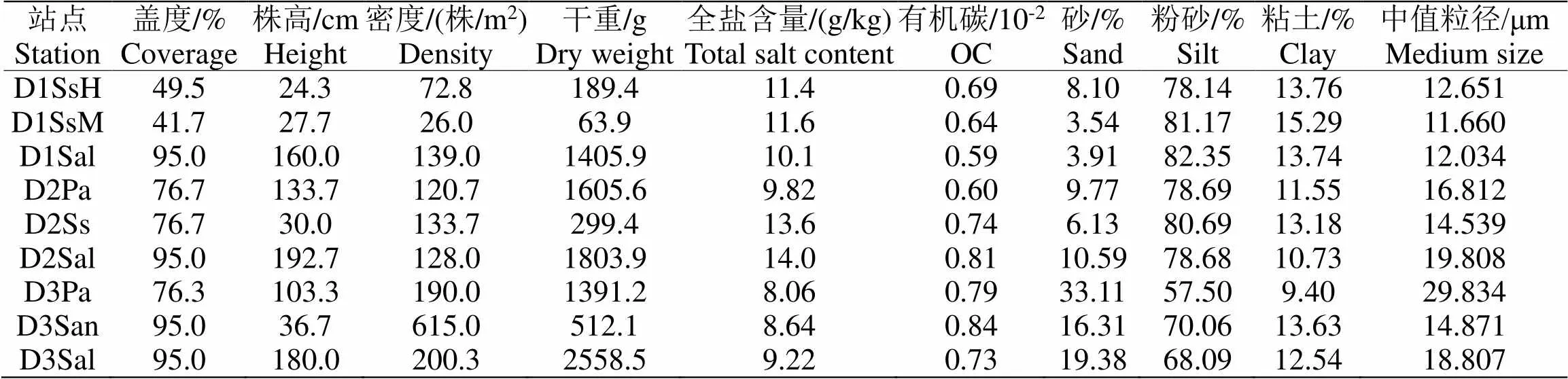
表 1 不同站点植株参数和环境因子
2.2 大型底栖动物种类组成
本调查共采集到大型底栖动物47种,其中环节动物17种,占总种数的36.2%;软体动物和甲壳动物各14种,分别占总物种数的29.8%;纽形动物和脊椎动物各1种,分别占总物种数的2.1%。在不同植被生境下,大型底栖动物种类组成有所差异,碱蓬带和大米草带各出现15、11种大型底栖动物,均以节肢动物占优势;芦苇带环节动物、软体动物和节肢动物占比相近,但总种数较少(共7种);互花米草带出现29种大型底栖动物,环节动物占比51.7%。多重分析结果显示,互花米草带大型底栖动物的种数显著高于芦苇区域(<0.05),其他植被生境种数差异不明显。不同植被带优势种组成如表2所示,可以看出丁字湾盐沼湿地四种植被生境大型底栖动物优势种有明显差异,仅双齿围沙蚕和河独蜾蠃蜚在2种植被生境中均占优势,其他物种只在特定的生境中为优势种。节肢动物在碱蓬生境占优势,而互花米草生境的优势种均为环节动物多毛类。
丁字湾盐沼湿地大型底栖动物主要可分为浮游生物食性、植食性、肉食性、碎屑食性和杂食性5种功能群(图2)。浮游生物食性有绯拟沼螺、缢蛏和河独蜾蠃蜚等,植食性有沈氏厚蟹、天津厚蟹和中华蟹守螺等,肉食性有日本鼓虾()、渤海格鳞虫()和锥唇吻沙蚕()等,碎屑食性有丝异须虫、多丝独毛虫()和膜质伪才女虫()等,杂食性有双齿围沙蚕、不倒翁虫()和宽身闭口蟹等。由图2可知,芦苇生境大型底栖动物呈现浮游生物食性和杂食性功能群占比较高的特点,且未出现碎屑食性的物种;碱蓬生境为浮游生物食性和植食性物种占优势;大米草生境下5种大型底栖动物功能群占比相对均衡;互花米草生境中碎屑食性和杂食性成为主要的功能群类型,其中碎屑食性的种数占比明显高于其余三种生境。
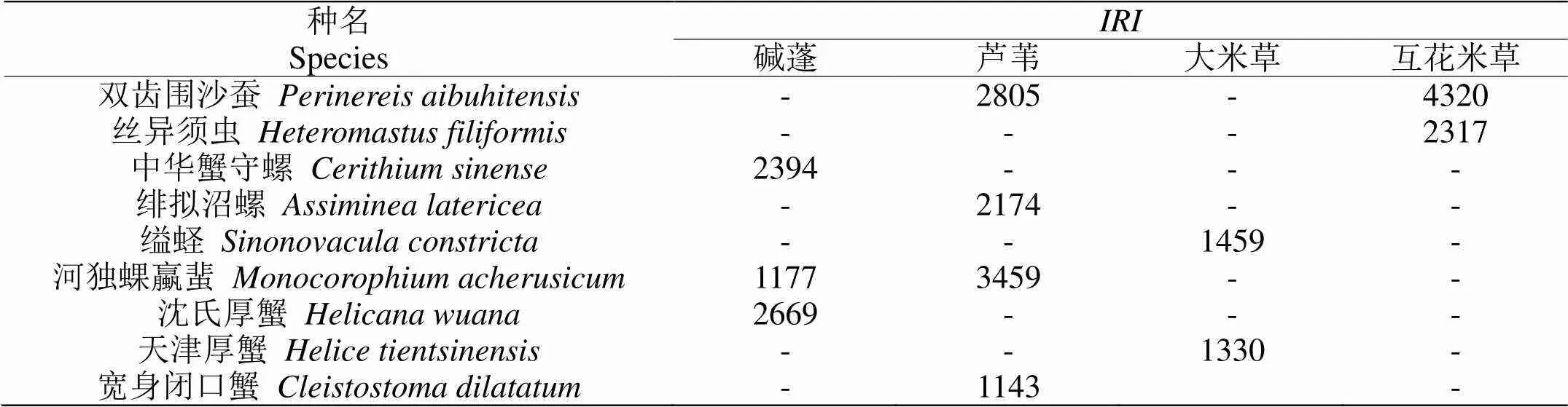
表 2 各植被生境大型底栖动物优势种(IRI>1000)
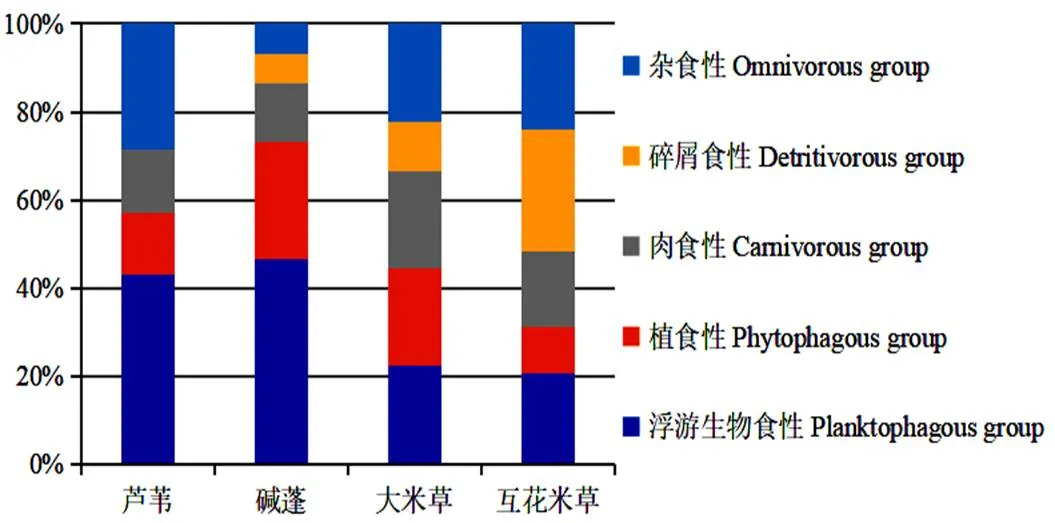
图 2 丁字湾盐沼湿地大型底栖动物功能群种类百分比组成
2.3 大型底栖动物的群落结构
大型底栖动物的丰度和生物量如图3所示。碱蓬生境大型底栖动物平均丰度为45 ind/m2,平均生物量为32.12 g/m2,节肢动物丰度居于首位,软体动物位居第2,生物量则以软体动物为最高。芦苇生境大型底栖动物平均丰度为858 ind/m2,平均生物量为29.35 g/m2,节肢动物丰度占优势,软体动物位居第2,生物量环节动物多毛类为最高。大米草生境大型底栖动物平均丰度为44 ind/m2,平均生物量为79.24 g/m2,软体动物和节肢动物丰度居于首位,生物量则以软体动物为最高,节肢动物次之。互花米草生境大型底栖动物平均丰度为173 ind/m2,平均生物量为36.28 g/m2,环节动物多毛类在丰度和生物量上均为最优势类群。
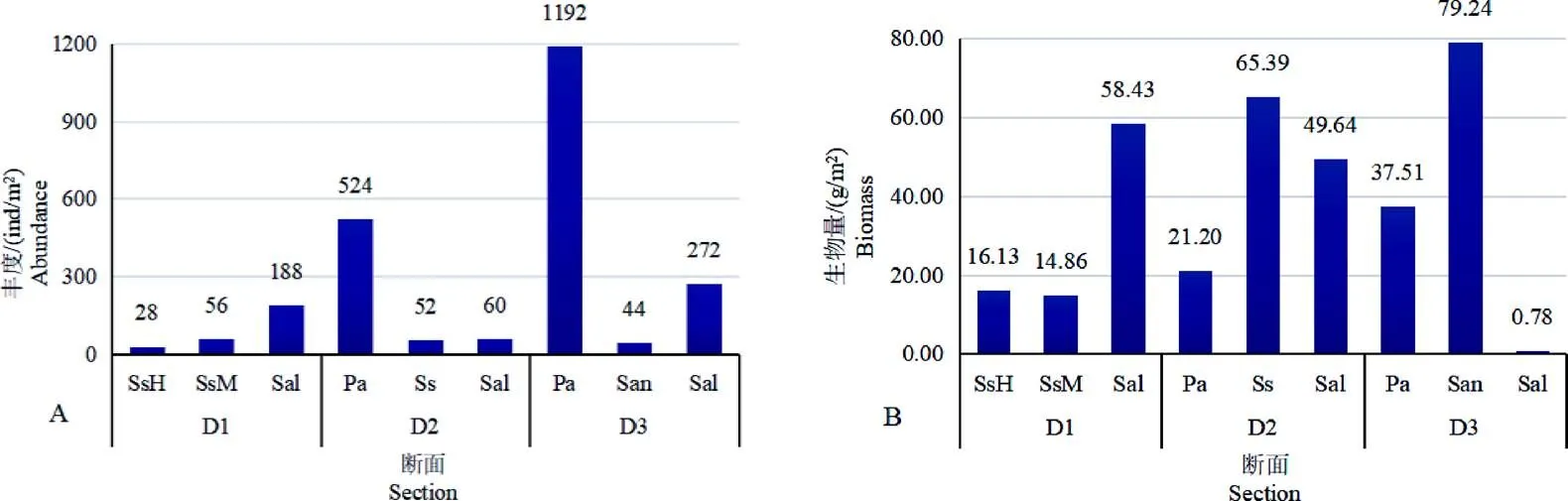
图 3 大型底栖动物的丰度(A)和生物量(B)
Ss碱蓬,Pa芦苇,San大米草,Sal互花米草
Ss:Pa:, San:, Sal:
由表3可知,丁字湾盐沼湿地不同植被生境中大型底栖动物Margalef物种丰富度指数()和Shannon-Wiener物种多样性指数()呈现大米草带>互花米草带>碱蓬带>芦苇带的特点,Pielous物种均匀度指数()则为大米草带>碱蓬带>互花米草带>芦苇带,其中仅大米草生境大型底栖动物多样性指数()>3,芦苇生境多样性指数()最低,仅为0.244。
注:Ss碱蓬,Pa芦苇,San大米草,Sal互花米草。
Note: Ss:Pa:, San:, Sal:
单因素方差分析显示,不同植被生境大型底栖动物的丰度和丰富度存在显著差异(<0.05),多样性指数和均匀度指数存在极显著差异(<0.01)。多重分析结果表明,芦苇带大型底栖动物的丰度显著高于碱蓬带(<0.01)和互花米草带(<0.05),但其多样性指数和均匀度指数均显著低于碱蓬带(<0.01)和互花米草带(<0.01),其大型底栖动物丰富度指数显著低于互花米草带(<0.01),其他生境的丰度、生物量和多样性指数差异不显著(>0.05)。
不同站点大型底栖动物群落组成的聚类和非度量多维尺度分析的结果如图4所示,聚类分析在15%相似度水平上将9个站点分成了4组,ANOSIM结果显示群组间具显著差异(<0.01)。D2Pa(群落Ⅳ)和D3San(群落Ⅱ)站点各单独成为一组,D1断面和互花米草带的5个站点组成一组(群落Ⅰ),D3Pa和D2Ss两个站点组成一组(群落Ⅲ),其中互花米草带的3个站位率先聚类到一起,整体上调查区域的大型底栖动物群落相似性较低。nMDS分析图的Stress值为0.08,说明能够正确解释样本间的相似关系,9个站点大致分成4组,这与聚类分析的结果较为一致。群落Ⅰ的特征种为丝异须虫和沈氏厚蟹,群落Ⅱ特征种为天津厚蟹和光滑河篮蛤(),群落Ⅲ特征种为薄壳绿螂()和河独蜾蠃蜚,群落Ⅳ特征种为绯拟沼螺。

图 4 大型底栖动物群落的聚类分析(A)及非度量多维尺度分析(B)
2.4 丰度/生物量比较曲线
丰度/生物量比较曲线(ABC)中,如果大型底栖动物群落结构基本平衡,则生物量曲线位于丰度曲线上方;当群落受到中度污染时,生物量曲线与丰度曲线出现交叉或重叠;受到严重污染时,丰度曲线位于生物量曲线之上[24]。根据图5,D2Sal和D3San站点的生物量曲线和丰度曲线在起点处相聚较近,说明存在轻度干扰的可能;D2Pa和D3Sal站点两条曲线相互交叉,且D2Pa站点丰度曲线部分超过生物量曲线,说明大型底栖动物群落受到中度干扰;而D3Pa站点的丰度曲线整条位于生物量曲线之上,说明该站点的大型底栖动物群落已受到了严重的干扰。

图 5 丁字湾盐沼湿地大型底栖动物ABC曲线
2.5 环境因子相关性分析
对丁字湾盐沼湿地大型底栖动物和栖息环境进行Pearson相关性分析,其中植被类型一项碱蓬赋值为1,芦苇为2,大米草为3,互花米草为4。结果显示大型底栖动物丰度与沉积物砂含量、中值粒径呈极显著正相关(<0.01),与沉积物粉砂和粘土含量呈显著负相关(<0.05);物种数与植被类型成显著正相关(<0.05)。
典范对应分析(CCA)结果见图6,采用向前引入法逐步筛选出显著的环境因子为有机碳、粉砂、植被类型、砂、植被高度、植被盖度等。典范对应分析图中环境因子箭头长短表示其对大型底栖动物影响的显著程度,箭头越长影响越显著。有机碳、粉砂、植被类型、砂的箭头较长,表明这4种环境因子与丁字湾盐沼湿地大型底栖动物优势种相关程度较大。从环境因子与CCA第一排序轴夹角分析,有机碳、砂、植被类型、植被盖度与第一排序轴成负相关,粉砂、植被高度与第一排序轴成正相关。第一排序轴反映了大型底栖动物优势种对环境因子的需求趋势,由左往右大型底栖动物优势种对有机碳、砂、植被类型、植被盖度的适应性逐渐降低,粉砂、植被高度的适应逐渐升高。从环境因子与CCA第二排序轴夹角分析,植被类型、粉砂、植被盖度、植被高度与第二排序轴呈正相关,即第二排序轴由下到上大型底栖动物优势种随着植被类型、粉砂、植被盖度和植被高度的增大适应性逐渐增强。

图 6 大型底栖动物优势种与环境因子之间的典范对应分析
3 讨 论
3.1 盐沼植被对大型底栖动物功能群的影响
盐沼植被是盐沼生态系统的生产者,对盐沼大型底栖动物的组成和分布具有重要影响,已有研究表明植被类型不同,大型底栖动物组成差异明显[25]。本研究结果显示,丁字湾盐沼湿地不同植被生境大型底栖动物功能群组成不同,如在芦苇带和碱蓬带,大型底栖动物以浮游生物食性功能群为主,而在互花米草分布区内则是以碎屑食性功能群为主。2010年起随着互花米草的入侵,丁字湾原生盐沼植被芦苇和碱蓬的分布空间被压缩,低潮带基本为互花米草占据,对大型底栖动物功能群组成与分布造成显著影响。本研究发现,互花米草分布区内虽然杂食性、肉食性和植食性功能群的比例未有明显变化,但优势功能群已由浮游生物食性转为碎屑食性功能群,且原生植被芦苇和碱蓬分布区内碎屑食性功能群未出现或占比极低,说明浮游生物食性功能群在互花米草生境的适宜性大幅减弱。此外,四种植被生境中芦苇生境物种数最少,但大型底栖动物优势种覆盖环节动物、软体动物和节肢动物三个类群,碱蓬和大米草生境优势种也以大个体软体动物和节肢动物为主,而互花米草生境虽然种数多,Shannon-Wiener物种多样性指数较高,但优势类群单一,仅包含环节动物多毛类。一般来说,互花米草密集生长和发达的地下根系会降低区域的透光性和水流速度,使沉积物氧化活性水平上升,因而限制某些体型较大或对溶氧要求较高的底栖动物生存[26]。对不同食性和栖息习性的物种来说,C4植物互花米草虽较原生植被有更高的初级生产力,其产生的有机碎屑可被碎屑食性者多毛类等取食,但双壳类和端足类物种却难以利用,且互花米草微生境的改变在一定程度上抑制了微藻等其他食物的输入,一些具有特定选择性食物源的物种受到抑制[27]。
3.2 生境对物种多样性和群落的影响
大型底栖动物的栖息环境决定其生长发育和群落结构,生境间的差异是造成底栖动物物种多样性差异的主要原因之一,盐沼湿地植被类型、盐度、有机碳、中值粒径、营养元素含量和流速等都会对底栖动物的生长和分布产生影响[28]。本研究发现芦苇生境内大型底栖动物群落的平均丰度显著高于互花米草区域,但物种数、多样性指数、丰富度指数和均匀度指数均显著低于互花米草区域,不同植被生境下平均生物量没有明显差异。绯拟沼螺和河独蜾蠃蜚是芦苇生境大型底栖动物丰度的主要贡献者,这与张衡等[1]对长江口东滩湿地芦苇生境的调查结果相似。芦苇的地上部分对底上浮游食性和植食性动物的丰度有明显的影响,但由于其根系粗大且质地较硬,不利于底内型大型底栖动物取食,大型底栖动物总种数少,仅底上个别物种丰度较高,导致多样性指数数值偏低。腹足纲螺类为芦苇生境常见优势种的原因可能为蟹类和多毛类在深秋至早春季节进入冬眠期或钻入沉积物更深层中,而螺类对周围环境的敏感度较低,在全年多数月份均可保持较高的丰度且明显高于其他类型的大型底栖动物[1]。此外,芦苇生长于白沙河和丰城河河口高潮带,海水淹没时间较短,属于偏淡水环境,不利于对盐度条件敏感的底栖动物生存,导致其种类数和多样性指数低于中、低潮带半咸水区域。总体来说,芦苇生境相比其他生境大型底栖动物物种多样性指数较低而少数优势种的优势度较高(如绯拟沼螺),是生物与河口环境相适应的结果[2,4]。聚类和nMDS分析结果也可以看出,河道附近芦苇、碱蓬和大米草带的大型底栖动物群落与滩涂碱蓬带和互花米草带的底栖动物群落相似性较低且存在显著性差异,引起群落差异的主要贡献种是丝异须虫、天津厚蟹、薄壳绿螂、绯拟沼螺等。考虑到本研究中运用样方法对盐沼湿地大型底栖动物进行定量采集,一些活动能力较强的穴居型蟹类难以取样,现场采样时芦苇样地中可见厚蟹类爬行,因此丁字湾盐沼湿地大型底栖动物中蟹类的数量可能被低估。
Macarthur认为群落包含的物种数量对群落的稳定性起重要作用,物种数丰富的群落,即使种间的相互作用较小,群落也能维持稳定,种数较少的群落,物种间的相互作用仅可对该群落的稳定性起到一定的弥补作用,且作用十分有限[29]。根据Shannon-Wiener物种多样性指数污染评价标准[30],除大米草生境显示清洁外,其余3种植被生境均出现污染情况,其中芦苇生境为重污染,结合ABC曲线结果,感潮河道周边植被生境大型底栖动物群落受到不同程度干扰,以芦苇生境受到的干扰最为严重,D3断面互花米草生境也存在中度干扰。基于上文可知,丁字湾盐沼湿地湾顶滩涂大型底栖动物群落稳定性优于感潮河道,这可能与河口盐度变化大且水流冲刷较强有关,芦苇生境位于淡、咸水交界处且高潮区易受周边村落人类活动影响,因此底栖动物群落稳定性差,而感潮河道D3断面邻近麻姑岛,岛东侧与陆地筑有一座0.5 km长的桥闸相连,受村民生产生活和岛路交通等活动影响,该断面大型底栖动物群落处于不稳定状态。综上所述,滨海湿地生态系统中盐沼植被与环境因子间相互关联、相互影响,共同对大型底栖动物群落组成与物种分布起作用,且不同底栖动物种类对环境的适应性有一定差异,因此,在环境变化复杂的河口和内湾,植被、沉积环境、人类活动与底栖动物之间的综合作用以及作用机理仍需开展进一步的系统研究。
4 结 论
丁字湾盐沼湿地共发现大型底栖动物47种,其中芦苇生境浮游生物食性占比较高,碱蓬生境浮游生物食性和植食性物种占优势,大米草生境各功能群占比相对均衡,而互花米草生境中碎屑食性的种数占比明显高于其余三种生境。芦苇生境大型底栖动物平均丰度最高(858 ind/m2),大米草生境生物量最高,为79.24 g/m2。不同植被生境大型底栖动物群落相似性水平较低,群组间差异显著。Shannon-Wiener物种多样性指数和丰度/生物量比较曲线(ABC)结果表明感潮河道周边植被生境大型底栖动物群落受到不同程度干扰,以芦苇生境受到的干扰最为严重。环境因子相关性分析结果显示丁字湾盐沼湿地大型底栖动物分布受植被、沉积物有机碳含量和粒度的共同影响。
[1] 张衡,叶锦玉,梁晓莉,等.长江口东滩湿地芦苇生境大型底栖无脊椎动物群落结构的月动态[J].应用生态学报,2017,28(4):1360-1369
[2] 陆健健.湿地生态学[M].北京:高等教育出版社,2006
[3] Schwartz ML. Salt Marsh[M]. Netherlands: Springer, 2005
[4] 袁兴中,陆健健.长江口潮滩湿地大型底栖动物群落的生态学特征[J].长江流域资源与环境,2002,11(5):414-420
[5] 胡知渊,鲍毅新,程宏毅,等.中国自然湿地底栖动物生态学研究进展[J].生态学杂志,2009,28(5):959-968
[6] 宋慈玉,储忝江,盛强,等.长江口盐沼分级潮沟系统中大型底栖动物群落结构特征[J].复旦学报(自然科学版),2011,50(3):253-259
[7] 袁兴中,陆健健,刘红.河口盐沼植物对大型底栖动物群落的影响[J].生态学报,2002,22(3):326-333
[8] 陈骞,何伟添,刘阳,等.澳门典型湿地底栖动物群落结构特征[J].南方水产科学,2015,11(4):1-10
[9] 胡成业,水玉跃,田阔,等.瓯江口树排沙湿地不同生境大型底栖动物群落多样性研究[J].海洋与湖沼,2016,47(2):422-428
[10] 张婷婷,高宇,王思凯,等.河口湿地景观格局与大型底栖生物群落的尺度效应研究[J].海洋渔业,2018,40(6):679-690
[11] 汤世凯,于剑锋,李金鹏,等.丁字湾近岸海域表层沉积物粒度特征及沉积动力环境[J].海洋地质与第四纪地质,2019,39(2):70-78
[12] 王燕飞.最近40年来丁字湾潮滩表层沉积特征演变的遥感定量反演[D].烟台:鲁东大学,2013
[13] 王伟,袁帅帅.近二十年来丁字湾海水悬浮物的时空分布及变化特征[J].地下水,2020,42(6):116-118
[14] 娄安刚,郑嫣茹,李晓静,等.丁字湾规划对其水动力与纳潮量影响研究[J].海洋湖沼通报,2012(4):171-176
[15] 王诗红,张志南,吕瑞华,等.丁字湾潮间带日本刺沙蚕幼体对底栖微藻的摄食率[J].青岛海洋大学学报(自然科学版), 2002(3):409-414
[16] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 17378.7-2007海洋监测规范:第7部 分:近海污染生态调查和生物监测[S].北京:中国标准出版社,2007
[17] Pinkas L, Oliphant MS, Iverson ILK. Food habits of albacore, bluefin tuna,and bonito in California waters [J]. Fish Bulletin, 1971,152:1-105
[18] 程济生.黄海无脊椎动物资源结构及多样性[J].中国水产科学,2005,12(1):68-75
[19] 沈国英,黄凌风,郭丰,等.海洋生态学[M].北京:科学出版社,2010
[20] Clarke KR, Warwick RM. Change in marine communities: An approach to statistic analysis and interpretation 2nd edition [M]. UK: PRIMER-E Ltd: Plymouth Marine Laboratory, 2001
[21] Grémare A. Feeding, tube-building and particle-size selection in the terebellid polychaete Eupolymnia nebulosa [J]. Marine Biology, 1988,97(2):243-252
[22] Leira M, Sabater S. Diatom assemblages distribution in Catalan rivers, NE Spain, in relation to chemical and physiographical factors [J]. Water Research, 2005,39(1):73-82
[23] Lepš J, Šmilauer P. Multivariate analysis of ecological data using CANOCO [M]. 1st edition. Cambridge: Cambridge University Press, 2003:1-283
[24] Warwick RM, Pearson TH, Ruswahyuni. Detection of pollution effects on marine macrobenthos: further evaluation of the species abundance /biomass method [J]. Marine Biology, 1987,95(2):193-200
[25] 杨泽华,童春富,陆健健.盐沼植物对大型底栖动物群落的影响[J].生态学报,2007,27(11):4387-4393
[26] Grosholz ED, Levin LA, Tyler AC,. Changes in community structure and ecosystem function followinginvasion of Pacific estuaries//Grosholz, Bertness MD, eds. Human Impacts on Salt Marshes: A Global Perspective [M]. Berkley: University of California Press, 2009:23-40
[27] 冯建祥,黄茜,陈卉,等.互花米草入侵对盐沼和红树林滨海湿地底栖动物群落的影响[J].生态学杂志,2018,37(3):943-951
[28] Silvestri S, Defina A, Marani M. Tidal regime, salinity and salt marsh plant zonation [J]. Estuarine, Coastal and Shelf Science, 2005,62:119-130
[29] Macarthur H. Fluctuations of animal populations and a measure of community stability [J]. Ecology, 1955,36:533-536
[30] 蔡立哲,马丽,高阳,等.海洋底栖动物多样性指数污染程度评价标准的分析[J].厦门大学学报(自然科学版),2002,41(5):641-646
Study on the Structure of Microbenthic Communities in Coastal Wetlands with Different Vegetation Types in Dingzi Bay
JI Ying-lu1,2, PU Si-chao1,2, TAO Hui-hui1,2, ZHANG Shao-ping1,2, ZHANG Liang1,2, WANG Zhi3*
1.266061,2.266061,3.361102,
We investigated the community structure of macrobenthos in different habitats of salt wetland in Dingzi Bay in four salt marsh vegetation forms, i.e.,habitat,habitat,habitat, andhabitat during October 2020. In total, 47 species were recorded, belonging to 35 families, 7 classes, and 5 phyla. The average abundance was the highest inhabitat, the lowest inhabitat, while the average biomass was the opposite.Shannon-wiener species diversity index showed that the diversity of macrobenthos inhabitat was higher than those in other habitats.The similarity of the macrobenthic communities among the four salt marsh plants was low, and the macrobenthic communities inhabitat were the first to cluster together, and were significantly different from those inhabitat.habitat was dominated by plankton feeding group, whilehabitat was mostly detrital feeding group.The results of Pearson correlation analysis and canonical correspondence analysis showed that the macrobenthic community was affected by vegetation, sediment organic carbon content and grain size.
Wetland; vegetation; animal community
Q958.8
A
1000-2324(2022)03-0412-09
10.3969/j.issn.1000-2324.2022.03.012
2022-01-20
2022-02-17
山东省海洋重点实验室开放基金项目(202002);国家重点研发计划资助(2016YFC1402103)
纪莹璐(1990-),女,硕士研究生,工程师,主要研究方向底栖生态动力学和海洋及海岸带生态修复. E-mail:jiiyinglu2008@126.com
Author for correspondence. E-mail:zhiwang00kxy@xmu.edu.cn

