瘦素对哮喘大鼠肺组织氧化应激及细胞凋亡的影响①
苗菲菲 刘兆玮 田 鹏 张 红 张长庚 (衡水市人民医院,衡水 053000)
支气管哮喘简称哮喘,是一种以气道炎症、气道高反应性和气道重塑为特点的气道慢性炎症性呼吸系统疾病,具有较高的患病率和致死率[1-2]。近年来,随着气候改变、雾霾、空气污染等环境因素的改变,哮喘发的生率和病死率呈上升趋势,并越来越受到社会的关注[3-4]。近来研究发现,机体氧化/抗氧化系统失衡,氧化应激产物增加,可引起肺动脉平滑肌细胞凋亡和组织损伤,并造成气道炎症加重及气道重塑改变,从而参与哮喘发生过程[5-6],故氧化应激反应在哮喘中的作用也受到研究者的日益重视。瘦素可表达于支气管上皮细胞、气道平滑肌细胞、肺泡上皮细胞等组织细胞,是一种脂肪性细胞因子样蛋白多肽,可调节炎症反应和免疫应答反应[7-8]。越来越多的研究发现,哮喘患者体内瘦素及其受体表达与哮喘病情进展关系密切[9-10],然而针对外源性地给予瘦素对哮喘症状影响的相关报道较少。本研究建立哮喘大鼠模型,外源性给予瘦素及瘦素拮抗剂,探究其对哮喘大鼠支气管肺组织氧化应激及细胞凋亡的影响,以期为阐明瘦素与哮喘病程的关系提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性SD 大鼠,体质量200~220 g,6~7周育龄,购于首都医科大学实验动物科学部[SCXK(京)2015-0006],所有大鼠饲养于衡水市人民医院动物房,饲养条件:自然光照,自由饮食、饮水,温度25 ℃,相对湿度50%,噪音低于80 分贝,保持动物房环境及鼠笼清洁、透气。本实验经衡水市人民医院伦理委员会批准,实验动物符合3R原则。
1.1.2 主要试剂与仪器 瘦素(货号:CYT-683,以色列ProSpec-Tany 公司);IL-6 ELISA 试剂盒(批号LS-F37731,上海康朗生物科技有限公司);TNF-α ELISA 试剂盒(批号:DM-M57136,上海笃玛生物科技有限公司);HE 染色试剂盒(货号:LMO105,上海联迈生物工程有限公司);TUNEL 染色试剂盒(货号:WLA029a,沈阳万类生物科技有限公司);超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(货号:S311,上海研卉生物科技有限公司);丙二醛(MDA)试剂盒(货号:YX-C-A401,武汉益普生物科技有限公司);Kelch样环氧氯丙烷样相关蛋白1(Kelch-like epichlorohydrin-like associated protein 1,Keap1)抗体、核转录因子E2相关因子(nuclear transcription factor E2 related factor,Nrf2)抗体、血红素氧合酶(heme oxygenase,HMOX-1)抗体、B 细胞淋巴瘤-2 基因(Bcl-2)抗体(货号分别为:ab119403、ab62352、ab223349、ab196495,美国Abcam 公司);BCA 蛋白定量试剂盒、胰蛋白酶(货号分别为P0768、P0231,美国Pierce 公司);反转录试剂盒(货号:T1597,日本TaKaRa);手动轮转式切片机(型号:RM2125RTS,德国Leica 公司);光学显微镜(型号:SMZ745,日本尼康公司);蛋白电泳仪、半干转膜仪(型号:1659001、Trans-Blot SD,美国Bio-Rad 公司);凝胶成像仪(型号:GIS-500,杭州Miulab公司)。
1.2 方法
1.2.1 大鼠哮喘模型建立及分组给药 参照文献[11]采用卵清蛋白(ovalbumin,OVA)致敏并用雾化吸入法诱发大鼠支气管哮喘模型,具体操作方法为:将大鼠置于气雾装置内,用4%OVA 生理盐水进行恒压喷雾引喘,观察大鼠的哮喘潜伏期(即从喷雾开始到哮喘发作的时间),一般不超过150 s,超过150 s 者认为不敏感,不予选用,将预选合格的40 只大鼠随机分为模型组、瘦素组(10µg/kg)、瘦素拮抗剂组(3 µg/kg)及阳性对照组(布地奈德,1 mg/只),10 只/组。各组大鼠于两侧大腿外侧肌内注射4%OVA 生理盐水0.2 ml,腹腔注射0.5 ml 4%OVA+4%氢氧化铝凝胶0.5 ml 致敏,1 次/周,共进行4 次致敏,若大鼠出现呼吸喘促、喘息、哮鸣音、甚则搔鼻、打喷嚏及鼻处有白色黏性分泌物表明造模成功,另取10只正常大鼠,于相同时间、相同方法给予等量生理盐水作为正常对照组。各组大鼠均于造模成功后开始给药,瘦素组及瘦素拮抗剂组参照文献[11-12]设置剂量并通过腹腔注射给予相应剂量的瘦素及瘦素拮抗剂溶液,阳性对照组参照文献[13]设置剂量,并通过喷雾给予布地奈德0.5 ml,正常对照组和模型组腹腔注射生理盐水0.2 ml,各组大鼠均于给药后1 h 按预选条件喷雾4%OVA 生理盐水激发哮喘,各组大鼠均给药致敏4周,1次/2 d。
1.2.2 各组大鼠一般行为观察及肺功能检测 各组大鼠均于末次引喘后24 h 观察大鼠的神态、活动情况、呼吸状况、皮毛状态、口鼻等部位分泌物、咳嗽(或气喘)等肺系疾病的特异性症状体征的变化。完成一般行为观察后,用现配的4%戊巴比妥钠溶液(1 ml/kg)进行腹腔注射麻醉,置于固定板,进行气管插管,用动物肺功能测定仪测定大鼠的吸气阻力(Ri)、呼气阻力(Re)、肺通气顺应性(Cldyn)。
1.2.3 标本采集 各组大鼠在肺功能检测后,立即经气管注入4 ℃含酚红(D-Hanks)的缓冲液5 ml,轻轻按摩胸部20~30 s 后,回收支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),共3 次(回收率>90%),将回收后的BALF 于4 ℃、2 500 r/min 下离心10 min,取上清液保存于-20 ℃冰箱。处死大鼠,取完整左右两肺。剪取部分左肺用组织匀浆器匀浆、离心分离取上清液于-20 ℃冰箱中保存,剩余左肺及右肺组织迅速置于4%多聚甲醛中固定24 h。
1.2.4 大鼠BALF 中炎症因子IL-6、TNF-α 含量及肺组织氧化应激指标SOD、MDA 含量检测 取
1.2.3中-20 ℃冰箱保存的BALF上清液及肺组织匀浆液,于4 ℃冰箱解冻后,取BALF上清液,按试剂盒说明书检测IL-6、TNF-α 含量。取肺组织匀浆液,按试剂盒说明书方法检测肺组织中SOD、MDA含量。
1.2.5 大鼠肺组织HE 及TUNEL 染色观察 取1.2.3 中4%多聚甲醛中固定24 h 的左右两肺组织,进行常规透明、浸蜡、包埋后,切成5µm 厚的切片,取左肺组织切片,根据HE 染色试剂盒说明书进行染色、脱水、透明后封片,置于光学显微镜下观察组织病理变化。取右肺组织切片,进行脱蜡、脱水、封闭后,添加TUNEL 工作液室温下孵育1 h,随后加入抗荧光猝灭剂封片,在共聚焦显微镜下观察切片中细胞凋亡情况,采用Image-pro plus 软件系统定量检测细胞凋亡率,细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.2.6 Western blot 法检测肺组织中Keap1、Nrf2、HMOX-1、Bcl-2 蛋白相对表达水平 取1.2.5 中剩余肺组织,以组织匀浆器匀浆、离心后取上清液,试剂盒提取蛋白,BCA 蛋白定量试剂盒检测蛋白总浓度后,取50 µg 蛋白上样,进行电泳和转膜反应,TBST溶液清洗后,加入5%脱脂牛奶室温下封闭1 h,TBST 清洗3 次,加入一抗[Keap1、Nrf2、HMOX-1、Bcl-2、β-actin(内参)],稀释倍数分别为1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶2 000),4 ℃摇床室温孵育过夜,TBST 清洗后加入HRP 羊抗兔二抗(稀释倍数1∶2 000),37 ℃摇床室温孵育1 h,TBST 清洗3 次后,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image J软件分析各组蛋白相对表达。
1.3 统计学分析 以SPSS22.0软件对实验数据进行统计分析,计量资料以±s表示,多组间比较采用单因素方差分析,进一步两组间比较行SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠一般行为检测结果 正常对照组大鼠呼吸节律整齐、均匀,口唇颜色红润,口、鼻等部位无异常分泌物出现。模型组大鼠出现呼吸急促、喘息、哮鸣音、搔鼻、打喷嚏现象,且大多数大鼠口、鼻处有白色黏性分泌物。瘦素组大鼠出现呼吸减慢和节律不齐、四肢瘫软、腹肌痉挛、行动迟滞或俯伏不动现象。瘦素拮抗剂组及阳性药物组大鼠呼吸渐复平稳、节律渐复均匀,极个别大鼠口、鼻处有白色黏性分泌物出现,偶尔有搔鼻、打喷嚏现象。
2.2 各组大鼠肺功能检测结果 与正常对照组相比,模型组大鼠Ri、Re升高(P<0.05),Cldyn降低(P<0.05);与模型组相比,瘦素组大鼠Ri、Re 升高(P<0.05),Cldyn 降低(P<0.05);与瘦素组相比,瘦素拮抗剂组及阳性药物组大鼠Ri、Re 降低(P<0.05),Cldyn升高(P<0.05);瘦素拮抗剂组与阳性药物组相比,上述指标差异无统计学意义(P>0.05),见表1。
表1 各组大鼠肺功能比较(±s,n=10)Tab.1 Comparison of lung function of rats in each group(±s,n=10)

表1 各组大鼠肺功能比较(±s,n=10)Tab.1 Comparison of lung function of rats in each group(±s,n=10)
Note:1)P<0.05 vs normal control group;2)P<0.05 vs model group;3)P<0.05 vs leptin group.
Cldyn/(ml·cm-1)0.23±0.04 0.12±0.031)0.04±0.021)2)0.17±0.031)2)3)0.18±0.041)2)3)Groups Normal control Model Leptin Leptin antagonist Positive drug Ri/(cm·s·ml-1)1.81±0.21 3.06±0.241)3.95±0.251)2)2.58±0.221)2)3)2.53±0.231)2)3)Re/(cm·s·ml-1)1.80±0.19 3.09±0.251)3.97±0.261)2)2.18±0.231)2)3)2.20±0.241)2)3)
2.3 各组大鼠BALF 中炎症因子IL-6、TNF-α 及肺组织SOD、MDA 含量检测结果 与正常对照组相比,模型组大鼠BALF 中炎症因子IL-6、TNF-α,肺组织中MDA 含量增多(P<0.05),肺组织中SOD 含量减少(P<0.05);与模型组相比,瘦素组大鼠BALF 中炎症因子IL-6、TNF-α,肺组织中MDA 含量增多(P<0.05),肺组织中SOD 含量减少(P<0.05);与瘦素组相比,瘦素拮抗剂组及阳性药物组大鼠BALF 中炎症因子IL-6、TNF-α,肺组织中MDA 含量减少(P<0.05),肺组织中SOD 含量增多(P<0.05);瘦素拮抗剂组与阳性药物组相比,上述指标差异无统计学意义(P>0.05),见表2。
表2 各组大鼠BALF中IL-6、TNF-α含量比较(±s,n=10)Tab.2 Comparison of IL-6 and TNF-α contents in BALF of rats in each group(±s,n=10)
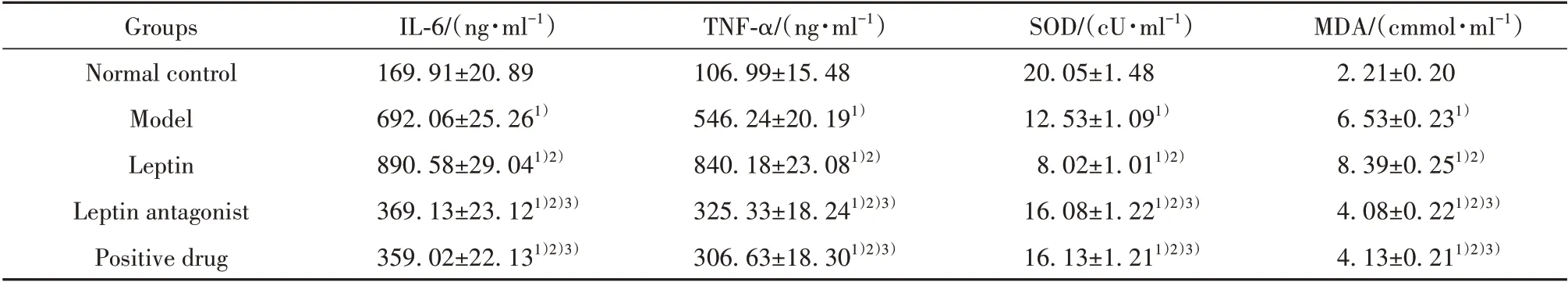
表2 各组大鼠BALF中IL-6、TNF-α含量比较(±s,n=10)Tab.2 Comparison of IL-6 and TNF-α contents in BALF of rats in each group(±s,n=10)
Note:1)P<0.05 vs normal control group;2)P<0.05 vs model group;3)P<0.05 vs leptin group.
MDA/(cmmol·ml-1)2.21±0.20 6.53±0.231)8.39±0.251)2)4.08±0.221)2)3)4.13±0.211)2)3)Groups Normal control Model Leptin Leptin antagonist Positive drug IL-6/(ng·ml-1)169.91±20.89 692.06±25.261)890.58±29.041)2)369.13±23.121)2)3)359.02±22.131)2)3)TNF-α/(ng·ml-1)106.99±15.48 546.24±20.191)840.18±23.081)2)325.33±18.241)2)3)306.63±18.301)2)3)SOD/(cU·ml-1)20.05±1.48 12.53±1.091)8.02±1.011)2)16.08±1.221)2)3)16.13±1.211)2)3)
2.4 各组大鼠肺组织HE 染色检测结果 正常对照组大鼠肺组织结构完整;模型组大鼠肺组织出现支气管壁炎症细胞浸润、杯状细胞增生及黏液分泌、气道平滑肌增厚、管腔变窄等病理损伤;瘦素组大鼠支气管壁炎症细胞浸润、杯状细胞增生及黏液分泌、气道平滑肌增厚、管腔变窄等病理损伤程度明显增高;与瘦素组相比,瘦素拮抗剂及阳性药物组大鼠上述病理损伤减轻,见图1。

图1 各组大鼠肺组织HE染色(×200)Fig.1 HE staining of lung tissue of rats in each group(×200)
2.5 各组大鼠肺组织TUNEL 染色及细胞凋亡检测结果 正常对照组大鼠肺组织染色均匀;与正常对照组相比,模型组大鼠肺组织支气管上皮细胞棕黄色颗粒物质沉积增多,凋亡细胞比例升高(P<0.05);与模型组相比,瘦素组大鼠肺组织支气管上皮细胞棕黄色颗粒物质及凋亡细胞比例升高(P<0.05);与瘦素组相比,瘦素拮抗剂及阳性药物组大鼠肺组织支气管上皮细胞棕黄色颗粒物质及凋亡细胞比例降低(P<0.05),瘦素拮抗剂组与阳性药物组相比,上述指标差异无统计学意义(P>0.05),见图2、表3。

图2 各组大鼠肺组织TUNEL染色(×400)Fig.2 TUNEL staining of lung tissue of rats in each group(×400)
表3 各组凋亡细胞比例比较(±s,n=10)Tab.3 Comparison of apoptotic cells in each group(±s,n=10)

表3 各组凋亡细胞比例比较(±s,n=10)Tab.3 Comparison of apoptotic cells in each group(±s,n=10)
Note:1)P<0.05 vs normal control group;2)P<0.05 vs model group;3)P<0.05 vs leptin group.
Proportion of apoptotic cells/%10.62±0.22 42.09±0.251)60.03±0.261)2)22.39±0.231)2)3)21.25±0.241)2)3)Groups Normal control Model Leptin Leptin antagonist Positive drug
2.6 各组大鼠肺组织Keap1、Nrf2、HMOX-1、Bcl-2蛋白表达结果 与正常对照组相比,模型组大鼠肺组织Keap1、Nrf2、HMOX-1、Bcl-2 蛋白表达降低(P<0.05);与模型组相比,瘦素组大鼠肺组织Keap1、Nrf2、HMOX-1、Bcl-2 蛋白表达降低(P<0.05);与瘦素组相比,瘦素拮抗剂组及阳性药物组大鼠肺组织Keap1、Nrf2、HMOX-1、Bcl-2 蛋 白 表 达 升 高(P<0.05);瘦素拮抗剂组与阳性药物组相比,上述指标差异无统计学意义(P>0.05),见表4、图3。

图3 各组大鼠肺组织中Keap1、Nrf2、HMOX-1、Bcl-2 蛋白表达Fig.3 Expressions of Keap1,Nrf2,HMOX-1 and Bcl-2 protein in lung tissue of rats in each group
表4 各组大鼠肺组织Keap1、Nrf2、HMOX-1、Bcl-2蛋白表达比较(±s,n=10)Tab.4 Comparison of Keap1,Nrf2,HMOX-1,Bcl-2 protein expressions in lung tissue of rats in each group(±s,n=10)

表4 各组大鼠肺组织Keap1、Nrf2、HMOX-1、Bcl-2蛋白表达比较(±s,n=10)Tab.4 Comparison of Keap1,Nrf2,HMOX-1,Bcl-2 protein expressions in lung tissue of rats in each group(±s,n=10)
Note:1)P<0.05 vs normal control group;2)P<0.05 vs model group;3)P<0.05 vs leptin group.
Bcl-2/β-actin 1.01±0.11 0.49±0.091)0.14±0.101)2)0.79±0.091)2)3)0.81±0.101)2)3)Groups Normal control Model Leptin Leptin antagonist Positive drug Keap1/β-actin 1.02±0.10 0.46±0.081)0.12±0.081)2)0.79±0.091)2)3)0.80±0.091)2)3)Nrf2/β-actin 1.06±0.11 0.48±0.091)0.14±0.081)2)0.78±0.101)2)3)0.79±0.091)2)3)HMOX-1/β-actin 1.09±0.10 0.46±0.091)0.15±0.091)2)0.80±0.101)2)3)0.81±0.091)2)3)
3 讨论
哮喘病因复杂,其发病机制至今尚不明确,而理想的哮喘动物模型对哮喘病因及发病机制的研究具有十分重要的意义[14]。OVA 来源于蛋清,价格便宜,具有很强的免疫源性,大鼠腹腔注射OVA 一段时间后,用OVA 雾化致敏,可诱发大鼠哮喘发作,此方法是目前国内外常用的动物哮喘造模方法[15]。本研究采用OVA 激发建立大鼠哮喘模型,与正常对照组相比,模型组大鼠出现呼吸急促、喘息、打喷嚏现象,且口、鼻处有白色黏性分泌物出现,BALF 中炎症因子IL-6、TNF-α 含量增加,肺功能指标Ri、Re增加,Cldyn降低,肺组织出现支气管周围炎症细胞浸润、杯状细胞增生及黏液分泌、气道平滑肌增厚、管腔变窄等病理现象,与文献[16]研究动物哮喘症状及病理损伤结果一致,提示模型组大鼠出现气道炎症、通气受限及支气管肺组织炎症损伤,表明大鼠哮喘模型建造成功。
近来研究发现,瘦素与哮喘关系密切,机体瘦素水平与哮喘严重程度呈正相关[9]。陈云峰等[17]发现外源性给予瘦素可抑制支气管哮喘大鼠气道平滑肌细胞β2 肾上腺素能受体(β2-AR)表达,促进炎症因子释放,并推测这可能是瘦素参与哮喘肺功能下降进程的原因。然而李桂茹等[12]发现外源性给予瘦素可降低机械通气肺损伤中炎症细胞因子的表达,降低肺损伤,与文献[17]报道的瘦素促进炎症介质、抑制气道平滑肌细胞β2-AR 表达,加重哮喘患者肺功能损伤的结论相反。本研究给予哮喘大鼠瘦素及瘦素拮抗剂进行观察,从正反两面验证瘦素与哮喘的关系。结果发现,与模型组相比,瘦素组大鼠呼吸加快、四肢瘫软、腹肌痉挛现象加重,BALF 中IL-6、TNF-α 含量及肺功能指标Ri、Re 进一步增加,Cldyn 进一步降低,肺组织支气管壁炎症浸润、杯状细胞增生及黏液分泌等病变进一步加重;瘦素拮抗剂和阳性药物组大鼠上述哮喘症状、血清学指标、炎症指标、肺功能指标及组织病理损伤与模型组相比均明显减轻,表明外源性给予瘦素可加重哮喘症状和病理损伤,而瘦素拮抗剂可改善哮喘症状和病理损伤。然而瘦素加重哮喘进程的具体分子生物学机制还不甚明确,本研究对此进行继续探究。
氧化应激反应在哮喘病理进程中发挥重要作用,KLENIEWSKA 等[18]发现机体内氧化应激产物,如活性氧蓄积,可引起生物膜上参与电子转运的酶失活以及细胞溶解,从而产生组织损伤,并证明氧化应激过度反应是哮喘发病的关键环节。马南等[19]发现氧化应激失衡参与了哮喘的发展,并推测氧化应激指标MDA 水平可作为哮喘严重程度及控制水平的监测指标。本研究发现,与正常对照组相比,模型组大鼠肺组织氧化应激指标MDA 含量升高,SOD 活性降低,肺组织凋亡细胞比例升高,提示哮喘模型大鼠机体内存在氧化应激反应。Keap1-Nrf2通路与氧化应激和凋亡等密切相关,NAZIMA 等[20]发现Nrf2 的表达上调可促进Nrf2 与Keap1 解离,进而通过提高细胞抗氧化能力、消除过氧化产物堆积发挥抗氧化损伤作用;此外,Nrf2高表达通过促进抗凋亡因子Bcl-2 表达发挥抗凋亡作用。郑怜玉等[21]发现黄连素可上调Nrf2、Keap1 表达,并激活Nrf2 下游抗氧化蛋白酶HMOX-1 表达,提高肺组织的抗氧化能力,进而降低肺组织氧化损伤。本研究发现,与正常对照组相比,模型组大鼠Nrf2、Keap1、HMOX-1、Bcl2 蛋白表达降低,提示哮喘模型组大鼠肺Nrf2-Keap1 通路被抑制,机体抗氧化应激能力减弱,肺组织损伤和细胞凋亡严重。而与模型组相比,瘦素组大鼠肺组织Nrf2、Keap1、HMOX-1、Bcl-2蛋白表达进一步降低,而氧化应激指标MDA 升高、SOD 降低,肺组织细胞凋亡比例进一步增加,表明瘦素具有促进哮喘症状和病理损伤进程的作用,其可能与抑制Nrf2-Keap1 通路激活,降低机体抗氧化应激反应和组织细胞凋亡作用有关。本研究还发现,瘦素拮抗剂组及阳性药物组大鼠Nrf2 通路蛋白表达、氧化应激指标、肺组织细胞凋亡比例均显著低于模型组,提示瘦素拮抗剂可能通过激活Nrf2-Keap1 通路表达促进机体抗氧化应激和抗凋亡作用,进而改善哮喘症状和病理损伤。
综上所述,瘦素可抑制Nrf2-Keap1通路激活,降低机体抗氧化应激和抗凋亡作用,进而加重哮喘进程,可能为阐明瘦素参与哮喘病程的机制提供一定参考。但Nrf2 靶分子调控机制复杂,本研究未设置通路抑制剂进行实验,这有待后续深入研究。

