单磷酸阿糖腺苷联合布地奈德治疗小儿毛细支气管炎SAA、INF⁃γ及IL⁃33水平变化
师玉霞 张莹莹 王妍 王彩 郭泽磾 曹慧娜 赵巧霞
毛细支气管炎为婴幼儿常见下呼吸道感染,病毒感染为此病的常见病因,此外与患者免疫系统失衡、不完善等因素均存在一定联系[1]。据相关数据统计,毛细支气管炎者晚年出现哮喘机率为30%左右,对患者生活质量及生命安全均造成不良影响[2]。血清样淀粉蛋白A(serum amyloid protein A,SAA)为急性感染时相反应蛋白,为敏感的炎性指标[3]。干扰素⁃γ(interferon,INF⁃γ)是调节Th/Th12 免疫应答平衡的重要活性物质,在抗病毒和免疫反应中有重要的作用[4]。白细胞介素⁃33(Interleukin,IL⁃33)是诱导TH2 细胞上调的重要影响因子,可直接反映哮喘患者气道炎症反应[5]。有研究发现SAA、INF⁃γ 及IL⁃33在小儿毛细支气管炎中发挥着重要的作用[6]。临床中对毛细支气管炎治疗常使用扩张剂、抗生素等治疗,但效果不尽人意。单磷酸阿糖腺苷为临床中常用的抗病毒治疗药物,可减少病毒复制、翻译及转录,从而有效控制患儿体内的病毒性感染;布地奈德可改善患儿局部炎症,减轻支气管平滑肌的收缩反应[7]。本文通过单磷酸阿糖腺苷联合布地奈德治疗小儿毛细支气管炎,观察其治疗效果,并探讨其对SAA、INF⁃γ 及IL⁃33 的影响。现报道如下。
1 资料与方法
1.1 一般资料
收集郑州市第七人民医院2016年1月至2020年4月收治的106 例毛细支气管炎患儿,根据不同治疗疗方式分为:59 例为单磷酸阿糖腺苷+布地奈德治疗(观察组),47 例为布地奈德治疗(对照组)。观察组中男32 例,女27 例,平均年龄为(2.25±0.85)岁,平均病程(2.54±0.87)d;对照组中男28 例,女21 例,平均年龄为(2.34±0.77)岁,平均病程(2.24±0.59)d。纳入标准:①首次发病者;②有急性发作性呼吸性喘息;③伴有病毒感染性呼吸道感染征象;④符合《毛细支气管炎的诊断、治疗与预防》[8]中相关诊断标准。排除标准:①先天性支气管畸形者;②合并肾功能不全者;③严重肺炎以及营养不良者。两组一般资料比较差异无统计学意义(P>0.05)。本研究经院医学伦理委员会批准通过,受试患儿监护人已签署知情同意书。
1.2 方法
1.2.1 治疗方法
对照组:使用布地奈德(国药准字H20030987,规格:每瓶200 揿,鲁南贝特制药有限公司)雾化吸入治疗,每次以0.5 mg 布地奈德+生理氯化钠溶液(3 mL)混合,10 min/次,1 次/d。观察组则在常规治疗基础上使用单磷酸阿糖腺苷(国药准字H10970334,规格:0.2g,广东隆赋药业股份有限公司)+布地奈德治疗,布地奈德雾化吸入治疗同对照组,静脉滴注单磷酸阿糖腺苷,使用葡萄糖溶液(5%)100 mL 与0.1 g 单磷酸阿糖腺苷融合,1 次/d。两组治疗时间均为1 周。
1.2.2 SAA、INF⁃γ 及IL⁃33 因子水平检测
治疗前与治疗后1 周,抽取患儿静脉血液5 mL,用3 000 r/min 离心机离心10 min,离心半径10 cm,获取上清液,置于20℃冰箱内冷藏待检。使用酶联免疫吸附法检测SAA、INF⁃γ 及IL⁃33 水平,试剂盒由赫澎(上海)生物科技有公司提供。
1.2.3 炎性因子检测
使用酶联免疫法检测患者肿瘤坏死因子⁃α(tumor necrosis factor,TNF⁃α)、白细胞介素⁃6(Interleukin,IL⁃6)、白细胞介素⁃8(Interleukin,IL⁃8),试剂盒购自武汉默沙克生物科技有限公司。
1.2.4 LTE4、MCP⁃1 检测
使用酶联免疫吸附法检测血清白三烯E4(leu⁃kotriene,LTE4)、单核细胞趋化蛋白⁃1(Monocyte chemoattractant protein,MCP⁃1),试剂盒由赫澎生物科技有公司提供。
1.3 统计学方法
采用SPSS 18.0 统计软件进行统计分析,计量资料采用()表示,采用t检验;计数资料采用n(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 SAA、INF⁃γ 及IL⁃33 因子水平比较
治疗前两组SAA、INF⁃γ 及IL⁃33 因子水平比较差异无统计学意义(P>0.05),治疗后均有所改善,观察组SAA、IL⁃33 水平低于对照组,INF⁃γ 高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 SAA、INF⁃γ 及IL⁃33 因子水平比较(±s)Table 1 Comparison of SAA,INF⁃γ and IL⁃33 factor levels(±s)
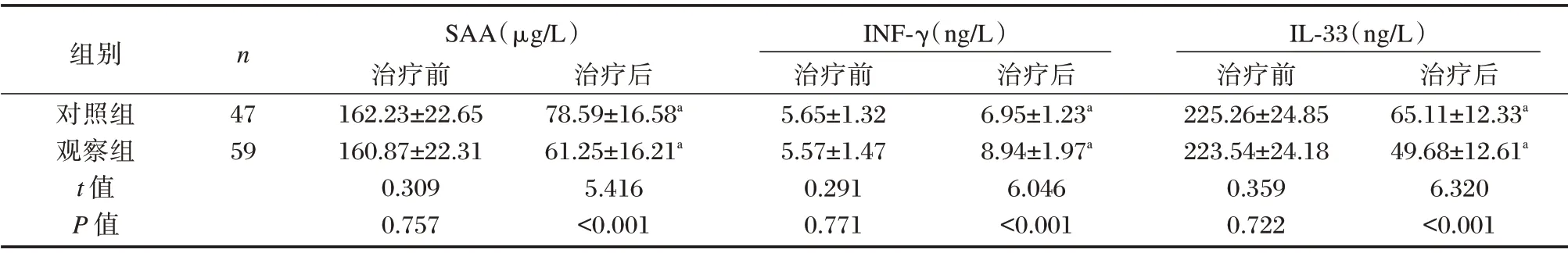
表1 SAA、INF⁃γ 及IL⁃33 因子水平比较(±s)Table 1 Comparison of SAA,INF⁃γ and IL⁃33 factor levels(±s)
注:为同组间治疗前后比较,aP<0.05。
组别对照组观察组t 值P 值n 47 59 SAA(μg/L)治疗前162.23±22.65 160.87±22.31 0.309 0.757治疗后78.59±16.58a 61.25±16.21a 5.416<0.001 INF⁃γ(ng/L)治疗前5.65±1.32 5.57±1.47 0.291 0.771治疗后6.95±1.23a 8.94±1.97a 6.046<0.001 IL⁃33(ng/L)治疗前225.26±24.85 223.54±24.18 0.359 0.722治疗后65.11±12.33a 49.68±12.61a 6.320<0.001
2.2 两组TNF⁃α、IL⁃6、IL⁃8 水平比较
治疗前两组TNF⁃α、IL⁃6、IL⁃8 水平比较差异无统计学意义(P>0.05),治疗后均有所改善,观察组TNF⁃α、IL⁃6、IL⁃8 明显低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组TNF⁃α、IL⁃6、IL⁃8 水平比较(±s)Table 2 Comparison of the levels of TNF⁃α,IL⁃6 and IL⁃8 between the two groups(±s)

表2 两组TNF⁃α、IL⁃6、IL⁃8 水平比较(±s)Table 2 Comparison of the levels of TNF⁃α,IL⁃6 and IL⁃8 between the two groups(±s)
注:为同组间治疗前后比较,aP<0.05。
组别对照组观察组t 值P 值n 47 59 TNF⁃α(ng/L)治疗前81.26±10.64 81.23±10.85 0.014 0.988治疗后44.14±10.62a 32.26±10.37a 5.797<0.001 IL⁃6(ng/L)治疗前20.19±6.24 20.17±6.35 0.016 0.987治疗后14.21±3.18a 9.28±3.61a 7.359<0.001 IL⁃8(ng/L)治疗前244.34±24.84 241.20±24.19 0.656 0.513治疗后166.21±12.36a 126.31±12.41a 16.473<0.001
2.3 两组LTE4、MCP⁃1 水平比较
治疗前两组LTE4、MCP⁃1 水平比较差异无统计学意义(P>0.05),治疗后均有所改善,观察组LTE4、MCP⁃1 低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组LTE4、MCP⁃1 水平比较(±s)Table 3 Comparison of LTE4 and MCP⁃1 levels between the two groups(±s)
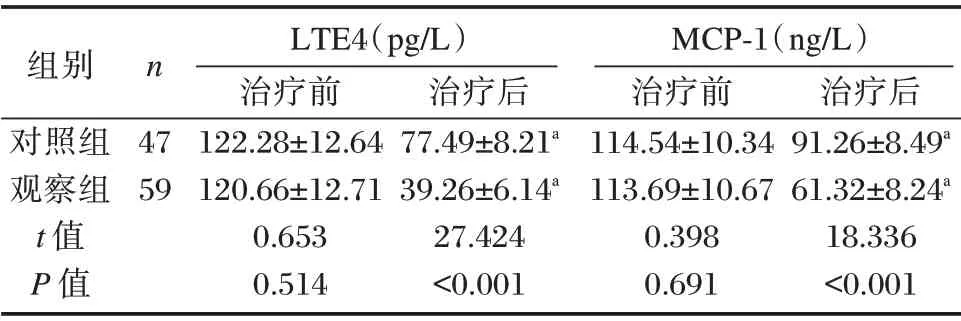
表3 两组LTE4、MCP⁃1 水平比较(±s)Table 3 Comparison of LTE4 and MCP⁃1 levels between the two groups(±s)
注:为同组间治疗前后比较,aP<0.05。
组别对照组观察组t 值P 值n 47 59 LTE4(pg/L)治疗前122.28±12.64 120.66±12.71 0.653 0.514治疗后77.49±8.21a 39.26±6.14a 27.424<0.001 MCP⁃1(ng/L)治疗前114.54±10.34 113.69±10.67 0.398 0.691治疗后91.26±8.49a 61.32±8.24a 18.336<0.001
2.4 临床症状改善时间比较
观察组发热、湿啰音、喘息、咳嗽消退时间比对照组低,差异有统计学意义(P<0.05)。见表4。
表4 临床症状改善时间比较[(±s)]Table 4 Comparison of clinical symptoms improvement time[(±s)]
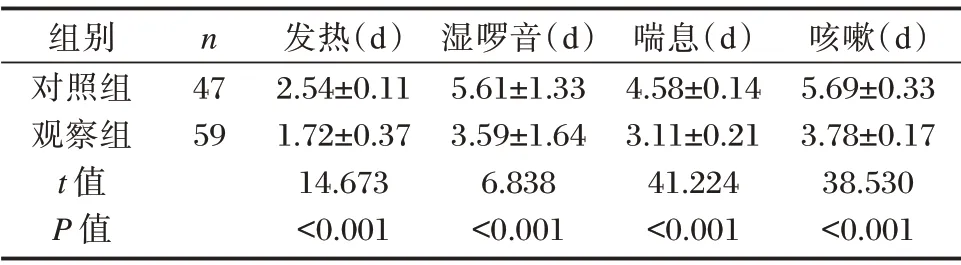
表4 临床症状改善时间比较[(±s)]Table 4 Comparison of clinical symptoms improvement time[(±s)]
组别对照组观察组t 值P 值n 47 59发热(d)2.54±0.11 1.72±0.37 14.673<0.001湿啰音(d)5.61±1.33 3.59±1.64 6.838<0.001喘息(d)4.58±0.14 3.11±0.21 41.224<0.001咳嗽(d)5.69±0.33 3.78±0.17 38.530<0.001
3 讨论
毛细支气管炎发病机制和支气管哮喘相似,由于婴幼儿抵抗能力低下,病原菌侵袭呼吸道后会迅速在病变区域中扩散,毛细胞支气管、肺泡均会被炎症因子侵袭。布地奈德可有效干扰花生四烯酸与白三烯合成,能够提高内源性糖皮质激素的作用,稳定平滑肌功能,减少炎性介质的生成,缓解平滑肌收缩,因此其具有较好的抗炎效果[9]。在临床治疗中通常建议增加抗病毒药物治疗,单磷酸阿糖腺苷则是病毒感染治疗的常用药物,通过抑制DNA 聚合酶减少病毒活性,从而降低病毒合成率[10]。
相关研究显示,毛细支气管炎发生与Th1/Th2免疫应答调节失衡、气道高反应等机制存在密切联系[11⁃12]。TNF⁃α、IL⁃6 和IL⁃8 是临床中用于反映机体炎症严重程度的有效参考指标。SAA 作为急性时相反应蛋白,对病毒感染敏感度比C 反应蛋白更佳[13]。有研究表明,在机体受到病毒、细菌、创伤等因素的影响下可产生IL⁃1、IL⁃6 等促炎细胞因子,促进SAA 在肝脏中合成[14]。在本研究中,使用单磷酸阿糖腺苷联合布地奈德治疗后患儿SAA及TNF⁃α、IL⁃6 和IL⁃8 水平均明显降低,说明联合治疗可有效改善患儿炎症状态,降低SAA 的表达,与单磷酸阿糖腺苷能通过抑制促SAA 表达的炎症因子产生有关,与以往文献研究结果相符[15]。
LTE4 可引起炎性细胞在气道聚集,导致气道平滑肌收缩,从而引起气道高原反应;MCP⁃1 有激活和趋化单核细胞的能力,诱导其产生细胞因子;INF⁃γ 主要经Th1 细胞产生,Th0 也可分泌INF⁃γ,同时INF⁃γ 也是调节Th1/Th2 免疫应答平衡的重要活性物质[16]。以往研究发现,毛细支气管炎、哮喘类患者INF⁃γ 水平可明显降低,导致Th1/Thl2 失衡,进而引发炎症反应升高以及嗜酸性粒细胞活化[17]。在本研究中,联合治疗后患儿LTE4、MCP⁃1低于对照组,而INF⁃γ 高于对照组,分析与单磷酸阿糖腺苷通过抑制蛋白质及腺苷高半胱氨酸水解酶合成,切断甲基转移酶的反应,最终抑制了DNA 病毒的复制有关。
IL⁃33 是Th2 细胞表面表达的一种重要因子,可使气道处于高反应性,引起气道生理重塑,是导致哮喘发生、发展的重要炎性因子[18]。本研究中,治疗后患者IL⁃33 水平均下降,且观察组下降程度更明显,提示联合用药可降低机体炎症水平,抑制气道炎症反应。本研究结果还显示,使用单磷酸阿糖腺苷联合布地奈德治疗患儿临床症状消失时间明显短于对照组,与以往研究结果相符[19]。提示单磷酸阿糖腺苷联合布地奈德两者在治疗上起到了协调作用,通过改善患者机体炎症水平,从而缓解患者临床症状,对促进患者康复有积极意义。
综上所述,单磷酸阿糖腺苷联合布地奈德治疗小儿毛细支气管炎可降低患儿SAA、IL⁃33 水平,增加INF⁃γ 表达,加速炎症症状缓解,从而促进患者恢复。

