西藏环状病毒可视化RT-LAMP检测方法的建立与应用
杨振兴,李占鸿,李卓然,李 乐,杨 恒,牛保生,姚萍芬,朱建波* (.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,云南 昆明 6504;.云南省师宗县动物疫病预防控制中心,云南 曲靖 655700)
西藏环状病毒(Tibet orbivirus,TIBOV)属呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus),病毒粒子呈20面体,大小约为80 nm,为无包膜双链RNA(dsRNA)病毒[1]。病毒基因组为21 kb,由 10个节段长度不同的dsRNA(Seg-1~Seg-10)组成,可以编码(VP1~VP7)7种结构蛋白和(NS1~NS4)4 种非结构蛋白[2]。其中Seg-6长1 100 bp,编码346个氨基酸残基的病毒核心蛋白VP6,为解旋酶,参与ssRNA和dsRNA结合与解旋,不同毒株间Seg-9的核酸序列高度保守,相似度高于95%[3]。
TIBOV(XZ0906)于2009年首次从我国西藏采集的圆斑按蚊中分离到,这是一种新型环状病毒[1]。2009年和2011年分别在广东省的致倦库蚊和湖南的三带喙库蚊中分离到TIBOV(D181/2008和HN11121),其中三带喙库蚊是我国乙脑病毒的重要传播媒介,不仅分布范围广而且是很多地区的优势蚊种[4]。2012、2013和2019年分别在云南省芒市、西双版纳傣族自治州和师宗县采集的库蠓中相继分离到TIBOV(DH13C12、YN12246和YNSZ/V290/2019)[5-7]。在云南省江城、师宗、景洪和德宏等地区采集到的牛、羊和猪血清中均检测到TIBOV的中和抗体,抗体效价较高,且多地牛血清抗体阳性率高于20%[7]。以上研究结果表明TIBOV已经在我国多地被发现和分离,并可感染多种家畜动物,有文献报道TIBOV是家畜动物不明热和流产的潜在致病性病原,对我国畜牧养殖业构成了潜在威胁[3],因此建立TIOBV的快速可视化病原学检测诊断方法对疫病的防控具有指导作用。
目前,已建立了TIBOV的常规RT-PCR和qRT-PCR检测方法[7],虽然这2种检测方法均具有准确可靠的优势,但常规RT-PCR耗时长,灵敏度低,扩增结束后需通过电泳检测,易污染,而且很难在感染初期检出病毒;qRT-PCR检查方法的灵敏度和时效性上有所提高,但是需要昂贵的检测设备。环介导等温扩增(loop-mediated isothermal amplification,LAMP)是由NOTOMI等[8]于2000年发明的一种新型恒温核酸扩增方法,该技术借助具有链置换作用的Bst DNA聚合酶的帮助,可在等温条件下进行靶序列高效快速扩增,避免了常规RT-PCR和实时荧光定量RT-PCR的梯度升降温模式[9]。所以,LAMP无需昂贵的设备,而且该技术可以根据反应管中液体颜色的变化,通过肉眼识别即可做出判断,做到了真正意义上的现场可视化快检[10]。近年来,国内外已将该技术广泛应用于细菌、真菌和病毒等病原微生物的检测,其灵敏度、特异性和时效性都有很好的体验。
鉴于目前尚未见LAMP方法用于TIBOV的检测,本研究选择我国分离TIBOV(YNSZ/V290/2019)毒株[6]的Seg-9序列作为靶基因,根据高保守区域设计RT-LAMP特异性引物,建立了针对TIBOV的特异性RT-LAMP检测方法,为开展我国TIOBV的检测与流行病学调查提供了技术支撑。
1 材料与方法
1.1 毒株和昆虫样品流行性出血病病毒(epizootic haemorrhagic disease virus,EHDV)YNSZ/V003/2012[11]、蓝舌病病毒(bluetongue virus,BTV)GDST008[12]、中山病病毒(Chuzan virus,CHUV)SZ187[13]、广西环状病毒(Guangxi orbivirus,GXOV)V172/GX/2015[14]、阿卡斑病毒(Akabane virus,AKAV)V287/YNSZ/2019[15]、版纳病毒(Banna virus,BAV)YNSZ043[16]、芒市病毒(Mangshi virus,MSV)V301/YNJH/2019[17]和TIBOV(YNSZ/V290/2019)等虫媒病毒由本实验室分离保存。昆虫样品为采集自云南省景洪和师宗不同地区牛羊养殖场的2 596只蠓虫和蚊虫,其中蠓虫1 947只,蚊虫649只。
1.2 主要试剂WarmStart®LAMP变色预混液(M1800)购自新英格兰生物实验公司(北京);一步法RT-PCR试剂盒、DL5000 DNA Marker和DH5α感受态细胞购自TaKaRa;pLB零背景快速克隆试剂盒购自天根生化科技(北京)有限公司;磁珠法病毒核酸提取试剂盒(MagMAX-96 Viral RNA Isolation Kit)购自Thermo公司。
1.3 引物设计和合成从GenBank中下载TIBOV株的Seg-9基因序列,与本研究室前期分离的TIBOV(YNSZ/V290/2019)毒株Seg-9序列进行比对,选择高度保守区域,利用PrimerExplorer V5(http://primerexplorer.jp/e/)在线软件设计6条特异性引物:1对外引物TIBOV-F3/B3,1对内引物TIBOV-FIP/BIP和1对环引物TIBOV-Floop/Bloop(表1)。引物由南京金斯瑞生物技术有限公司合成。
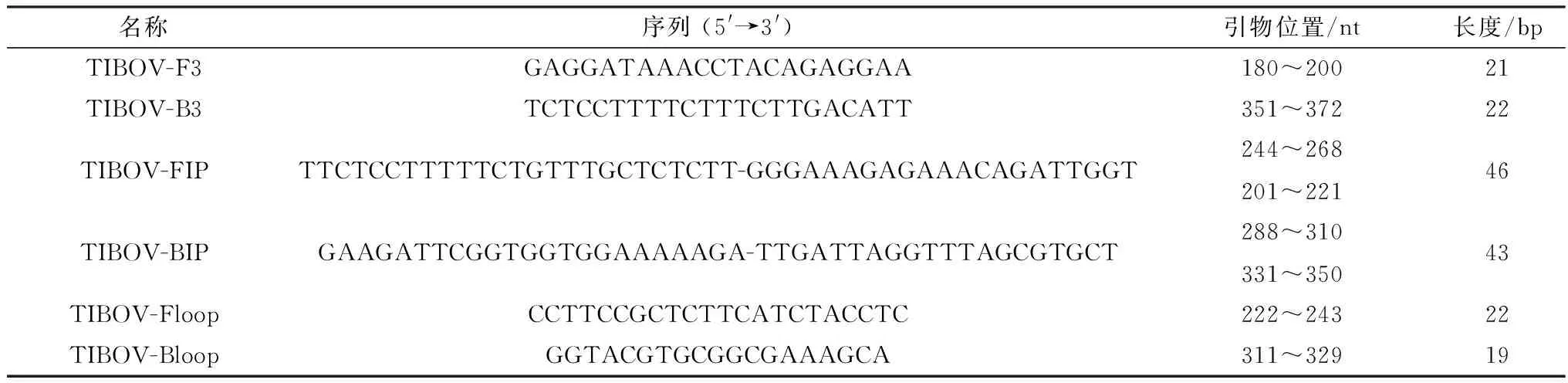
表1 TIBOV的RT-LAMP检测引物相关信息
1.4 核酸的提取及质粒标准品构建使用磁珠法病毒RNA提取试剂盒,按照产品说明书对EHDV、BTV、CHUV、GXOV和TIBOV毒株及昆虫样品进行RNA提取。标记编号后,PCR仪上95℃加热5 min后,迅速冰浴冷却进行变性处理,解开病毒基因组的双链RNA,-70℃保存备用。利用TIBOV RT-LAMP的外侧引物F3/B3对提取的TIBOV核酸进行RT-PCR扩增,将回收产物与pLB载体连接,转化感受态细胞后,筛选、鉴定出正确的重组质粒,并进行测序验证。经紫外分光光度计测定质粒浓度后,根据公式计算出质粒拷贝数。
1.5 可视化RT-LAMP反应体系及反应条件的优化以TIBOV核酸为模板,配置反应体系(25 μL):WarmStart LAMP 2×Master Mix 12.5 μL、TIBOV-F3/PALV-B3引物(10 μmol/L)各1 μL、TIBOV-FIP/PALV-BIP 引物(20 μmol/L)各1 μL、TIBOV-Floop/Bloop(20 μmol/L)各1 μL,模板核酸2 μL,加入无核酸酶灭菌水至25 μL。在此反应体系和反应条件下,利用棋盘法分别优化内外引物比例(1∶1,2∶1,3∶1,4∶1和5∶1)、反应温度(60,62,64,66℃),反应时间(40,50,60,70 min),核酸模板(1,1.5,2 μL),确定最佳反应体系和条件。
1.6 特异性试验取EHDV、BTV、CHUV、GXOV、BAV、MSV和TIBOV等虫媒病毒的核酸为模板,以ddH2O为阴性对照,用建立的RT-LAMP方法同时进行检测,分析该方法的特异性。
1.7 敏感性试验将已经测定拷贝数的TIBOV重组质粒用无核酸酶灭菌水10倍梯度稀释成100~106拷贝/μL 7个梯度,每个反应管加入1 μL稀释的核酸样品作为模板,进行TIBOV RT-LAMP和常规RT-PCR[7]扩增,反应结束后进行琼脂糖凝胶电泳,分析比较两种方法的敏感性。
1.8 昆虫样品检查用TIBOV RT-LAMP和常规RT-PCR方法[7]分别检查2 596份蠓虫和蚊虫的核酸样品,反应结束后进行琼脂糖凝胶电泳,比较2种方法的检出率,并计算两者的符合率。
2 结果
2.1 可视化RT-LAMP反应体系及反应条件的优化经棋盘法确定优化后的RT-LAMP反应体系(25 μL):WarmStart LAMP 2×Master Mix 12.5 μL、TIBOV-F3/PALV-B3引物(10 μmol/L)各0.2 μL、TIBOV-FIP/PALV-BIP引物(20 μmol/L)各0.4 μL、TIBOV-Floop/Bloop(20 μmol/L)各0.4 μL,模板核酸1.5 μL,加入无核酸酶灭菌水至25 μL;反应条件:64℃ 50 min,80℃ 5 min终止反应。RT-LAMP反应结束后,TIBOV核酸样品反应液颜色由红色变为黄绿色,电泳呈现梯度状条带,为阳性;而阴性对照的反应液仍为粉红色,电泳无条带出现(图 1),表明优化所得RT-LAMP可视化反应结果良好。
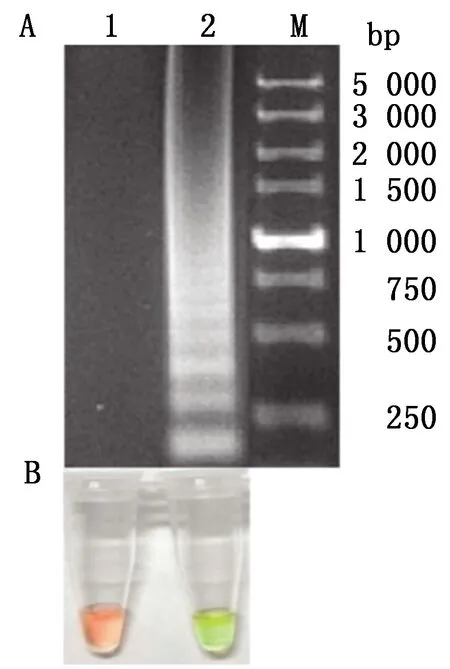
A.电泳结果;B.目测结果;1.阴性对照;2.TIBOV;M.DL5000 DNA Marker图1 TIBOV RT-LAMP 最佳反应体系和反应条件下的检测结果
2.2 特异性试验对EHDV、BTV、CHUV、GXOV、AKAV、BAV、MSV和TIBOV的核酸进行RT-LAMP检测,结果显示仅TIBOV核酸检测结果出现梯度状条带,反应管颜色变为黄绿色,显现为阳性,而其他病毒的检测结果均为阴性(图2),表明该检测方法具有较强的特异性。
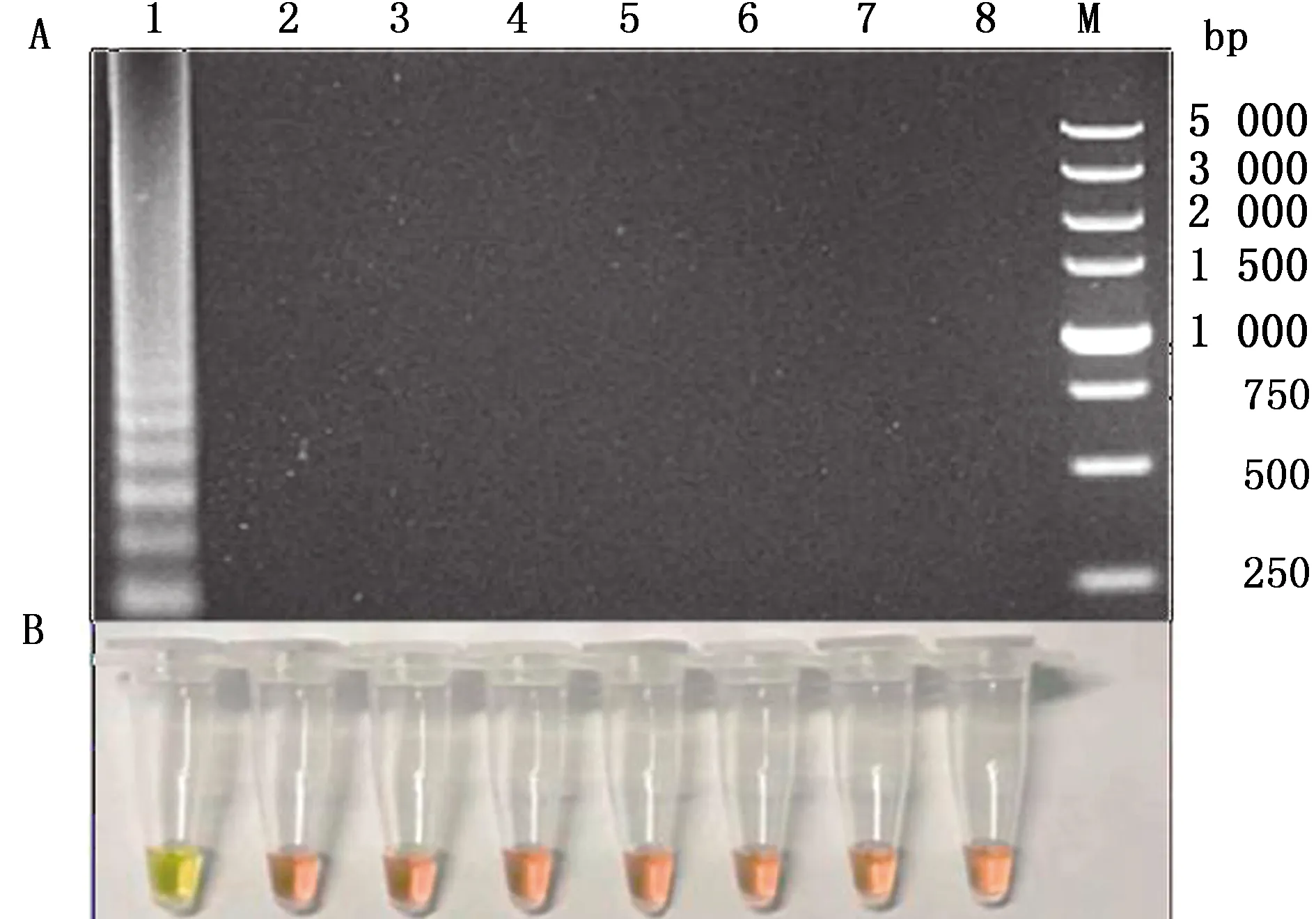
A.电泳结果;B.目测结果。1.TIBOV;2.EHDV;3.BTV;4.CHUV;5.GXOV;6.AKAV;7.BAV;8.MSV;M.DL5000 DNA Marker图2 TIBOV RT-LAMP特异性试验结果
2.3 敏感性试验经紫外分光光度计测定构建的TIBOV基因重组质粒(pLB-TIBOV/V209/Seg-9)的质量浓度为38.5 mg/L,根据公式计算出核酸拷贝数为1.82×1011拷贝/μL。用无核酸酶灭菌水将质粒10倍梯度稀释成1.82×100~1.82×106拷贝/μL的7个浓度梯度,各取1 μL为模板同时进行TIBOV RT-LAMP和常规RT-PCR扩增。结果显示RT-LAMP和RT-PCR分别检出TIBOV的最低核酸浓度分别为18.2和182 拷贝/μL(图3),但RT-PCR的电泳条带较弱,c高10倍以上。
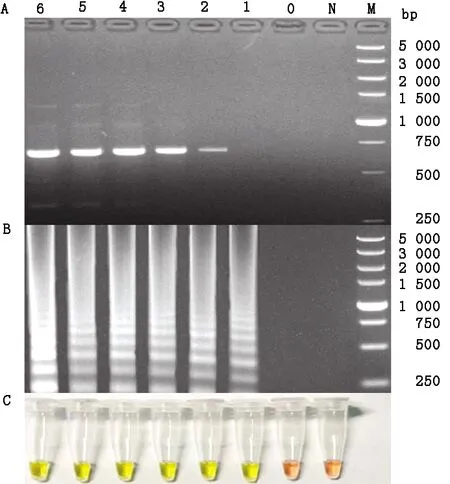
A.RT-PCR电泳结果;B.RT-LAMP电泳结果;C.RT-LAMP目测结果。0~6.为TIBOV阳性质粒(pLB-TIBOV/V209/Seg-9)10倍梯度稀释至1.82×100~1.82×106 拷贝/μL的7个梯度样品;N.阴性对照;M.DL5000 DNA Marker图3 TIBOV RT-LAMP灵敏度试验结果
2.4 昆虫样品的检查用TIBOV RT-LAMP和常规RT-PCR方法分别检测2 596份蠓虫和蚊虫的核酸样品,结果显示(表2),RT-LAMP检测86份为阳性,2 510份为阴性,阳性检出率为3.31%;RT-PCR检测31份为阳性,2 565份为阴性,阳性检出率为1.19%;2种方法检测同为阳性和阴性的样品各为31份和2 510份,符合率为[(31+2 510)/2 596]×100%=97.88%。表明RT-PCR虽能用于检测昆虫样品中的病毒核酸,但因敏感性较RT-LAMP低,导致部分病毒载量较低的阳性样品检查结果为阴性。
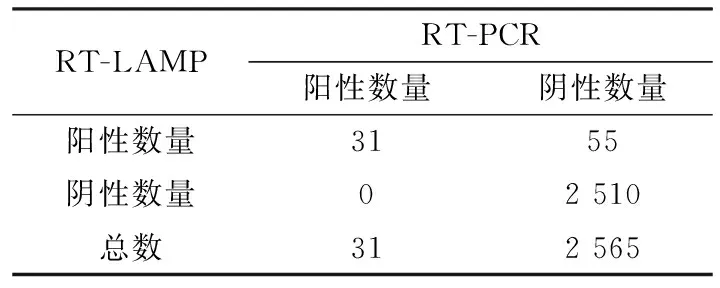
表2 RT-LAMP和RT-PCR方法检测结果的符合率 份
3 讨论
近年来随着人们对环状病毒属病毒的深入研究,不断有新型环状病毒被陆续分离和发现,一方面拓展了人们对环状病毒属病毒的认识,另一方面掌握新发环状病毒属病毒的流行特征对动物疫病防控与保障公共卫生安全具有重要的意义。作为一种新发环状病毒的西藏环状病毒,目前国内外已报道了病原分离[6]、病毒抗体[3]及核酸检测等多种方法。病原分离工作量大、耗时长,不便于进行快速检测;抗体检测方法,由于抗体的产生相对于病毒感染存在一定的滞后性,不利于疫病的早期诊断和防控;核酸检测方法如巢式PCR[18]、RT-PCR及qRT-PCR[7]等,检测结果准确可靠,但主要局限于实验室检测,无法实现现场快速检测。因此本研究以TIBOV的Seg-9为靶基因设计特异性引物,建立了RT-LAMP检测方法,完善了TIBOV检测技术体系。
本研究针对TIOBV靶片段设计了6条特异性引物,提高了扩增效率,增加了扩增产物。由于RT-LAMP比RT-PCR的扩增效率高,开管检测的方式更容易造成污染,这是RT-LAMP技术在基层推广中遇到的最大问题[19]。通过使用含钙黄素的预混染料,在反应结束后,阳性样品管会出现明亮的黄绿色,而阴性样品管为粉红色,在自然光下肉眼观察直接观察对比颜色变化,直接判断样品的阴阳性。此外,阳性样品由于扩增产生了大量产物,与阴性对照相比阳性管溶液会更为浑浊。本研究建立的可视化RT-LAMP方法避免了其他方法采用电泳等开管方式检测时,容易使扩增产物气溶胶溢出,污染试验环境从而出现假阳性的可能。
EHDV、BTV、CHUV、GXOV、BAV和MSV均为蠓虫或蚊虫传播的虫媒病毒,自然环境中多种虫媒病毒流行区域重叠或同时感染易感动物的情况普遍存在[20]。因此,为确保TIBOV RT-LAMP检测方法的特异性,我们对以上6种病毒的核酸进行检测,结果均为阴性,表明本研究建立的RT-LAMP检测方法具有较好的特异性。同时通过引入1对环引物(LF/LB),摸索最佳扩增温度,提高了RT-LAMP的反应效率,进一步缩短反应时长,加速显色反应,以TIBOV质粒为检测对象,其最低检出限为18.2拷贝/μL,反应时间仅为RT-PCR的1/2,敏感性是RT-PCR方法的10倍以上。
昆虫样品检测结果显示,RT-LAMP检出阳性86份,检出率为3.31%,RT-PCR检出阳性31份,检出率为1.19%,因为阳性昆虫样品的病毒载量较低,而RT-LAMP的灵敏度更高,因此病毒检出率是常规RT-PCR的2倍以上。同时发现RT-PCR检测昆虫样品时,扩增产物的电泳条带较弱,可能导致一些样品检测时出现假阴性。因此RT-LAMP有更好的灵敏度和时效性,更适合大规模样品的快速检测和病原学调查。本研究建立的RT-LAMP为我国开展TIBOV的流行病学调查和疫病的现场快速检测提供了有效的技术支撑。

