聚唾液酸高产菌株的高通量诱变选育及发酵工艺优化
施明雨,郭 亭,,3,,魏荷芬,应汉杰,,3,张宿义,陈 勇,,3,唐成伦
(1.江苏集萃工业生物技术研究所有限公司,江苏 南京 211800;2.南京高新工大生物技术研究院有限公司,江苏 南京 211800;3.南京工业大学 国家生化工程技术研究中心,江苏 南京 211800;4.泸州老窖股份有限公司,四川 泸州 646000)
唾液酸(SA),化学名为N-乙酰基神经氨酸,是一种天然的碳水化合物[1]。在医学领域中,唾液酸在大脑和神经系统的产生和发育中发挥非常重要的作用[2]。特别是对于出生体质量较轻的婴儿,充足的唾液酸补给对婴儿大脑的正常发育至关重要;孕妇分娩后体内的唾液酸含量水平逐渐下降,为维持体内唾液酸水平,孕妇乃至孕后仍需额外摄取足量的唾液酸。另外,唾液酸的含量还与DHA的含量有着明显的相关性,这表明它极有可能与婴儿的脑结构和脑功能发育有关,可能两者都对早期脑发育有益[3]。目前,唾液酸作为一种“全能型”新食品资源,可以应用于食品、奶粉、医药和化妆品等众多领域。
据中国燕窝市场分析报告显示,2016—2020年,燕窝的需求与供给均以超过10%的速度增长,但供需矛盾非常突出,如2019年的供需差额约3 000 吨/年;随着唾液酸的应用市场的不断拓展,唾液酸的潜在市场需求估计为1 500 吨/年,其市场容量在300~1 000亿元/年[6]。唾液酸的生产方法主要有天然提取法、酶合成法、化学合成法和微生物发酵法。唾液酸在天然原料中的含量很低,所以唾液酸的天然提取法应用有限;唾液酸酶合成法的缺点是原料成本高,这在一定程度上限制了酶合成法的规模化生产;唾液酸的化学合成法所需的反应条件苛刻(如氧化过程需要在-78 ℃进行),不具备优势;微生物发酵法生产唾液酸具有原料廉价、反应条件温和、易于放大的优势,是最具产业化前景的方法。
聚唾液酸(polysialic acid,PSA)是唾液酸单体通过α-2,8和/或者α-2,9糖苷键连接而成的线性多聚糖,以荚膜的形式存在于少数几种致病菌细胞的表面。1959年,Barry和Goebel首先在大肠杆菌(Escherichiacoli) K-235和K-1中发现该聚合物[4]。在固体发酵过程中,聚唾液酸通常以夹膜的形式附于细胞表面;在液体发酵过程中,由于搅拌等作用,聚唾液酸通常以黏液的形式脱落到发酵液中。将聚唾液酸进行酸水解或酶水解后,离纯化可得到唾液酸,这是工业化发酵生产唾液酸的基础[5]。
现阶段的聚唾液酸生产菌株主要是大肠杆菌,野生型大肠杆菌聚唾液酸的产量一般都不高且发酵水平不稳定,所以大肠杆菌的工业化发酵生产产量普遍较低(5~6 g/L),一定程度上限制了其应用。Rode等[7]利用大肠杆菌E.coliK92发酵生产聚唾液酸,产量为1.6 g/L。Stark等[8]利用E.coli通过溶氧反馈补料发酵生产聚唾液酸,产量3 g/L。国内对聚唾液酸的研究起步较晚,目前国内聚唾液酸的发酵水平较低,发酵成本较高。詹晓北等[9]对聚唾液酸的发酵动力学以及pH控制补料进行了研究。张琦等[10]通过两阶段搅拌策略发酵生产聚唾液酸,产量为3.966 g/L。刘金龙[11]优化聚唾液酸生产工艺,进行了500 L规模的中试放大验证,聚唾液酸产量达到5.5 g/L。
诱变筛选技术是获得高产菌株的有效手段之一,但高产聚唾液酸选育过程繁琐。国外关于唾液酸的研究很多,但是主要都是关于唾液酸及其衍生物生物生理活性的研究。本研究利用常压室温等离子体(ARTP)诱变和微生物高通量自动挑选仪,诱变选育得到高产聚唾液酸菌株,通过高密度发酵条件的优化,提升聚唾液酸的生产效率,为发酵法制备唾液酸的产业化提供良好的生产菌种。
1 材料与方法
1.1 材料
样品采集自某天然水体。
EscherichiacoliSA-1,由江苏集萃工业生物技术研究所有限公司微生物育种平台诱变筛选并保藏。
葡萄糖(食品级),山东西王药业有限公司;山梨醇、琼脂,NaCl、MgSO4、K2HPO4、KH2PO4,国药集团化学试剂有限公司;酵母粉、蛋白胨(AR),OXOID公司。
固体培养基(g/L):蛋白胨10、NaCl 10、酵母粉5、琼脂20;灭菌前pH自然。
种子培养基(g/L):蛋白胨10、NaCl 10、酵母粉5;灭菌前pH自然。
鉴别培养基(g/L):葡萄糖30、KH2PO41.0、蛋白胨10、MgSO40.6、琼脂20;灭菌前pH 7.6。
摇瓶培养基(g/L):山梨醇40、(NH4)2SO44.94、K2HPO4·3H2O 5.2、蛋白胨10、MgSO41.2;灭菌前pH 7.6。
上罐培养基(g/L):葡萄糖20、玉米浆20、K2HPO4·3H2O 2.5、KH2PO45.0,MgSO40.9、NaCl 5;pH 6.4。
1.2 主要仪器
ARTP-M型等离子诱变仪,无锡天木清源生物科技有限公司;QPix420型微生物高通量全自动挑选仪,美谷分子仪器(上海)有限公司;SW-CJ-1FD型超净工作台,苏州安泰空气技术有限公司;GENESYS 10S型分光光度计,赛默飞世尔科技(中国)有限公司;ZQZY-CT型振荡培养箱,上海知楚仪器有限公司;T&J-Btype 10 L*2发酵系统,迪必尔生物工程(上海)有限公司;PL600E/02型电子称,梅特勒-托利多仪器(上海)有限公司;G180DWS型立式自动压力蒸汽灭菌锅,致微(厦门)仪器有限公司;Centrifuge 5424R型高速离心机,艾本德中国有限公司。
1.3 方法
1.3.1 PSA含量测定
采用间苯二酚-盐酸法[12],测定PSA含量。
1.3.2 菌株的分离和纯化
将所取水样逐级稀释,分别涂布在鉴别培养基(另加溴甲酚紫10 g/L)上,通过多次稀释和挑选单菌落划线进行纯化,获得多株菌株,编号保存于本实验室。
1.3.3 菌种的生理生化鉴定和进化树分析
Biolog细菌鉴定:采用Biolog微生物自动分析系统(MicroStation,Biolog公司),细菌纯培养采用Biolog BUG 的固体培养基,37 ℃恒温培养12 h,再将菌落用液体培养基(IF - B)稀释,稀释的菌液加入到Gen Ⅲ微板中(每个孔100 μL),37 ℃ 恒温培养24 h,然后用MicroStation进行鉴定。
将测序结果提交GenBank进行BLAST分析。选取同源性相近的序列,再用MEGA7软件对选取的序列进行编辑,并构建系统进化树。
1.3.4 ARTP诱变
从超低温冰箱内取出甘油管划线于LB固体平板,挑选单菌落接种至一级种子液(LB,装液量20 mL,于100 mL摇瓶中),于37 ℃、200 r/min培养过夜。按4%的接种量将一级种子液转接至二级种子液(LB,装液量20 mL),于37 ℃、200 r/min培养约3 h,OD600达到0.6~0.8,取菌液1 mL,用无菌生理盐水梯度稀释104,制成诱变菌悬液。取10 μL菌悬液均匀涂布于载片上,放置在ARTP操作室中:高度2 mm,通气量10 L/min(0 ℃,1个标准大气压),功率100 W,分别处理0、10、20、30、35、40、45和50 s。处理完的载片,迅速转移至1 mL生理盐水中,充分振荡后涂布于含溴甲酚紫的鉴别培养基中,每个梯度做3个平行实验,平板放置于37 ℃生化培养箱中培养24 h,记录平板上的活菌数并计算致死率。致死率按式(1)计算。
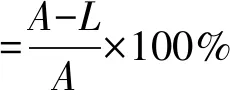
(1)
式中:A为未诱变处理平板上菌落数;L为诱变处理后平板上菌落数。
1.3.5 高产菌株筛选
1) 初筛。利用微生物高通量自动挑选仪扫描鉴别培养基平板上变色光圈直径(D)与菌落直径(d)比值较大的菌落,自动挑选至含摇瓶培养基的96孔板(装液量100 μL),37 ℃、150 r/min培养72 h,测定各孔菌株的PSA含量。每株单菌落做2个平行试验,复挑至Copy板培养24 h,作为初筛种子保藏甘油管。
2) 摇瓶复筛。将初筛得到菌株甘油管从超低温冰箱取出划线接种于LB固体平板,挑选单菌落接种至一级种子液(LB,装液量20 mL),于37 ℃、200 r/min培养过夜。按2%的接种量将一级种子液转接至含摇瓶培养基的摇瓶中(LB,装液量100 mL于500 mL摇瓶中),37 ℃、200 r/min培养72 h。以间苯二酚法检测PSA含量,以出发菌株为对照,筛选PSA产量较高的菌株。
1.3.6 细胞生物量测定
菌体量测定取一定量发酵液稀释一定倍数后测定OD600,OD600=1.0相当于0.45 g干菌体的质量(以1 L发酵液计)。
1.3.7 遗传稳定性验证
对获得的突变菌株进行5次传代,经过摇瓶(装液量100 mL)37 ℃、200 r/min下培养72 h,测定其各代的SA产量、生物量、发酵结束pH,验证菌种的遗传稳定性。
1.3.8 高密度发酵条件优化
在10 L发酵罐上对筛选的高产菌株进行高密度发酵,优化最佳产高PSA的高密度培养条件。优化后的培养条件:10 L玻璃发酵罐装液量为5 L、接种量为4%、发酵温度为37 ℃并以15%氨水控制pH在6.4,通过联动调节搅拌和通气量控制溶解氧在30%以上,采用恒速补料策略(发酵5 h开始以100 mL/h的速率)进行补料至发酵结束,补料培养基为500 g/L葡萄糖。
2 结果与分析
产聚唾液酸大肠杆菌菌株的选育过程通常是酸碱指示剂为初筛条件,然后通过间苯二酚法检测聚唾液酸含量来筛选出高产菌株,如高霖等[13]以溴甲酚紫为酸碱指示剂,对大肠杆菌SA-1进行常温常压等离子体(ARTP)和硫酸二乙酯(DES)诱变,然后在含酸碱指示剂的平板上人工挑选光圈、菌落较大的菌株,整个过程工作枯燥,步骤单一,操作人员容易疲劳、出错。高产聚唾液酸的大肠杆菌菌株的获得一定是基于庞大的突变库,本研究将酸碱指示剂和高通量自动挑选仪结合进行自动化高通量筛选,经过多轮筛选获得高产唾液酸大肠杆菌菌株。
2.1 产唾液酸菌株筛选
从天然水体取得水样,通过溴甲酚紫的鉴别培养基共分离纯化出50株菌,并借助全自动菌落挑选仪的颜色识别功能进行高通量自动化挑选培养基上各菌株的变色光圈直径(D)/菌落直径(d)比值较大的唾液酸突变株,经过多轮筛选获得高产唾液酸大肠杆菌菌株,筛选出6株菌株,见表1。进一步检测6株菌株聚唾液酸含量(间苯二酚法),其产量为0.01~0.20 g/L,其中5号菌株产量最高(0.20 g/L),记为SA-1,选作为后续研究菌株。
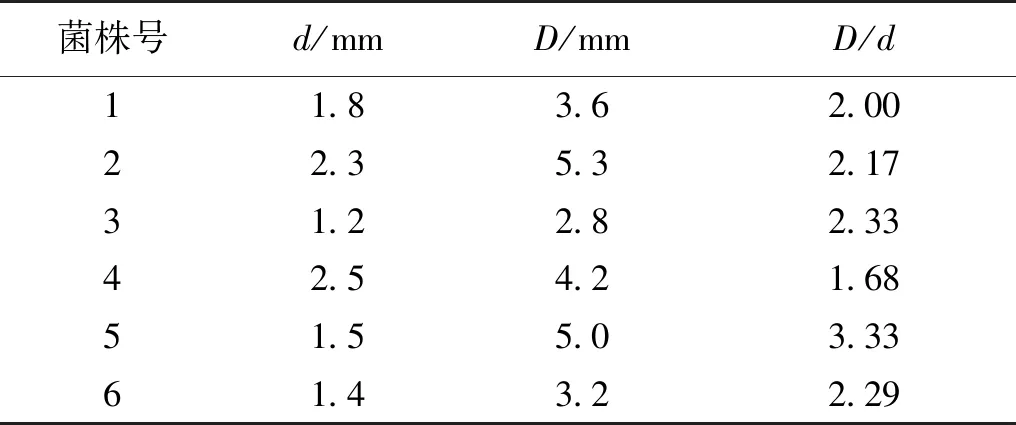
表1 产聚唾液酸菌株的初筛结果Table 1 Preliminary screening results of polysialic acid producing strains
2.2 菌株鉴定
将菌株SA-1接种于LB固体培养基中,菌落边缘整齐、湿润、透明、有光泽;对菌株SA-1进行Biolog鉴定(表2),相似度大于0.5;另外,对菌株SA-1系统进化树同源性分析,结果见图1。由图1可知:菌株SA-1与大肠杆菌144的同源性达100%。选取序列相近的序列进行系统进化树的分析,测序序列与大肠杆菌K235的同源性达100%。综合2种鉴定结果判定该菌为大肠杆菌。
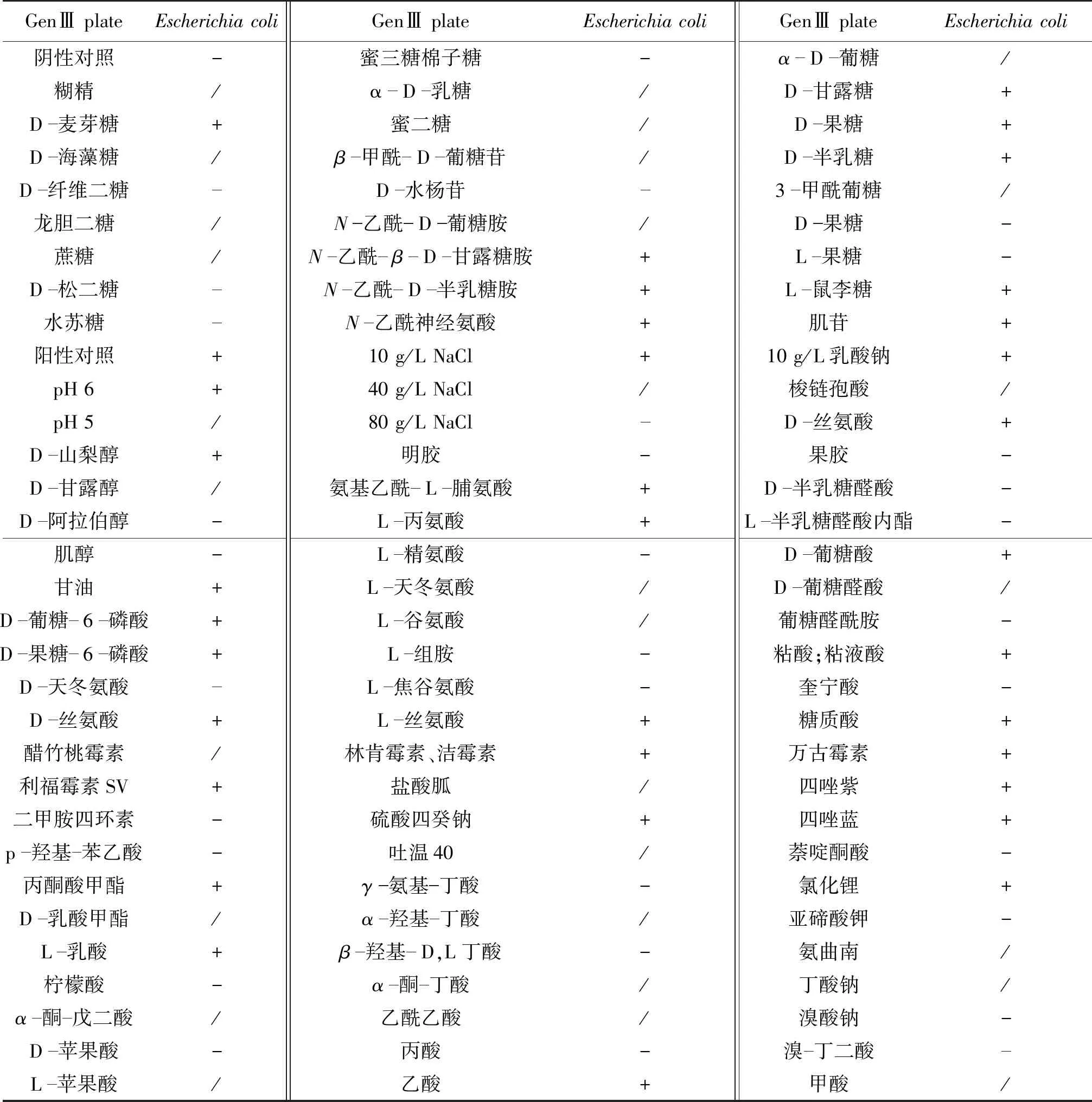
表2 菌株SA-1的Biolog鉴定结果Table 2 Results of strain SA-1 by Biolog identification
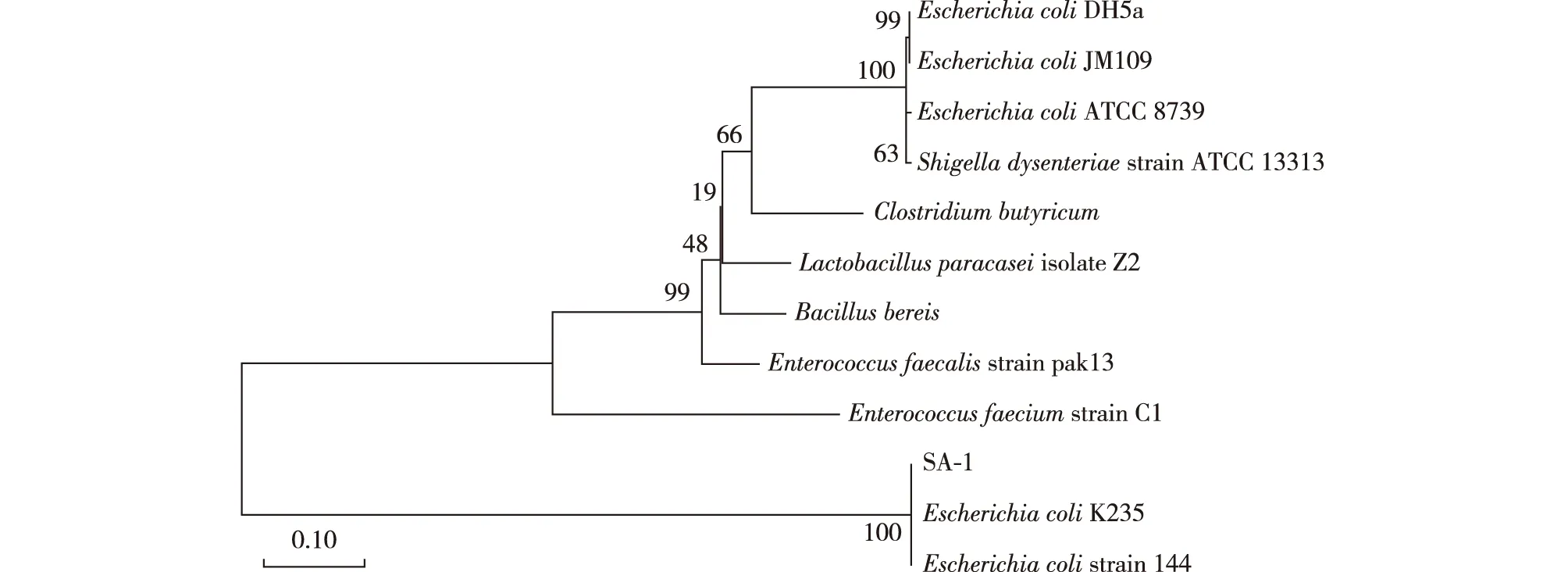
图2 菌体SA-1系统进化树Fig.2 Phylogenetic tree of strain SA-1
2.3 ARTP诱变结果
产唾液酸大肠杆菌ARTP诱变存活曲线如图3所示。
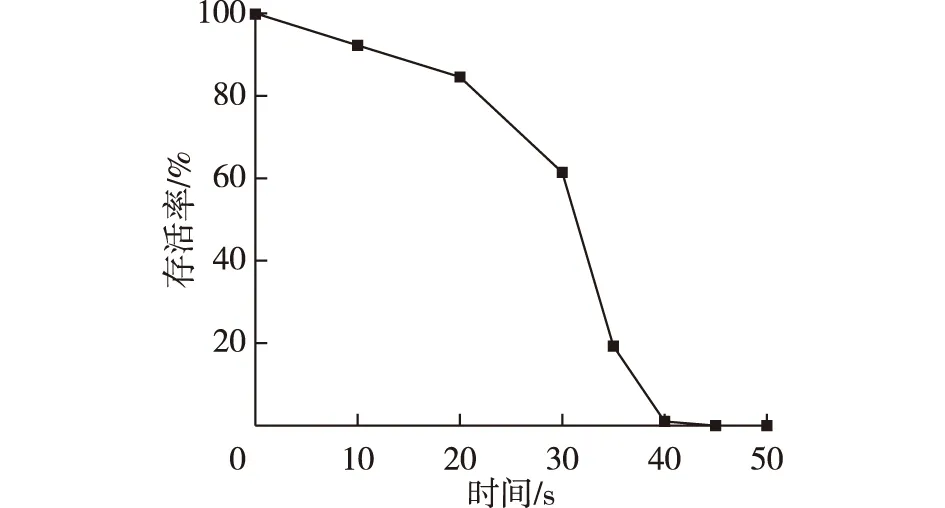
图3 E.coli SA-1的ARTP诱变存活曲线Fig.3 Survival curve of E.coli SA-1 by ARTP
由图3可知:在0~30 s时,随着照射时间的增加,存活率在逐步降低;照射时间≥40 s时存活率接近于0;而当照射时间为35 s时,存活率为19.20%,选取该照射时间下诱变的菌落进行培养。
2.4 高产菌株筛选
出发菌株SA-1通过ARTP诱变后,经溴甲酚紫鉴别培养基初筛,再通过摇瓶复筛,经过5轮筛选获得摇瓶发酵唾液酸产量最高的突变菌株SA-18,其摇瓶产量为0.95 g/L,是出发菌株产量(0.20 g/L)的4.75倍。
2.5 菌株遗传稳定性验证
为检测突变菌株E.coliSA-18产PSA的遗传稳定性,连续培养了8代,测定各代发酵参数,实验结果如表3所示。

表3 E.coli SA-18的遗传稳定性测试Table 3 Genetic stability test of E.coli SA-18
由表3可知:各代菌株发酵结束时的PSA产量在0.95 g/L左右,检测指标较为稳定,说明菌株SA-18具有良好的遗传稳定性。
2.6 高密度发酵过程中磷酸盐浓度优化
目前,聚唾液酸发酵生产过程通常都采用较高浓度磷酸盐和山梨醇为碳源的培养基,高质量浓度磷酸盐(20 g/L K2HPO4)可以有效提高PSA的产量和菌体浓度[14],但以山梨醇碳源进行发酵时,山梨醇并非速效碳源,导致细胞生长代谢较慢,发酵结束培养基中会积累大量的磷酸盐,磷酸盐在发酵体系中的另外一个重要作用就是作为缓冲体系,而SA的分离需要经过高浓度的酸来酸解,过高浓度的磷酸盐势必会大幅增加酸解过程酸的消耗,不利于SA的分离。本研究在10 L发酵罐中进行SA的高密度发酵,以葡萄糖为碳源,采用恒速补料的方式,发酵初始培养基不变,通过在补料培养基中分别添加0、2.5、5.0、7.5和10.0 g/L K2HPO4进行发酵,发酵结果如图4和5所示。
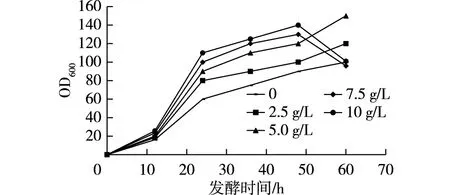
图4 磷酸盐用量对诱变菌株SA-18发酵过程细胞生长的影响Fig.4 Effects of phosphate concentrations on cell growth in the fermentation process of SA-18 mutated strain
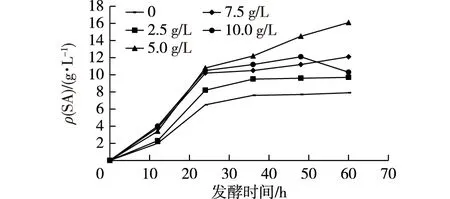
图5 K2HPO4用量对菌株SA-18产SA的影响Fig.5 Effects of different phosphate concentrations on SA in SA-18
由图4和5可知:补料培养基中K2HPO4用量为0、2.5 g/L时,菌体生长速率相对偏慢,最终唾液酸产量相较低;而当K2HPO4为7.5、10.0 g/L时,菌体前期生长迅猛,但发酵后期菌浓下降,即菌体自溶,后期SA合成速率也下降;当K2HPO4为5.0 g/L时,菌体生长稳定,最终SA产量也达到最高值16.10 g/L。
3 结论
为获得高产聚唾液酸的菌株,本研究首先从天然水体中获得样品,经鉴别培养基筛选到产唾液酸出发菌株SA-1。进一步通过优化最佳致死率等条件得到最佳诱变条件,出发菌株经ARTP等离子体诱变后获得大量突变株。借助全自动菌落挑选仪的颜色识别功能进行高通量自动化挑选高产唾液酸突变株,经过多轮筛选获得高产聚唾液酸大肠杆菌菌株SA-18(摇瓶水平达0.95 g/L)。在10 L发酵罐中,对突变菌株SA-18进行高密度发酵培养,优化补料培养基中的K2HPO4浓度,当K2HPO4用量为5.0 g/L时,此时SA产量达到16.10 g/L。

