基于网络药理学研究黄芪抗动脉粥样硬化的作用机制
王 超,张 咪,赵丽萍,范春雷
(浙江中医药大学生命科学学院,浙江 杭州 310053)
动脉粥样硬化是由多种因素引起的慢性炎症性疾病,同时也是冠心病、脑卒中、外周血管病等疾病的主要病理基础[1]。动脉粥样硬化的中医临床表现包含“中风”“眩晕”“健忘”“胸痹”等,从整体观进行辨证论治认为是本虚标实之症,本虚指气血阴阳的亏虚,标实指瘀、痰、热、毒等[2]。以本虚标实为病机,中医多采用祛瘀化痰、清热解毒、益气固本等治疗方法,安全性较高。
黄芪为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Bge.var.mongholicus (Bge.) Hsiao或膜荚黄芪A.membranaceus(Fisch.) Bge.的干燥根,具有益气升阳、利水消肿、固表止汗等功效,主要活性成分包括黄芪多糖、黄酮类、皂苷类以及生物碱类等,临床上常用于冠状动脉粥样硬化、病毒性心肌炎、肝炎、糖尿病等疾病的治疗[3]。研究表明,黄芪具有扩张血管、抗炎、抗肿瘤、增强机体免疫的作用,也常用于动脉粥样硬化患者的治疗[4]。
由于中药具有多成分、多靶点及多途径的特点,黄芪的活性成分抗动脉粥样硬化的作用机制尚不明确,而网络药理学能从构建“药物-靶点-疾病”关系网络的角度为中药分子作用机制的研究提供科学的方法。本研究利用网络药理学的方法,筛选出黄芪治疗动脉粥样硬化的潜在药效成分与作用靶点,并通过体外实验进行初步验证,以期为黄芪治疗动脉粥样硬化的基础研究与临床应用提供理论基础。
1 材料
1.1 细胞株 人脐静脉内皮细胞系(HUVECs),购于中国科学院上海生科院细胞资源中心。
1.2 试剂与药物 黄芪提取物(中药黄芪购自浙江中医药大学附属医院并经鉴定为正品,取200 g黄芪加水浸泡2 h,加热煮沸,过滤收集药液,再将残余药渣重新提取,合并2次滤液,通过旋转蒸发仪浓缩药液至含生药量1 g/L)。DMEM高糖培养基(美国Gibco公司,批号8117033);胎牛血清(杭州四季青生物工程材料研究所,批号19110503);胰蛋白酶(浙江吉诺生物医药技术有限公司,批号2019092902);四甲基偶氮唑蓝(MTT)(美国Ameresco公司,批号3068B512);二甲基亚砜(上海源叶生物科技有限公司,批号20170204);过氧化氢(美国Sigma公司,批号MKBN5879V);细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司,批号20170409);活性氧(ROS)、超氧化物歧化酶(SOD)检测试剂盒(上海碧云天生物技术有限公司,批号20180402、20180403);高灵敏度化学检测试剂盒、Trizon Reagen、UltraSYBR Mixture(High ROX)、RIPA裂解液(强)、去基因组cDNA第一链合成试剂盒、BCA蛋白浓度测定试剂盒(江苏康为世纪生物科技有限公司,批号30338、03878、40327、20152、01410、30334);引物均由生工生物工程(上海)股份有限公司合成;Bax、Bcl-2、IL-1β、TNF-ɑ、p38 MAPK、p-p38 MAPK单克隆抗体(武汉三鹰生物技术有限公司,批号201709、201710、201803、201805、201802、201804);β-actin抗体、羊抗兔二抗、羊抗鼠二抗(杭州达文生物有限公司,批号Q17892,J805472713、SG081018A)。
1.3 仪器 二氧化碳细胞培养箱(美国Thermo Fisher Scientific公司);Guava EasyCyte 8型微流式细胞分析仪(美国EMD Millipore公司);Q5000超微量紫外可见分光光度计(美国Quawell公司);Nikon研究级倒置生物显微镜Ti-S(日本Nikon公司);ABI实时荧光定量PCR仪(美国Applied Biosystems公司);低温高速离心机(德国Eppendorf公司);酶标仪(美国Molecular Devices公司);凝胶发光化学成像系统(上海勤翔科学仪器有限公司)。
2 资料与方法
2.1 黄芪有效成分的筛选 使用中药系统药理学平台(TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.php),以“huangqi”为关键词进行检索,筛选出黄芪化合物中符合口服生物利用度(OB)≥30%和生物活性分子的类药性(DL)≥0.18的化合物作为活性成分,并且根据相关文献报道进行补充。之后再检索出黄芪各个活性成分所相关的靶点,通过Uniprot数据库(https://www.uniprot.org/)查找其靶点对应的基因信息,并将其导出归纳整理。
2.2 疾病靶点筛选 通过OMIM数据库(http://www.ncbi.nlm.nih.gov/omim)和GeneCards数据库(http://www.genecards.org/)以“atherosclerosis”作为关键词进行检索并去除假阳性与重复基因后导出结果。再将获得的基因与黄芪潜在活性成分作用的基因通过Venny 2.1(http://bioinfogp.cnb.csic.es/tools/venny/index.html)进行比对取交集,并将相关结果导出。
2.3 药物-疾病网络模型的构建与分析 将黄芪的活性成分和动脉粥样硬化交集靶点等相关信息导入Cytoscape 3.7.1软件,构建黄芪-活性成分-动脉粥样硬化-作用靶点网络。通过String数据库(https://string-db.org/)分析动脉粥样硬化和黄芪活性成分之间的相互作用关系,设置最高置信度,标准为confidence>0.9,物种设置为“Homosapiens”,以网络中的各靶基因的“节点连接度(Degree)”为指标,通过 Degree的测算筛选出网络中的核心蛋白质靶标,从而获得蛋白质相互作用的关系。
2.4 GO功能富集分析和KEGG通路富集分析 通过DAVID数据库(https://david.ncifcrf.gov/)对筛选出的核心靶点进行GO功能富集分析和KEGG通路富集分析。将之前筛选出来的黄芪治疗动脉粥样硬化的靶点导入DAVID数据库之中,设定物种为“HomoSapiens”,将基因的名称核对为官方的名称,阈值设置为P<0.05后,进行GO生物学过程富集分析和KEGG代谢通路富集分析,并将前20个富集结果进行可视化。
2.5 细胞培养与增殖能力的检测 将复苏后的HUVECs细胞置于含10%胎牛血清的DEME培养基中培养,待细胞状态稳定后进行分组,设置正常组、模型组、加药组。将对数生长期的细胞以1×106/mL的密度接种于96孔板中,用不同浓度H2O2(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mmol/L)进行处理。通过MTT检测H2O2对HUVECs细胞增殖的影响;并且用不同剂量黄芪提取物(5、10、15、20、25、30、35、40、45、50 mg/L)对H2O2损伤后的HUVECs细胞进行处理,再通过MTT法检测黄芪提取物对受氧化应激损伤的HUVECs细胞增殖的影响。
2.6 流式细胞术检测细胞凋亡 取1×106个对数生长期的HUVECs细胞接种于6孔板中,分为空白组(不作处理)、模型组(0.9 mmol/L H2O2处理)、加药组(0.9 mmol/L H2O2处理后,再用30 mg/L黄芪提取物处理)。培养48 h后收集细胞,经PBS重悬后加入5 μL AnnexinⅤ-FITC和5 μL PI,室温避光孵育20 min,通过流式细胞仪检测细胞凋亡情况。
2.7 细胞中ROS水平及SOD活性的检测 从6孔板中收集各组正常培养的细胞,弃去原培养液,用无血清培养基洗涤3次后,各孔加入2 mL无血清培养基和20 μmol/L DCFH-DA,37 ℃避光孵育30 min后 PBS洗3遍,通过酶标仪检测各组细胞荧光的强弱,激发波长为488 nm,发射波长为525 nm,并在荧光共聚焦显微镜上,实时检测荧光强弱并拍照。根据试剂盒说明书操作步骤检测细胞中SOD活性。
2.8 RT-qPCR法检测相关基因表达 取处于对数生长期的各组细胞,消化细胞并收集,用Trizol法提取细胞的总RNA,使用反转录试剂盒将总RNA逆转录为cDNA,进行荧光定量PCR检测。以β-actin作为内参基因,引物序列见表1。

表1 引物序列
2.9 Western blot检测相关蛋白表达 离心收集各组细胞后加入细胞裂解液提取蛋白,并通过BCA法对蛋白进行定量,制备样品。将样品进行聚丙烯胺凝胶电泳(SDS-PAGE),使用相关抗体进行Western blot检测,通过凝胶成像仪进行显影观察。

3 结果
3.1 黄芪活性成分及作用靶点的筛选 以“huangqi”为检索词通过TCMSP数据库检索总共检索到87种化合物。以OB≥30%、DL≥0.18作为化合物筛选条件,共筛选得到20种化合物,之后通过文献补充黄芪皂苷类成分2种,所得数量占所有总化合物的25.29%,见表2。

表2 黄芪潜在有效成分的基本信息
3.2 疾病相关靶点及黄芪治疗动脉粥样硬化潜在靶点筛选结果 动脉粥样硬化的相关靶点基因在GeneCards数据库与OMIM数据库中进行检索,共得到3 736个靶点基因,将上述筛选出来的黄芪中具有潜在作用的靶点基因和动脉粥样硬化靶点基因进行匹配并在线绘制韦恩图(图1),获得共同靶点基因76个,见表3。

图1 黄芪潜在活性成分与动脉粥样硬化相关靶点韦恩图
3.3 黄芪-活性成分-靶点-疾病网络与PPI的构建与分析 通过Cytoscape 3.7.1软件构建黄芪-活性成分-动脉粥样硬化-靶点网络,结果显示,该网络由94个节点组成,其中活性成分节点16个,基因节点76个,疾病节点1个,药物节点1个,具有138条边(图2)。其中红色节点代表疾病;蓝色节点代表药物;紫色节点代表药物成分;绿色节点代表关键作用靶点。将黄芪-动脉粥样硬化共有的76个靶点基因导入String数据库平台,获得蛋白质相互作用关系网络图(图3),其中关联度值最高的前5个节点依次为IL6、CASP3、VEGFA、MAPK8、EGFR(图4),表明了这些基因可能是黄芪治疗动脉粥样硬化的潜在靶点。
3.3.1 GO功能富集分析 将黄芪-动脉粥样硬化共同靶点导入DAVID数据库中进行GO富集分析共得到96个条目,其中DNA结合转录激活因子活性、RNA聚合酶Ⅱ特异性涉及15个靶标;近端启动子序列特异性DNA结合涉及15个靶标;RNA聚合酶Ⅱ近端启动子序列特异性DNA结合涉及14个靶标,此外还与蛋白质异二聚化活性、染色质结合、泛素样蛋白连接酶结合、核受体活性等功能相关,见图5(展示了前20位的GO分析结果)。
表3 黄芪抗动脉粥样硬化的潜在靶点
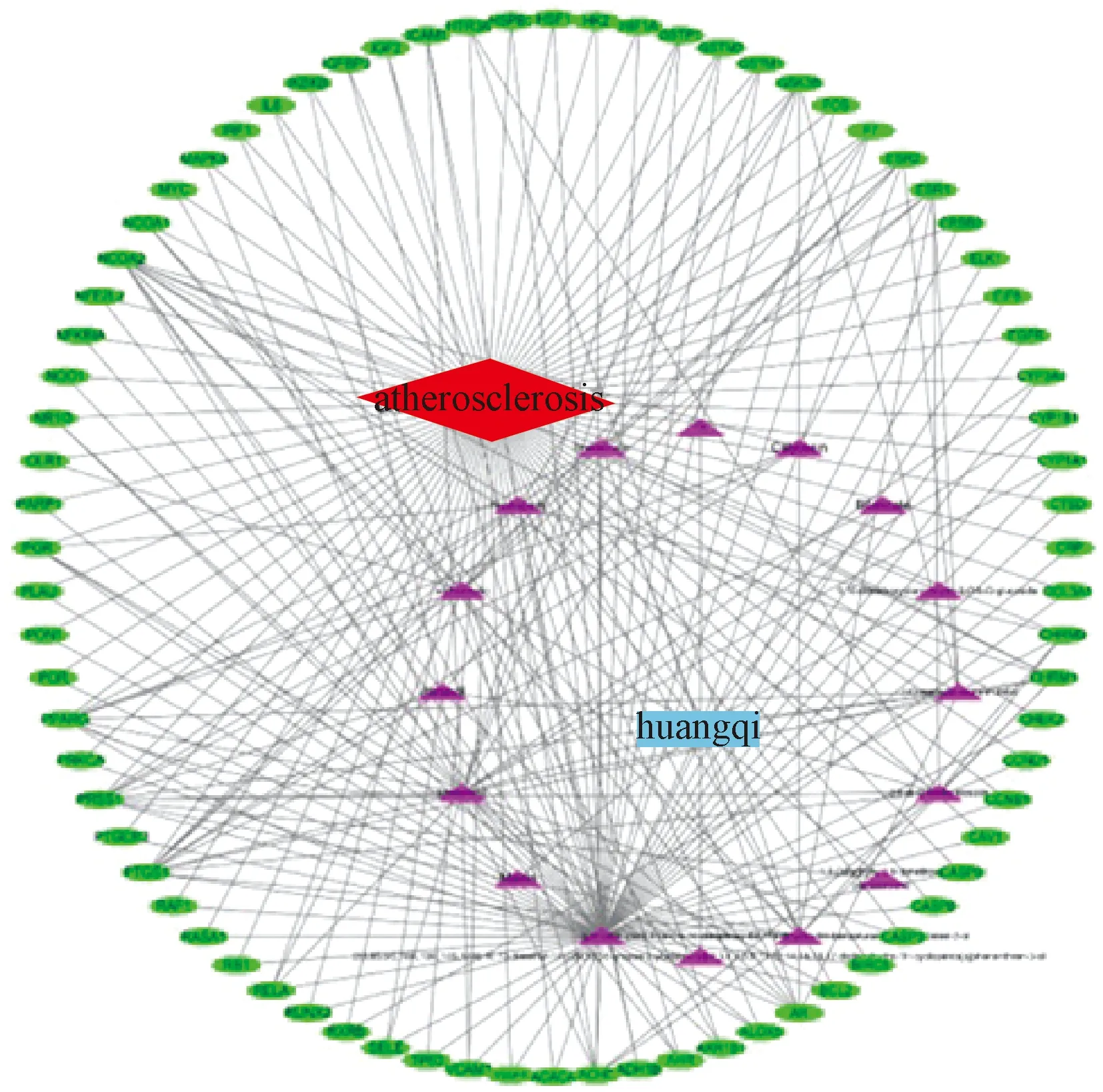
图2 黄芩“活性成分-靶点”网络图
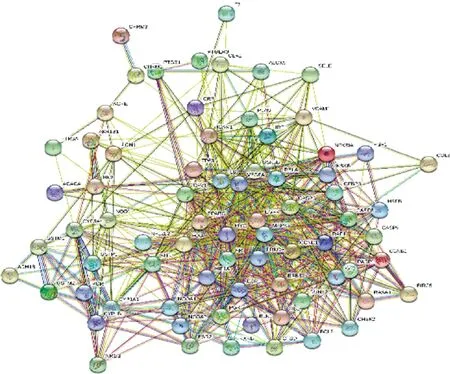
图3 黄芪与动脉粥样硬化蛋白质相互作用核心网络图
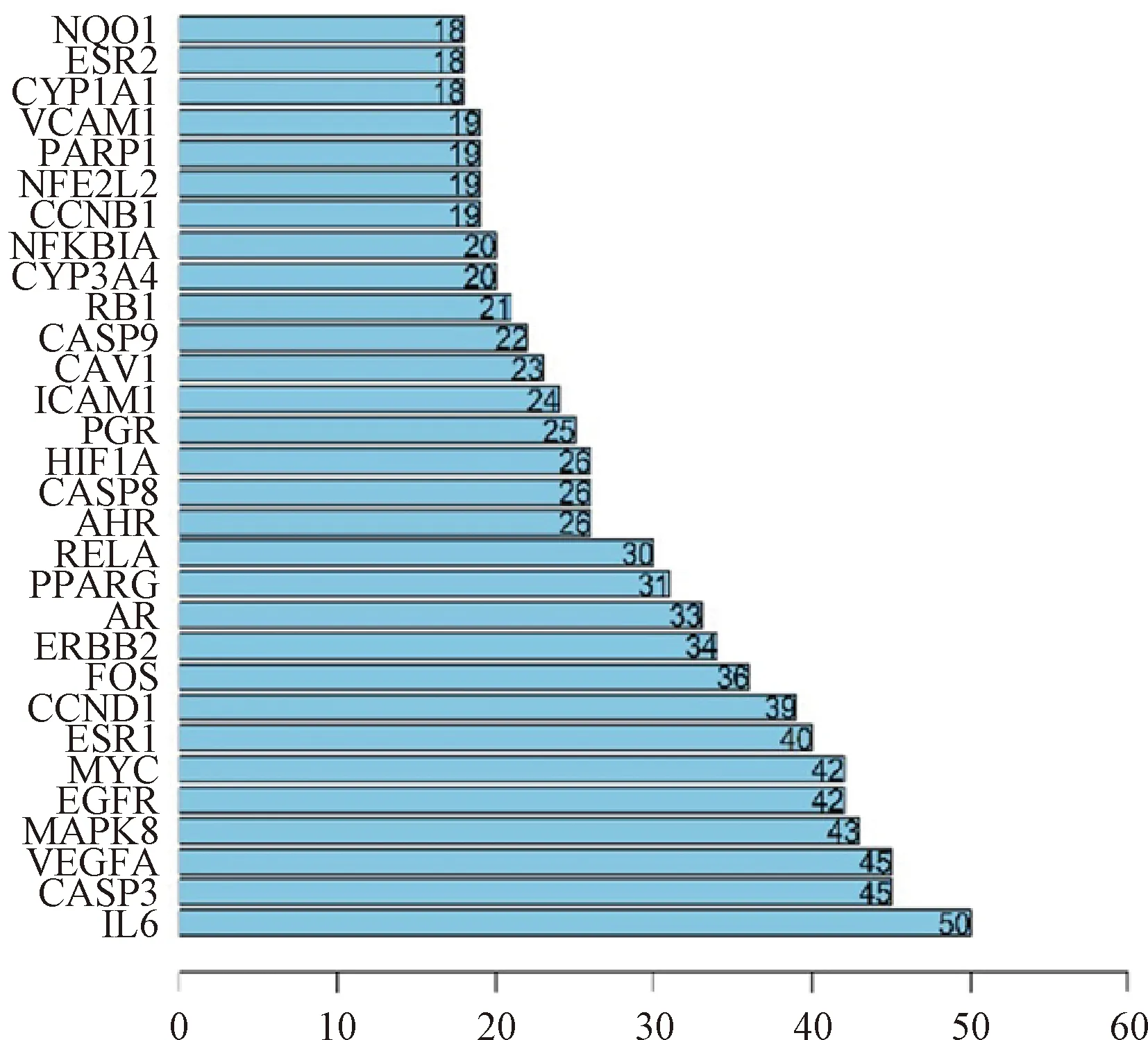
图4 黄芪治疗动脉粥样硬化的核心靶点
3.3.2 KEGG通路富集分析 黄芪抗动脉粥样硬化的KEGG富集分析结果显示靶点被富集在62条通路上,其中包括MAPK通路、PI3K/Akt通路、细胞凋亡通路、AGE-RAGE通路等,见图6(展示了前20位的KEGG分析结果)。参与MAPK信号通路的核心靶点有RELA、IKBKB、CASP3、MAPK8、EGFR、VEGFA、FOS、ELK1、RAF1、PRKCA、ERBB2、MYC、HSPB1、IGF2、RASA1,是含有核心靶点最多的信号通路,见图7。
3.4 黄芪提取物对H2O2诱导的HUVECs细胞增殖的影响 如图8A所示,当细胞经0~1 mmol/L浓度的H2O2处理后,细胞存活率随着H2O2浓度升高而逐渐下降,当H2O2浓度为0.9 mmol/L,细胞存活率为62.5%;H2O2浓度为1 mmol/L时,细胞存活率低于40%,不利于后续的实验,所以选择浓度为0.9 mmol/L的H2O2处理做为造模条件。如图8B所示,黄芪提取物在0~30 mg/L的剂量范围内,随着黄芪提取物剂量的升高细胞增殖率也升高,在30 mg/L时细胞增殖率最高;但当剂量超过30 mg/L时,增殖能力开始逐渐下降,当剂量达到50 mg/L时,细胞的增殖已无明显变化,故选用30 mg/L的黄芪提取物进行后续的研究。

图5 黄芪-动脉粥样硬化关键靶点的GO生物学过程富集分析

图6 黄芪-动脉粥样硬化关键靶点的KEGG代谢通路富集分析

图7 MAPK信号通路
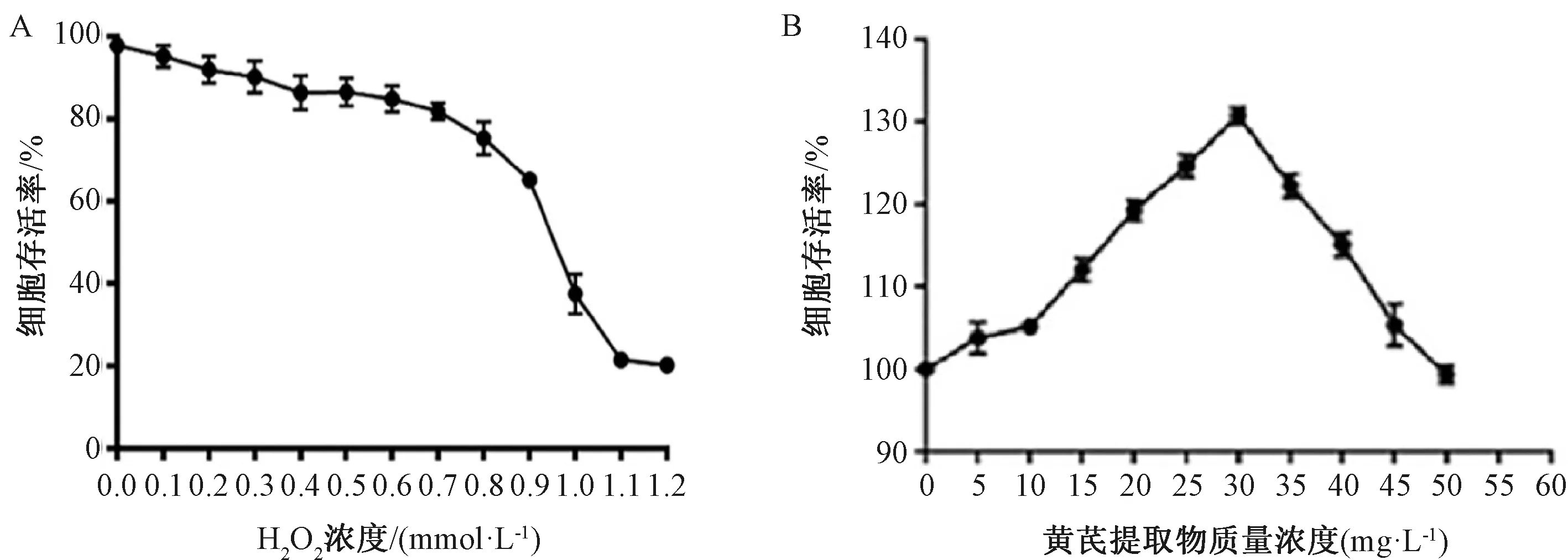
图8 黄芪提取物对HUVECs细胞的影响
3.5 流式细胞术检测细胞凋亡率 如图9所示,与空白组比较,模型组HUVECs细胞的凋亡率升高(P<0.01);与模型组比较,加药组细胞凋亡率降低(P<0.01)。
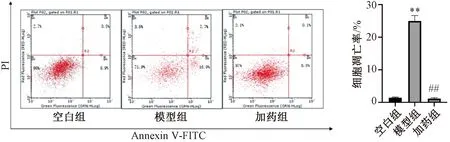
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01。图9 各组细胞凋亡率

注:与空白组比较,*P<0.05,与模型组比较,#P<0.05。图10 各组细胞中ROS水平
3.6 黄芪提取物对H2O2诱导的HUVECs细胞中ROS水平及SOD活性的影响 如图10所示,与空白组比较,模型组细胞荧光强度增强,表明细胞中ROS水平升高(P<0.05);与模型组比较,加药组细胞荧光强度减弱,表明加药组ROS水平受到抑制(P<0.05)。如图11所示,与空白组比较,模型组细胞中SOD活性降低(P<0.05);与模型组比较,加药组细胞SOD活性升高(P<0.05)。

注:与空白组比较,*P<0.05,与模型组比较,#P<0.05。图11 各组细胞中SOD活性
3.7 黄芪提取物对H2O2诱导的HUVECs细胞中p38MAPK、IL-1β、TNF-αmRNA表达的影响 与空白组比较,模型组细胞p38MAPK、IL-1β、TNF-αmRNA表达均升高(P<0.05);与模型组比较,加药组细胞p38MAPK、IL-1β、TNF-αmRNA表达均降低(P<0.01),见图12。
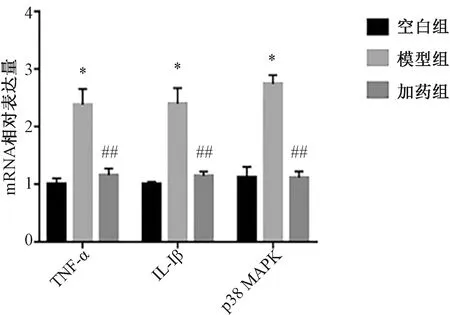
注:与空白组比较,*P<0.05,与模型组比较,##P<0.01。图12 各组细胞中p38 MAPK、IL-1β、TNF-ɑ mRNA表达
3.8 黄芪提取物对H2O2诱导的HUVECs细胞中p38-MAPK、IL-1β、TNF-ɑ蛋白表达的影响 如图13所示,与空白组比较,模型组细胞中Bcl-2蛋白表达降低(P<0.05),而Bax、IL-1β、TNF-ɑ、p38 MAPK和p-p38 MAPK蛋白表达均升高(P<0.05);与模型组比较较,加药组细胞中Bcl-2蛋白表达升高(P<0.01),IL-1β、Bax、TNF-ɑ、p38 MAPK和p-p38 MAPK蛋白表达均降低(P<0.01)。
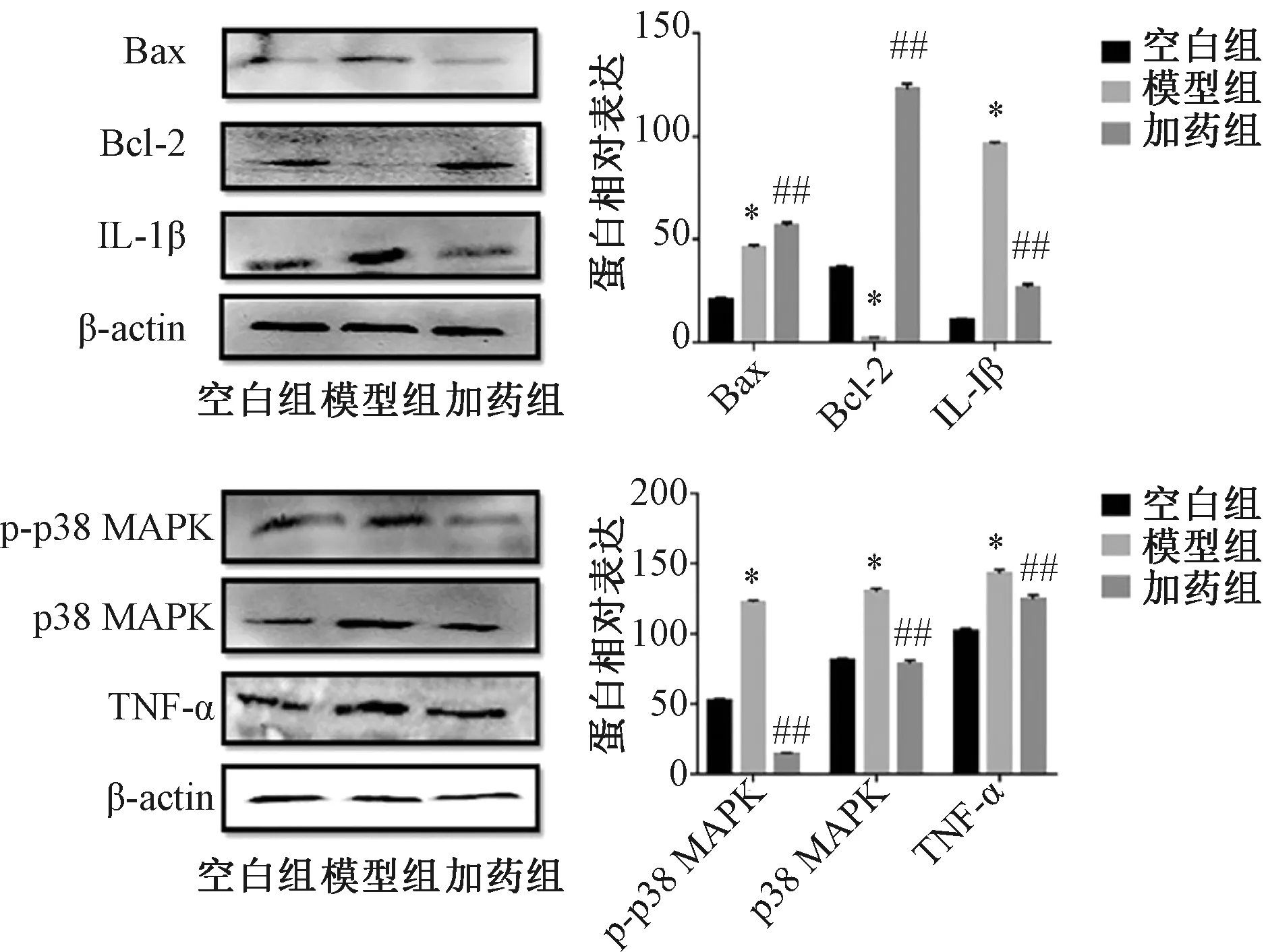
注:与空白组比较,*P<0.05,与模型组比较,##P<0.01。图13 各组细胞中p38-MAPK、IL-1β和TNF-ɑ蛋白表达
4 讨论
动脉粥样硬化作为心脑血管疾病的重要病理基础,其发生发展过程始终是基础和临床研究的重点,目前的研究认为动脉粥样硬化与内皮细胞损伤、脂质紊乱、免疫应答和与其相关的慢性炎症有紧密的联系[5]。中医对动脉粥样硬化的认识多为本虚标实之症,提出的血瘀、热毒和痰浊等病理因素与血栓形成、炎症以及脂质浸润等学说一一对应,因此通过活血化瘀、化痰以及清热解毒等方法来抑制血栓形成、调节血脂以及抗炎[6]。黄芪的药效甚多,常用于不同的疾病治疗中,但其根本还是“益气”的功效,因此黄芪常被用于治疗动脉粥样硬化性疾病。由于中药的活性成分众多、作用靶点与机制尚不完全明确,缺乏系统性和严谨性的研究,随着系统生物学的发展,基于大数据的网络药理学已成为分析中药复杂成分作用机制的重要方法[7]。
本研究利用网络药理学方法筛选出了黄芪的22种潜在活性成分,并与动脉粥样硬化相关靶点进行比对,得到了76个共有的靶点基因,结果表明IL-6、CASP3、VEGFA、MAPK8、EGFR等基因可能是黄芪抗动脉粥样硬化的主要作用靶点。已有相关文献表明,IL-6作为炎症细胞因子参与机体的炎症反应,其水平升高可促进血管内皮细胞及平滑肌细胞发生变性、坏死进而导致动脉粥样硬化形成、粥样斑块破裂甚至血栓形成[8];CASP3在细胞凋亡过程中起重要作用,当细胞的线粒体膜受到损伤,细胞色素会释放到细胞外进而激活CASP3诱导细胞凋亡[9];VEGFA与EGFR对于血管中内皮细胞的增殖、迁移及分化等具有重要作用[10];MAPK8参与细胞增殖、凋亡、应激以及炎症反应等过程[11]。由此推测,黄芪抗动脉粥样硬化的作用机制与细胞凋亡过程相关。GO功能富集分析结果显示黄芪与动脉粥样硬化的作用机制涉及多种代谢过程和细胞进程,多种生物分子参与其中共同调控复杂的代谢网络,体现出中药多种成分通过多种途径作用于多靶点的特点。通过KEGG通路富集结果可知,MAPK、PI3K/Akt、细胞凋亡等通路是黄芪抗动脉粥样硬化的重要途径,特别是MAPK通路与黄芪拥有最多的共同靶点,它能将细胞外的信号与细胞及细胞核之间的反应信息进行传递,从而参与到细胞的增殖、分化、凋亡以及自噬等生物过程,同时也参与了炎症、肿瘤等疾病的发生[12],因此本研究以MAPK通路作为目标验证其与黄芪提取物的相互作用,从而分析网络药理学结果的可行性。
研究表明,内皮细胞的损伤和功能失调常为动脉粥样硬化发生的最初环节,之后损伤组织会释放炎症介质和凝血酶因子等作用于炎症细胞产生炎症反应并激活纤维蛋白原与血小板,进而产生血栓炎症反应[13]。p38 MAPK作为MAPK家族中极为重要的一部分,主要参与炎症调控的过程[14],并且与氧化损伤过程具有紧密联系。本实验以0.9 mmol/L浓度的H2O2处理细胞来建立氧化损伤模型从而模拟动脉粥样硬化的最初发生进程,并使用黄芪提取物进行干预。结果显示黄芪提取物处理后的细胞ROS水平降低,SOD活性升高,细胞凋亡率也降低,说明黄芪提取物具有抗氧化的作用,同时能够抑制氧化损伤细胞的凋亡水平。RT-qPCR和Western blot实验结果表明,与模型组比较,黄芪提取物处理后的细胞中p38 MAPK、p-p38 MAPK、IL-1β、TNF-α mRNA和蛋白表达均降低,说明黄芪提取物能够作用p38 MAPK途径并且调控相关基因的表达,明确黄芪提取物参与了炎症的进程,有利于后续更加深入的研究。Bao等[15]研究结果表明p38 MAPK被激活后能够通过磷酸化或促进炎症因子(如TNF-α、IL-1)活化NF-κB,而NF-κB被激活后也可以通过其产物反过来激活自身和p38 MAPK表达,形成复杂的相互激活网络,从而参与动脉粥样硬化的进程。这与本研究结果一致,说明黄芪提取物可能通过抑制p38 MAPK/ TNF-α/IL-1途径相关基因的转录与蛋白表达来调控炎症反应过程,进而影响动脉粥样硬化的发生与发展。
综上所述,本研究通过网络药理学对黄芪治疗动脉粥样硬化的药效成分、作用靶点及通路进行了分析,预测了黄芪抗动脉粥样硬化的基因靶点与作用通路,并通过细胞实验初步证实了黄芪提取物通过MAPK通路抑制受氧化应激损伤细胞的凋亡、降低细胞中的ROS水平以及下调炎症因子的表达,进而影响动脉粥样硬化的发生发展。实验结果显示了黄芪可以通过多成分、多靶点、多通路抗动脉粥样硬化的特点,初步验证的结果则表明了网络药理预测的可行性,为黄芪抗动脉粥样硬化的深入研究提供依据。

