膈下逐瘀汤对四氯化碳诱导的肝纤维化大鼠Wnt/β-catenin 通路的影响
孙旭熊芬黄育生闫雪蔡庆群丘振文*
(1.广州中医药大学第一附属医院,广东广州510405; 2.广州中医药大学岭南医学研究中心,广东 广州510405)
肝纤维化是肝脏受到病毒、酒精、药物等生物、化学或免疫因素损伤后进行组织修复的病理生理过程,其本质是肝星状细胞激活后导致的细胞外基质大量聚集[1-2]。若肝纤维化没有得到逆转或改善则会进一步发展为肝硬化,据统计每年死于肝硬化的人数达到100万[3]。肝纤维化存在逆转可能,因此,开展肝纤维化治疗具有重要意义。
Wnt 信号通路是调控细胞生长与分化的重要信号通路,其异常表达与纤维化疾病紧密关联。当Wnt 信号通路被激活后,异常表达的Wnt 蛋白参与肝内炎症、脂代谢、氧化应激等反应,导致酒精性脂肪肝、肝纤维化等慢性肝病的发生[4]。具有活血化瘀作用的丹参、红景天、龙血竭等能抑制Wnt/β-catenin 信号通路的异常激活,起到抗肝纤维化的作用[5-7]。
膈下逐瘀汤出自《医林改错》,具有活血逐瘀、破症消结之功效,主治积聚痞块、痛不移处、卧则腹坠、肾泻、久泻由瘀血所致者[8]。中医认为肝纤维化多由湿热阻滞、肝气郁滞而致脉道不通、瘀血阻络所致,属本虚标实之证,本虚以脾气虚弱和肝肾阴虚为主,“因虚致积”可促使疾病进一步发展为肝硬化或肝癌,标实以水停、血瘀为主[9]。因此,本研究通过膈下逐瘀汤对肝纤维化大鼠Wnt/β-catenin 通路的调控作用,阐明膈下逐瘀汤对肝纤维化的治疗作用,以期指导临床应用。
1 材料
1.1 动物 清洁级健康成年雄性SD 大鼠48只,鼠龄8~12周,体质量(200±20)g,由广东省医学实验动物中心提供,实验动物使用许可证号SYXK(粤)2018-0092,饲养于广东药科大学实验动物中心,实验室温度24~25 ℃,相对湿度50%~60%。标准饲料、饮用水由广东药科大学动物实验中心提供,高脂低蛋白饲料配方为在79.5%标准饲料基础上添加20% 猪油和0.5% 胆固醇,适应性饲养1 周。
1.2 试剂与药物 膈下逐瘀汤由五灵脂6 g、当归9 g、川芎6 g、桃仁9 g、牡丹皮6 g、赤芍6 g、乌药6 g、延胡索3 g、甘草9 g、香附5 g、红花9 g、枳壳5 g 组成,饮片购自广州中医药大学第一附属医院,经广州中医药大学第一附属医院副主任中药师黄光荣鉴定为正品,将上述饮片按比例加入10 倍量水煎煮,过滤,滤液浓缩至含生药量1.58 g/mL,4 ℃保存备用。秋水仙碱片(西双版纳药业有限责任公司,批号H53021369),溶于蒸馏水,配制成质量浓度为11 mg/L;CCl4(分析纯,天津市大茂化学试剂厂,批号5623-5);花生油(山东鲁花集团有限公司,批号Q/LLH0015S);HE 染色试剂盒(武汉赛维尔生物科技有限公司,批号G1005);天门冬氨酸氨基转移酶(AST)试剂盒、丙氨酸氨基转移酶(ALT)试剂盒、透明质酸(HA)试剂盒、层黏蛋白(LN)试剂盒、Ⅲ型前胶原(PCⅢ)试剂盒、Ⅳ型胶原(CⅣ)试剂盒(南京建成生物工程研究所,批号20190518、20190409、20190814、20190730、20190916、20191011);TRIzol 试剂(美国Sigma 公司,批号187022024);RNA 提取试剂盒(上海捷瑞生物工程有限公司,批号GK4175);实时荧光定量PCR 扩增试剂盒(日本TaKaRa 公司,批号ST728A);磷酸酶抑制剂[生工生物工程(上海)股份有限公司,批号B546021-0250];蛋白酶抑制剂[安诺伦(北京)生物科技有限公司,批号HY-K0010];SDS-PAGE 蛋白上样缓冲液、DAB 显色试剂盒(上海碧云天生物技术有限公司,批号ST627、ST627);Wnt-1、β-catenin、p-GSK3β、GSK3β 抗体(美国Affinity 公司,批号AF2115、AF6266、AF2016、AF2017);GAPDH抗体、山羊抗兔HRP 标记二抗、ECL 试剂盒(杭州弗德生物科技有限公司,批号FD0063、FDR007、P0023A);BCA试剂盒(美国Thermo Scientific 公司,批号VK314219);PVDF 膜(美国Millipore 公司,批号402190QR)。
1.3 仪器 -80 ℃超低温冰箱(美国Sigma 公司);高速低温离心机(美国Thermo Scientific 公司);组织研磨仪(上海净信实业发展有限公司);脱水机(意大利Diapath公司);包埋机(武汉俊杰电子有限公司);病理切片机(德国Leica 公司);TBA-2000FR 全自动生化分析仪(日本东芝公司);病理切片扫描仪(匈牙利3D-histech 公司);垂直电泳槽、转移电泳槽、MicroCL17R 实时荧光定量PCR仪(美国Bio-Rad 公司);电泳仪(北京百晶生物技术有限公司);SK-L180-E 摇床(美国Scilogex 公司);电子天平[奥豪斯仪器(上海)有限公司];化学发光显影仪(北京赛智创业科技有限公司)。
2 方法
2.1 分组与造模 48 只大鼠按随机数字表法分为正常组、模型组、秋水仙碱组、膈下逐瘀汤组,每组12 只。参考文献[10]报道,以CCl4诱导制备肝纤维化模型。造模组大鼠于第1 天腹腔注射含40%CCl4花生油3 mL/kg,之后每3 d腹腔注射2 mL/kg,连续8周,正常组大鼠腹腔注射等体积花生油。首次注射后第2 天开始给药,膈下逐瘀汤组大鼠灌胃给予药液7.29 g/kg[11],秋水仙碱组大鼠灌胃给予秋水仙碱混悬液0.11 mg/kg,正常组和模型组大鼠灌胃给予生理盐水10 mL/kg,每天1次,每3 d 称定体质量1次以调整药量,共8周,末次给药后,禁食不禁水12 h 后腹腔注射6%水合氯醛7 mL/kg 麻醉取材。
2.2 行为学评价 每天观察并记录大鼠的精神状况、饮食及活动、毛发光泽度等一般情况。
2.3 肝脏指数评价 大鼠麻醉后,开腹摘取肝脏,观察肝脏形态并称定质量,计算脏器指数。
2.4 肝组织病理学观察 将约1 cm×1 cm 大小的肝组织置于4%多聚甲醛浸泡72 h,依次进行梯度乙醇脱水,石蜡包埋,切片(厚度3 μm),脱蜡,行苏木精-伊红(HE)染色,于显微镜下进行组织形态学观察。
2.5 生化法检测血清ALT、AST、HA、LN、PCⅢ、CⅣ水平 腹主动脉取血,4 ℃静置4 h,3 000 r/min 离心15 min,分离血清,严格按照相应试剂盒说明书操作,检测大鼠血清中ALT、AST、HA、LN、PCⅢ、CⅣ水平。
2.6 RT-qPCR 法检测肝组织中Wnt-1、β-catenin、GSK-3βmRNA 表达 采用TRIzol 试剂提取肝组织总RNA。按照逆转录试剂盒的操作说明书将提取的总RNA 逆转录成cDNA,采用SYBR Green 进行两步法实时荧光定量PCR 反应,以GAPDH作为内参。每个样品重复3次,以2-ΔΔCT分析计算各组mRNA 表达情况。引物序列均由生工生物工程(上海)股份有限公司设计并合成,引物序列见表1。

表1 引物序列
2.7 Western blot 法检测肝组织Wnt-1、β-catenin、GSK3β、p-GSK3β 蛋白表达 剪取肝组织约30 mg 于玻璃匀浆器中,加入400 μL RIPA 裂解液和100×磷酸酶抑制剂和蛋白酶抑制剂,冰上充分研磨,将匀浆液于4 ℃条件下12 000 r/min离心15 min,取上清液采用BCA 蛋白浓度测定试剂盒对肝组织蛋白进行定量分析后,按照4∶1 的比例加入上样缓冲液(5×),沸水浴15 min 使蛋白变性,制作10%分离胶与5%浓缩胶,蛋白上样,SDS-PAGE 凝胶电泳分离蛋白,在低温条件下,恒流300 mA,60 min 转至PVDF膜,5%脱脂牛奶室温封闭PVDF 膜2 h,TBST 洗涤3次,加入一抗孵育过夜,TBST 漂洗3次,每次5 min;二抗稀释后室温孵育30 min,TBST 漂洗3次,每次5 min。以GAPDH 为内参,ECL 试剂盒显影成像,利用GelAnalyze 对蛋白条带进行图像分析,记录灰度值,通过计算目的条带与内参的灰度值比值来分析Wnt-1、β-catenin、GSK-3β、p-GSK-3β 蛋白表达。
2.8 统计学分析 通过SPSS 22.0 软件进行处理,数据以()表示,采用GraphPad Prism 9 软件进行方差分析和作图,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 膈下逐瘀汤对肝纤维化大鼠一般形态、肝脏形态和肝脏指数的影响 正常组大鼠精神状态良好、活泼好动、皮毛洁白光泽;模型组大鼠行动迟缓,毛发枯乱、偏黄,死亡1 只;秋水仙碱组和膈下逐瘀汤组大鼠精神状态良好,行动较正常组迟缓,毛发黯淡无光泽,秋水仙碱组死亡1只,见图1。

图1 膈下逐瘀汤对肝纤维化大鼠行为、形态的影响
正常组大鼠肝脏组织呈鲜亮的红褐色,大小适中,无肿大,质地触及柔软光滑且富有弹性,组织边缘完整无钝感;模型组大鼠肝脏组织呈现出肿胀状态,颜色呈土黄色或灰黄色,黯淡无光泽,触之质地油腻、粗糙不平、无弹性且有颗粒感,组织边缘变钝且显韧硬;膈下逐瘀汤组和秋水仙碱组大鼠肝脏组织质地、色泽介于正常组和模型组之间,无正常组大鼠肝组织颜色鲜亮且光滑,但较模型组大鼠肝脏组织边缘整齐,肝脏组织的整体状态接近正常组,见图2。
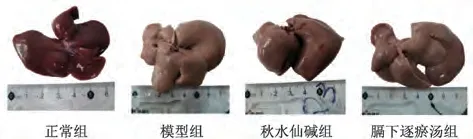
图2 膈下逐瘀汤对肝纤维化大鼠肝脏形态的影响
与正常组比较,模型组大鼠肝脏指数升高(P<0.01);与模型组比较,膈下逐瘀汤组和秋水仙碱组大鼠肝脏指数无统计学意义(P>0.05),见图3。
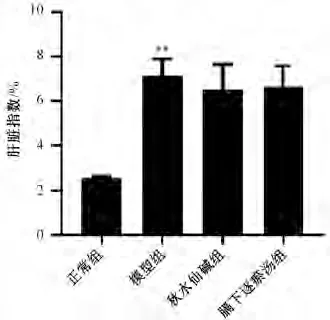
图3 膈下逐瘀汤对大鼠肝脏指数的影响(, n=9)
3.2 膈下逐瘀汤对肝纤维化大鼠肝脏组织病理变化的影响 正常组大鼠肝脏内小叶结构清晰、肝细胞排列整齐;模型组大鼠肝脏内小叶结构破坏、可见大量脂滴、炎症浸润和坏死细胞,汇管区纤维结缔组织增生;膈下逐瘀汤组和秋水仙碱组大鼠可见胶原纤维增生和炎性细胞减少,纤维间隔薄且仅分布于汇管区周围,阳性染色面积降低,见图4。
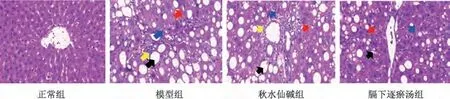
图4 膈下逐瘀汤对大鼠肝脏组织病理学的影响
3.3 膈下逐瘀汤对肝纤维化大鼠血清中ALT、AST 活性的影响 与正常组比较,模型组大鼠血清中ALT、AST 活性升高(P<0.01);与模型组比较,秋水仙碱组和膈下逐瘀汤组大鼠血清中ALT、AST 活性降低(P<0.05,P<0.01),见图5。
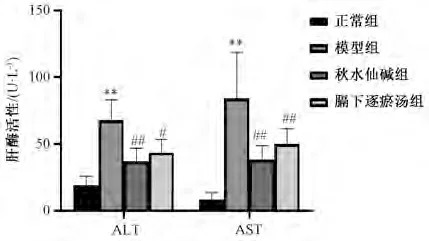
图5 膈下逐瘀汤对大鼠血清ALT 和AST 活性的影响(, n=9)
3.4 膈下逐瘀汤对肝纤维化大鼠血清中HA、LN、PCⅢ、CⅣ水平的影响 与正常组比较,模型组大鼠血清中HA、LN、PCⅢ、CⅣ水平升高(P<0.01);与模型组比较,秋水仙碱组和膈下逐瘀汤组大鼠血清中HA、LN、PCⅢ、CⅣ水平降低(P<0.01),见图6。

图6 膈下逐瘀汤对大鼠血清中HA、LN、PCⅢ、CⅣ水平的影响(, n=5)
3.5 膈下逐瘀汤对肝纤维化大鼠肝组织中Wnt-1、βcatenin、GSK-3βmRNA 表达的影响 与正常组比较,模型组大鼠肝组织中Wnt-1、β-cateninmRNA 表达升高(P<0.01),GSK-3βmRNA 表达降低(P<0.05);与模型组比较,秋水仙碱组和膈下逐瘀汤组大鼠肝组织中Wnt-1、β-cateninmRNA 表达降低(P<0.01),GSK-3βmRNA 表达升高(P<0.01),见图7。
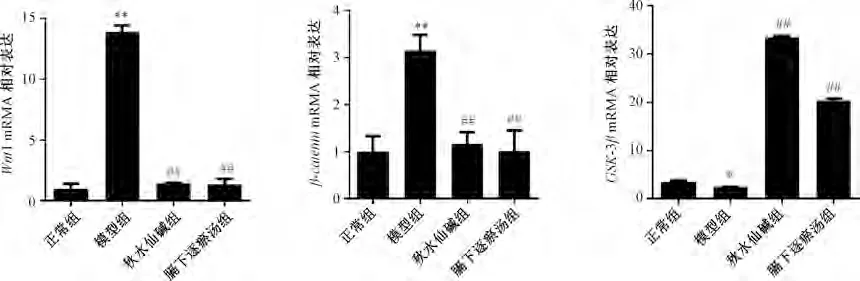
图7 膈下逐瘀汤对大鼠肝组织Wnt-1、β-catenin、 GSK-3β mRNA 表达的影响(, n=5)
3.6 膈下逐瘀汤对肝纤维化大鼠肝组织中Wnt-1、βcatenin、GSK-3β、p-GSK-3β 蛋白表达的影响 与正常组比较,模型组大鼠肝组织中Wnt-1、β-catenin、p-GSK-3β/GSK-3β 蛋白表达升高(P<0.01),GSK-3β 蛋白表达降低(P<0.05);与模型组比较,膈下逐瘀汤组大鼠肝组织中Wnt-1、β-catenin、p-GSK-3β/GSK-3β 蛋白表达降低(P<0.01,P<0.05),GSK-3β 蛋白表达升高(P<0.05),见图8~9。
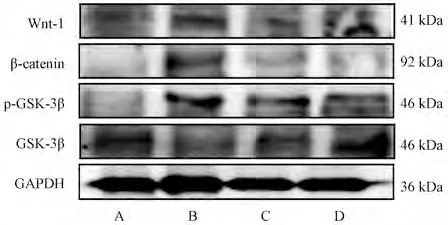
图8 各组大鼠肝组织中Wnt-1、β-catenin、p-GSK-3β、GSK-3β 蛋白表达
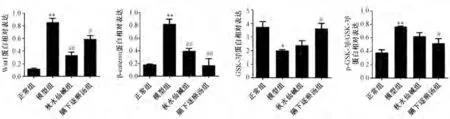
图9 膈下逐瘀汤对大鼠肝组织中Wnt-1、β-catenin、GSK-3β、p-GSK-3β/GSK-3β 蛋白表达的影响(, n=5)
4 讨论
肝纤维化是慢性肝病进展至肝硬化、肝癌的中心环节,中医将其归于“肝著”“臌胀”“积聚”“黄疸”等范畴[9,12]。现今尚无抗肝纤维化的有效药物,部分西药如秋水仙碱等,因不良反应大在临床难以推广。中医认为,纤维化病机为湿热疫毒内蕴,气滞瘀血阻络,治法以活血化瘀、疏肝解郁、养血柔肝为主[13]。
膈下逐瘀汤由五灵脂、当归、川芎、桃仁、牡丹皮、赤芍、乌药、延胡索、甘草、香附、红花、枳壳组成,具有改善微循环、抑制炎症的作用,主治腹部瘀血积块等病证,与肝纤维化发病机制和部位相符[14]。本研究发现,膈下逐瘀汤能降低肝纤维化大鼠血清中ALT、AST、HA、LN、PCⅢ、CⅣ水平,减少坏死细胞和炎性浸润,对肝纤维化大鼠具有保护作用。
Wnt/β-catenin 通路广泛参与细胞分化、组织修复等过程,在正常状态下处于低表达或沉默状态,当发生纤维化和肿瘤时,可被异常激活出现高表达[15-17]。β-catenin 为多功能蛋白,可介导信号转导和细胞黏附[18]。当Wnt 相关配体与细胞膜上Frizzled 受体结合后,通路被异常激活,细胞质中GSK-3β 发生磷酸化,导致β-catenin 在细胞质中积累并转移至细胞核并激活下游靶基因。抑制β-catenin 高表达,阻断Wnt/β-catenin 通路,抑制肝星状细胞增殖和活化,进而延缓肝纤维化发生[19-22]。
目前,膈下逐瘀汤对肝纤维化的探索除了集中在临床研究[23-24],对于临床前动物研究也在不断深入,如赵海军等[25]发现,膈下逐瘀汤能降低CCl4所致肝纤维化大鼠血清中ALT、AST、LN、HA 水平,升高血清蛋白和总蛋白表达,这与本研究部分结果一致。此外,膈下逐瘀汤可降低转化生长因子-β1 和α-平滑肌肌动蛋白等致纤维化因子水平,下调缺氧诱导因子-1α 及血管内皮细胞生长因子,改善血管新生[26-27];在信号通路方面,杨婧等[28-29]发现,膈下逐瘀汤可活化Akt-Nrf2 通路增强大鼠肝脏谷胱甘肽和硫氧还蛋白系统,减轻组织氧化应激,延缓纤维化进展。本研究在已证实膈下逐瘀汤对肝纤维化有积极治疗作用的前提下,首次探索了膈下逐瘀汤通过Wnt/β-catenin 通路干预肝纤维化的可能性。结果显示,Wnt-1、β-catenin 在肝纤维化大鼠肝组织中表达升高,膈下逐瘀汤可下调Wnt-1、βcatenin、p-GSK-3β/GSK-3β 蛋白表达,上调GSK-3β mRNA及蛋白表达。
综上所述,Wnt/β-catenin 通路在肝纤维化大鼠肝脏组织中存在异常激活现象,膈下逐瘀汤可通过抑制GSK-3β 磷酸化,促进β-catenin 降解,减少β-catenin 在细胞内积聚,进而阻断Wnt/β-catenin 通路激活。本研究证实了Wnt/βcatenin 通路与肝纤维化的相关性,进一步探究了膈下逐瘀汤改善肝纤维化的潜在机制,为抗肝纤维化研究提供了新的思路和方向。

