速效救心丸经ALKBH5/m6A调控自噬减轻缺氧/复氧心肌细胞损伤
王可妍,高俊杰,林文勇,王 丹,张春伶,牛振超,李益萍*,王肖龙*
(1.上海中医药大学附属曙光医院,国家中医心血管病临床医学研究中心分中心,上海 201203;2.上海中医药大学附属曙光医院心血管病研究所,上海 201203)
急性心肌梗死是发病率和死亡率很高的主要心血管疾病之一,其干预的最佳治疗手段是再灌注治疗。然而,在再灌注过程中会导致额外的心肌损伤,即心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury,MIRI)[1-3]。治疗MIRI的方法主要有机械性物理疗法(低温疗法、远隔缺血后适应等)及药物治疗(心房利钠肽、环孢霉素A等),然而临床试验并未证实其确切疗效[4-6]。因此,MIRI成为研究的热点和难点。
MIRI发病机制复杂,自噬在其病理过程中发挥重要作用[7]。N6-腺嘌呤(N6-methyladenosine,m6A)甲基化是RNA重要的表观遗传学修饰,m6A甲基化水平主要由甲基化酶如甲基化酶3 (methyltransferase-like 3,METTL3)和去甲基化酶如ALKBHB同源蛋白5 (alkylation repair homolog protein 5,ALKBH5)调控[8]。Song等[9]研究发现缺氧/复氧后 METTL3表达上调,m6A甲基化水平增加,进而损害自噬通量,促进心肌细胞凋亡,提示m6A甲基化修饰可能通过影响自噬从而参与MIRI的病理过程。
速效救心丸主要由川芎嗪、冰片组成。临床发现其可显著改善心肌梗死及心绞痛等症状[10-12]。本课题组预实验研究发现速效救心丸可以减少大鼠心肌梗死面积,改善心功能,从而减轻缺血再灌注损伤,并与自噬机制有关。本研究通过缺氧/复氧心肌细胞模型,从表观遗传学与自噬角度深入探讨速效救心丸对MIRI的保护作用,为其临床运用提供更加充分的理论依据。
1 材料
1.1 细胞 大鼠心肌细胞H9c2细胞购自上海诺百生物科技有限公司。
1.2 试剂与药物 速效救心丸(天津中新药业集团股份有限公司,批号617135),其浓度的选择基于前期基础研究,分别用无水乙醇将速效救心丸及其有效成分川芎嗪、冰片稀释溶解至50、100、25 mg/mL,与细胞共培养时使其给药终质量浓度为50、100、25 μg/mL。BCA蛋白浓度检测试剂盒、SDS-PAGE凝胶快速配制试剂盒、蛋白Marker、CellTiter-LumiTMSteady发光法细胞活力检测试剂盒(上海碧云天生物技术有限公司,批号0701018181104、P0012AC、061418181119、C0069S);DMEM高糖培养基(美国Corning公司,批号32320006);PBS (上海昱都生物科技有限公司,批号AF29526788);0.25% Trypsin-EDTA[赛默飞世尔科技(中国)有限公司,批号193154];SYBR RT-qPCR Master Mix、RNA抽取试剂盒(南京诺唯赞生物科技有限公司,批号Q341-02、7E552A1);GoScriptTMReverse Transscription (美国Promega公司,批号0000389033);ALKBH5(英国Abcam公司,批号ab195377);GAPDH (美国Proteintech公司,批号051201);二抗(合肥白鲨生物科技有限公司,批号69110200);EpiQuik m6A RNA甲基化定量检测试剂盒(美国Epigentek 公司,批号P-9005)。
1.3 仪器 超净工作台(珠海市再鑫仪器有限公司);Forma311型CO2细胞培养箱、StepOnePlus Real-Time PCR仪(美国Thermo公司);SDS-PAGE电泳仪、湿转转膜仪(美国Bio-Rad公司);5430R型高速冷冻离心机(德国Eppendorf公司)。
2 方法
2.1 缺氧/复氧模型的建立及复氧时间的确定 H9c2细胞培养在含10%胎牛血清的高糖DMEM中,5% CO2培养箱中传代培养至第3代后建立缺氧/复氧模型。更换培养基为低糖无血清的DMEM,在缺氧条件下(1% O2、94% N2、5% CO2)培养2 h后再复氧(95%空气,5% CO2),分别复氧0、2、4、6 h。
2.2 化学发光法检测细胞活力 通过CellTiter-LumiTMSteady发光法细胞活力检测试剂盒检测不同复氧时间组的ATP水平来确定最佳复氧时间。使用满足化学发光检测条件的96孔板,之后进行细胞铺板,5% CO2,37 ℃,过夜培养。室温平衡10 min,向每孔中加入发光法检测试剂,室温振荡2 min,室温孵育10 min,使发光信号趋于稳定。使用具有检测化学发光功能的多功能酶标仪进行检测。
2.3 实验分组 H9c2细胞铺板密度在30%~40%之间,随机分为常氧组、缺复/复氧组、速效+缺氧/复氧组、川芎嗪+缺氧/复氧组、冰片+缺氧/复氧组,药物预处理1 h之后进行缺氧/复氧处理,待到规定时间后收集细胞mRNA和蛋白。
2.4 Western blot检测ALKBH5的表达 提取各组细胞蛋白,BCA试剂盒蛋白定量后变性,上样、电泳、转膜,脱脂奶粉封闭,加入ALKBH5一抗(1∶2 000),4 ℃过夜孵育,洗膜后加入二抗(1∶10 000),室温孵育2 h,洗膜,显影。
2.5 Human ALKBH5过表达慢病毒制备 根据ALKBH5(NM_017758.3)基因信息,针对CDS区进行基因合成,并将其构建入慢病毒表达载体骨架PDS085_pL-MCS(用NheI和AscI酶切)中,即获得慢病毒表达载体pl-CMV-ALKBH5。
2.6 转染实验分组 H9c2细胞铺板密度在30%~40%之间,随机分为空白转染+常氧组、空白转染+缺氧/复氧组、空白转染+速效预处理+缺氧/复氧组、空白转染+川芎嗪+缺氧/复氧组、空白转染+冰片+缺氧/复氧组、ALKBH5过表达+缺氧/复氧组、ALKBH5过表达染+速效+缺氧/复氧组、ALKBH5过表达+川芎嗪+缺氧/复氧组、ALKBH5过表达+冰片+缺氧/复氧组。
2.7 慢病毒转染细胞 从培养箱中取出细胞,吸去旧培养基,将含病毒的培养液小心加入各孔中,放于CO2培养箱孵育4~6 h,吸去含病毒的培养液,PBS清洗细胞2~3次,最后加入适量培养液,过夜后观察细胞状态。
2.8 RT-qPCR检测相关基因的表达 采用RT-qPCR法对相关基因表达进行定量分析。用TRIzol试剂提取心肌细胞总RNA,逆转录获取cDNA,SYBR Green PCR Master Mix Kit 用于量化RNA水平,以β-actin作为内参,引物序列见表1。

表1 引物序列
2.9 比色法检测m6A甲基化水平 提取样品RNA,每次反应的总RNA量可为100~300 ng,每个反应的最佳量为200 ng。制备缓冲液与溶液,与RNA结合,捕获m6A RNA,使用酶标仪检测信号,计算m6A的水平。
2.10 统计学分析 通过SPSS 25.0软件进行处理,符合正态性及方差齐性,组间比较采用单因素方差分析;不符合正态性和(或)方差齐性,组间比较使用非参数检验。P<0.05表示差异有统计学意义。
3 结果
3.1 H9c2细胞不同复氧时间对细胞活力的影响 如图1所示,不同复氧时间组的细胞活力均低于常氧培养细胞(P<0.01);其中复氧4 h可以较好的恢复细胞活力。因此后续缺氧/复氧模型均采取缺氧2 h,复氧4 h。

注:与同一复氧时间常氧组比较,**P<0.01。图1 不同复氧时间心肌细胞活力
3.2 速效救心丸预处理对细胞状态的影响 如图2所示,常氧组细胞生长状态良好,死亡细胞较少;与常氧组比较,缺氧/复氧组细胞死亡增加(P<0.01);速效救心丸、川芎嗪及冰片预处理可减少缺氧/复氧后心肌细胞的死亡,促进增殖(P<0.01)。
3.3 速效救心丸预处理对缺氧/复氧心肌细胞ALKBH5表达的影响 如图3所示,与常氧组比较,缺氧/复氧组细胞去甲基化酶ALKBH5的mRNA和蛋白表达升高,其中mRNA表达差异有统计学意义(P<0.05),蛋白表达差异无统计学意义(P>0.05);与缺氧/复氧组比较,速效救心丸及其有效成分川芎嗪、冰片预处理均可增加缺氧/复氧后心肌细胞ALKBH5 mRNA 和蛋白表达(P<0.01)。
3.4 速效救心丸预处理及ALKBH5过表达对缺氧/复氧心肌细胞m6A甲基化水平的影响 如图4所示,与缺氧/复氧组比较,速效救心丸及其有效成分川芎嗪、冰片预处理可降低m6A水平(P<0.01),ALKBH5过表达处理后也可下调m6A水平(P<0.01)。

注:与常氧组比较,**P<0.01;与缺氧/复氧组比较,##P<0.01。图2 速效救心丸对缺氧/复氧后心肌细胞的影响
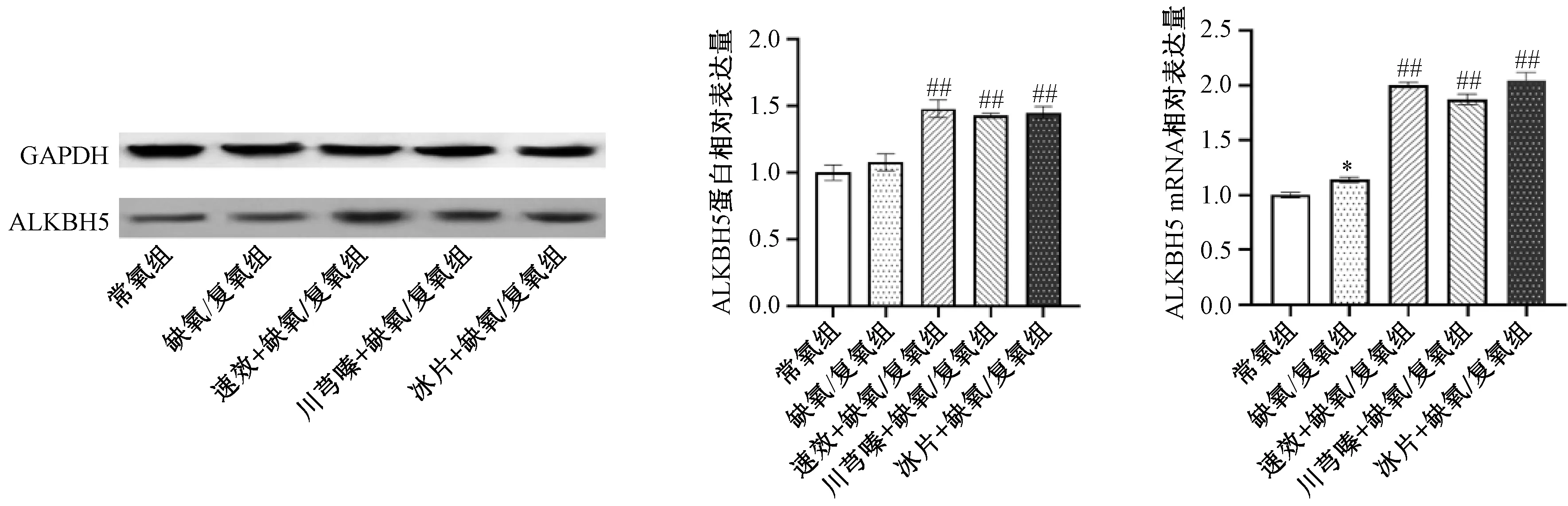
注:与常氧组比较,*P<0.05;与缺氧/复氧组比较,##P<0.01。图3 速效救心丸对ALKBH5表达的影响
3.5 速效救心丸预处理及ALKBH5过表达对缺氧/复氧心肌细胞活力的影响 如图5所示,与缺氧/复氧组比较,速效救心丸及其有效成分川芎嗪、冰片预处理可提高缺氧/复氧后心肌细胞的活力(P<0.01);与缺氧/复氧组比较,ALKBH5过表达处理也可增加心肌细胞活力(P<0.01)。
3.6 速效救心丸预处理及ALKBH5过表达对缺氧/复氧心肌细胞自噬的影响 如图6所示,与常氧组比较,缺氧/复氧组心肌细胞GSK3β、Atg5、Beclin1、P62 mRNA表达均升高(P<0.01),mTORmRNA表达降低(P<0.01);与缺氧/复氧组比较,速效救心丸及其有效成分川芎嗪、冰片预处理可抑制GSK3β、Atg5、Beclin-1、P62 mRNA表达(P<0.01),促进mTORmRNA表达(P<0.01);与缺氧/复氧组比较,ALKBH5过表达也可抑制GSK3β、Atg5、Beclin-1、P62 mRNA表达,促进mTORmRNA表达(P<0.01)。
4 讨论
在心肌缺血再灌注过程中,自噬被明显激活,超过一定水平时会导致细胞功能障碍,从而发生自噬性细胞死亡[13-14],因此,抑制过度自噬可能成为治疗MIRI的一个有效靶点。参与自噬调控的经典信号通路之一是GSK3β/mTOR通路,一些关键蛋白可直接或间接反映自噬过程[15-16]。Beclin 1是自噬起始阶段的关键调控分子,调控早期自噬小体的形成。微管相关蛋白轻链3蛋白(microtubulerassociated protein light chain 3 protein,LC3)是Beclin1蛋白的关键下游因子,是检测自噬发生的标志性蛋白。Atg5也参与自噬体的形成[17-20]。P62的主要功能是将被降解的细胞器运输至成熟的自噬体[21]。随着对表观遗传学的深入研究发现,m6A修饰与自噬密切相关。
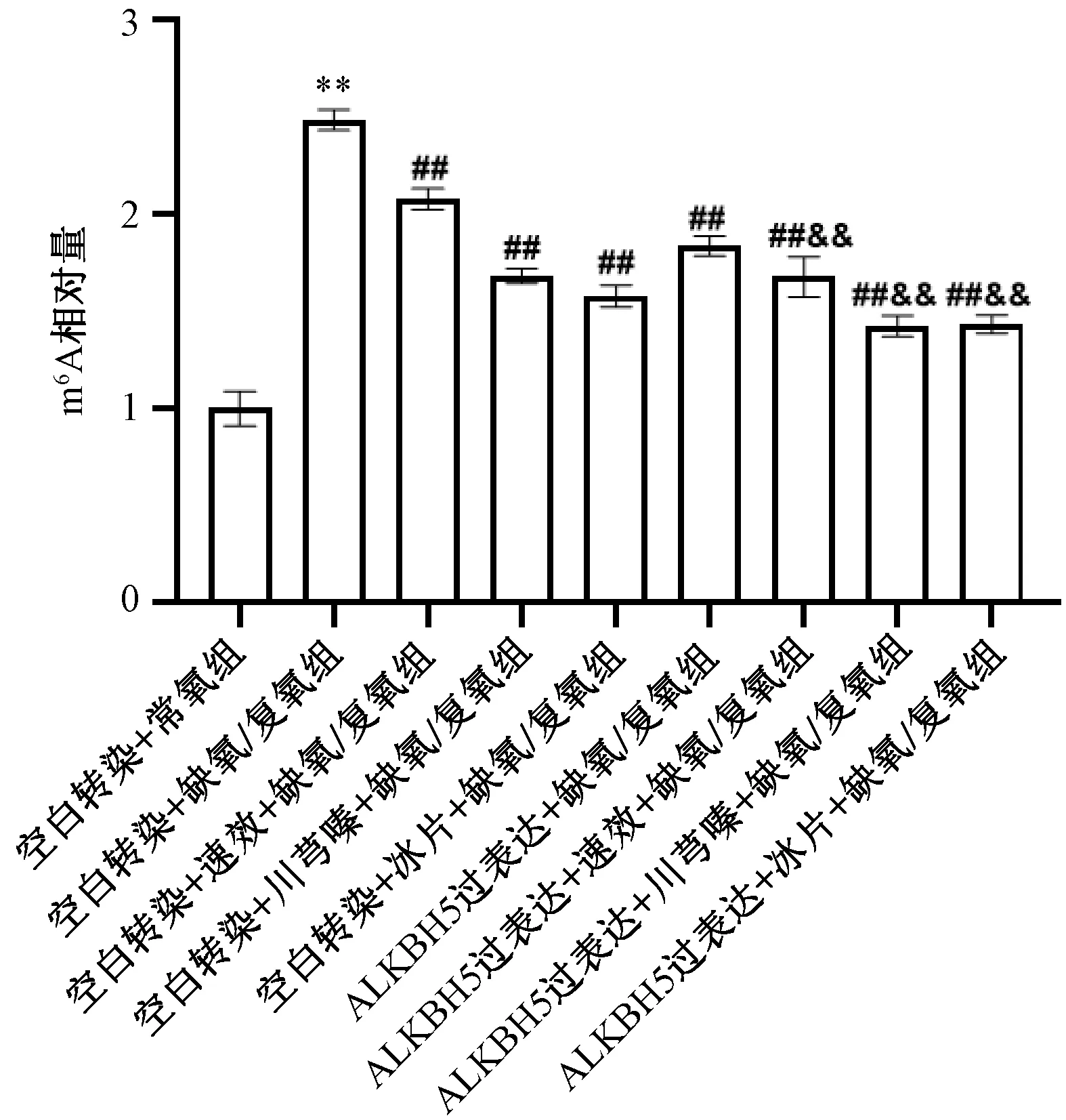
注:与空白转染+常氧组比较,**P<0.01;与空白转染+缺氧/复氧组比较,##P<0.01;与ALKBH5过表达+缺氧/复氧组比较,&&P<0.01。图4 速效救心丸与ALKBH5过表达对心肌细胞m6A甲基化水平的影响

注:与空白转染+常氧组比较,**P<0.01;与空白转染+缺氧/复氧组比较,##P<0.01;与ALKBH5过表达+缺氧/复氧组比较,&&P<0.01。图5 速效救心丸与ALKBH5过表达对心肌细胞活力的影响
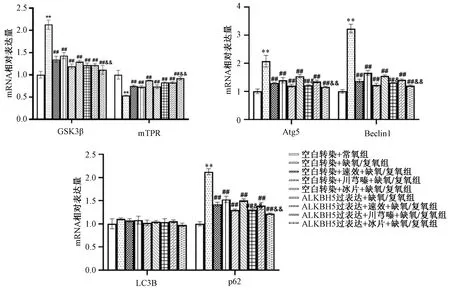
注:与空白转染+常氧组比较,**P<0.01;与空白转染+缺氧/复氧组比较,##P<0.01;与ALKBH5过表达+缺氧/复氧组比较,&&P<0.01。图6 速效救心丸与ALKBH5过表达对心肌细胞自噬的影响
本课题组发现,速效救心丸及其有效成分川芎嗪、冰片可有效改善缺氧/复氧心肌细胞损伤;缺氧/复氧后心肌细胞去甲基化酶ALKBH5 mRNA表达略增加,蛋白表达差异无统计学意义;而速效救心丸及其有效成分川芎嗪、冰片预处理可增加去甲基化酶ALKBH5的表达,下调m6A甲基化水平;抑制GSK3β、Beclin-1、Atg5、P62的表达,增加mTOR的表达。采用慢病毒转染技术使去甲基化酶ALKBH5过表达,ALKBH5过表达后缺氧/复氧心肌细胞m6A甲基化水平下降、细胞活力增加,GSK3β、Beclin-1、Atg5、P62的表达下降,mTOR的表达增加,表明速效救心丸可能通过ALKBH5/m6A途径抑制过度自噬从而减轻缺氧/复氧心肌细胞损伤。此外,本课题组发现速效救心丸拮抗缺血再灌注损伤的作用优于单体川芎,弱于单体冰片,提示速效救心丸减缓缺血再灌注损伤主要是通过冰片发挥作用,其用量较少,且在药物服用安全范围内,故对人体无害。
然而,本实验并未在蛋白层次上探索自噬相关指标的变化,其中LC3相对mRNA表达结果无统计学意义,故在以后的研究中应通过Western blot等技术来深入对自噬通路的研究。另外,应增加干扰ALKBH5表达后对缺氧/复氧心肌细胞的影响,以期为速效救心丸治疗MIRI提供更加充足的证据。MIRI目前尚无有效的治疗方法,但研究发现我国传统中药,如五参顺脉胶囊、三七总皂苷等通过抑制过度自噬减轻缺血再灌注损伤[22-25],未来需要更多相关研究来推动我国传统中医药卫生事业的发展。

