一测多评法同时测定不同采收期白苞蒿中8种成分
何 兵,田 吉,杨世艳
(1.西南医科大学药学院,四川 泸州 646000;2.西南医科大学附属中医医院,四川 泸州 646000)
白苞蒿ArtemisialactifloraWall.为菊科蒿属多年生草本植物,又名白花蒿,主要分布于我国秦岭以南各省区[1],常见于山坡、路旁、林缘,是中药刘寄奴的基原植物之一[2],以全草入药,性甘、微苦,平,具有清热、解毒、止咳等功效,主要用于治疗慢性肝炎、肝硬化、肾炎等症[3],主要成分为有机酸类和黄酮类[4-6]。其中有机酸具有较强的抗菌、抗炎、抗氧化等生物活性[7],而黄酮抗病毒、抗氧化、清除自由基等活性较强[8]。关于白苞蒿成分的含量测定较少,仅有1篇报道涉及槲皮素[9]。为了进一步完善和提高白苞蒿质量标准,本实验采用一测多评法同时测定该药材中富马酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸C、紫槲皮苷、异牡荆苷、异槲皮苷的的含量。
1 材料
1.1 仪器 P680高效液相色谱仪(美国戴安公司);LC2030高效液相色谱仪(日本岛津公司);MS105DU型电子天平(瑞士Mettler -Toledo公司);AS7240A型超声波清洗器(240 W,40 kHz,天津奥特赛恩斯仪器有限公司);Direct-Q3型超纯水系统(美国密理博公司)。Lubex Kromasil C18、AkzoNobel Kromasil C18、Dikma Inspire C18、Dikma Plastil C18、Dikma Diamonsil(2) C18、Dikma Silversil C18色谱柱(250 mm×4.6 mm,5 μm)。
1.2 试剂与药物 富马酸(批号F016-120615,纯度98.58%)、绿原酸(批号A0022-19030620,纯度99.39%)、隐绿原酸(批号A0024-19032403,纯度99.07%)、紫槲皮苷(批号A0103-19010210,纯度99.47%)、异牡荆苷(批号A0681-19051405,纯度99.02%)、异槲皮苷(批号A0439-19051005,纯度99.74%)、异绿原酸A(批号A0025-19032601,纯度99.82%)、异绿原酸C(批号A0027-19031603,纯度99.65%)对照品均购于成都曼斯特生物科技有限公司。白苞蒿于2019年4、6、8、10、12月采自四川泸州龙马潭区,经西南医科大学药学院何兵副研究员鉴定为菊科蒿属植物白苞蒿ArtemisiaLactfloraWall.,60 ℃烘干,粉碎,过3号筛。乙腈、甲醇为色谱纯;其余试剂均为分析纯;水为超纯水。
2 方法与结果
2.1 色谱条件 Lubex Kromasil C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈(A)-0.1%磷酸(B),梯度洗脱(0~30 min,5%~30%A;30~31 min,30%~5%A;31~35 min,5%A);体积流量1.0 mL/min;柱温40 ℃;检测波长0~11 min,209 nm(富马酸),11~35 min,326 nm(绿原酸、隐绿原酸、紫槲皮苷、异牡荆苷、异槲皮苷、异绿原酸A、异绿原酸C);进样量10 μL,色谱图见图1。由此可知,在该条件下各成分分离度良好。
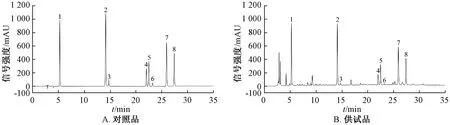
1.富马酸 2.绿原酸 3.隐绿原酸 4.紫槲皮苷 5.异牡荆苷 6.异槲皮苷 7.异绿原酸A 8.异绿原酸C1.fumaric acid 2.chlorogenic acid 3.cryptochlorogenic acid 4.rutin 5.isovitexin 6.isoquercitrin 7.isochlorogenic acid A 8.isochlorogenic acid C图1 各成分HPLC色谱图Fig.1 HPLC chromatograms of various constituents
2.2 溶液制备
2.2.1 对照品溶液 精密称取各对照品适量,加75%甲醇制成分别含富马酸2.095 mg/mL、绿原酸5.953 mg/mL、隐绿原酸0.461 mg/mL、紫槲皮苷3.490 mg/mL、异牡荆苷2.126 mg/mL、异槲皮苷0.492 mg/mL、异绿原酸A 3.387 mg/mL、异绿原酸C 2.432 mg/mL的贮备液,分别吸取0.5 mL,置于10 mL量瓶中,75%甲醇稀释至刻度,摇匀,制成质量浓度分别为0.105、0.298、0.023、0.175、0.106、0.025、0.169、0.122 mg/mL的溶液,即得避光低温保存。
2.2.2 供试品溶液 取药材粉末(过3号筛)约1.0 g,精密称定,置于100 mL锥形瓶中,加25 mL 75%甲醇,超声处理45 min,取出,放冷至室温,75%甲醇补足减失的质量,摇匀,滤过,取续滤液,0.45 μm滤膜过滤,即得。
2.3 方法学考察
2.3.1 线性关系考察 精密量取“2.2.1”项下贮备液0.1、0.2、0.4、0.5、0.6、0.8、1.0 mL,置于 10 mL量瓶中,加75%甲醇稀释至刻度,在“2.1”项下色谱条件进样测定。以峰面积为纵坐标(Y),各成分质量浓度为横坐标(X)进行回归,另取“2.2.1”项下对照品溶液,75%甲醇逐级稀释,分别以信噪比3∶1、10∶1为检测限、定量限,结果见表1,可知各成分在各自范围内线性关系良好。
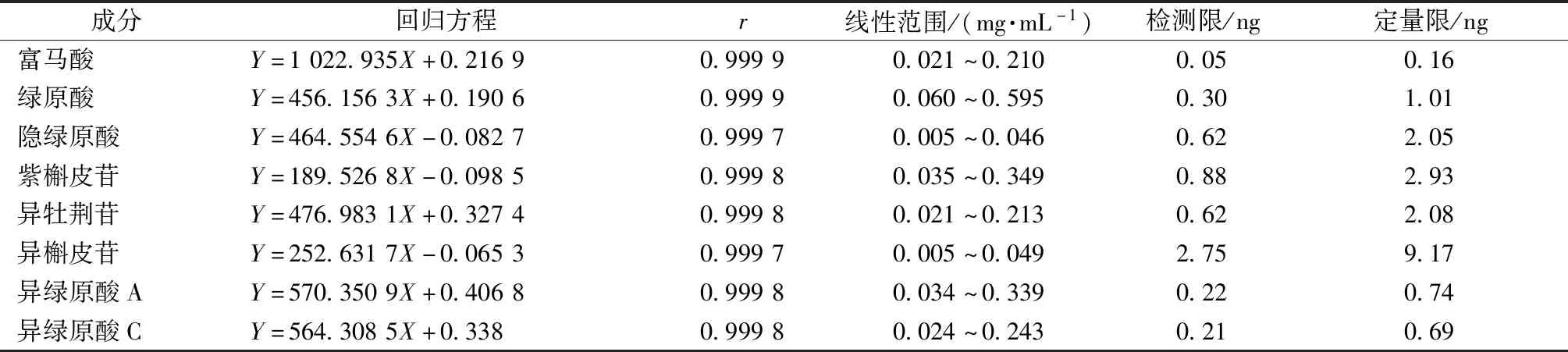
表1 各成分线性关系Tab.1 Linear relationships of various constituents
2.3.2 精密度试验 取“2.2.1”项下对照品溶液,在“2.1”项色谱条件下进样测定6次,测得富马酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸C、紫槲皮苷、异牡荆苷、异槲皮苷峰面积RSD分别为0.31%、0.25%、0.79%、0.55%、0.63%、0.74%、0.52%、0.60%,表明仪器精密度良好。
2.3.3 稳定性试验 取同一供试品溶液,室温放置,于0、4、8、12、24、48 h在“2.1”项色谱条件下进样测定,测得富马酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸C、紫槲皮苷、异牡荆苷、异槲皮苷峰面积RSD分别为0.81%、0.63%、1.06%、0.95%、1.02%、1.70%、1.17%、1.56%,表明溶液在48 h内稳定。
2.3.4 重复性试验 取采于8月的药材适量,按“2.2.2”项下方法平行制备6份供试品溶液,在“2.1”项色谱条件下进样测定,测得富马酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸C、紫槲皮苷、异牡荆苷、异槲皮苷含量RSD分别为1.12%、0.93%、1.49%、0.99%、1.08%、1.57%、1.22%、1.55%,表明该方法重复性良好。
2.3.5 加样回收率试验 精密称取各成分含量已知的药材9份,每份0.5 g,将其分成3组,每组3份,精密加入含富马酸1.625 mg/mL、绿原酸4.253 mg/mL、隐绿原酸0.205 mg/mL、紫槲皮苷1.735 mg/mL、异牡荆苷1.416 mg/mL、异槲皮苷0.238 mg/mL、异绿原酸A 2.469 mg/mL、异绿原酸C 1.647 mg/mL的对照品溶液0.50、0.75、1.00 mL,按“2.2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定,计算回收率。结果,富马酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸C、紫槲皮苷、异牡荆苷、异槲皮苷平均加样回收率分别为98.46%、98.22%、97.25%、97.78%、97.90%、97.34%、98.15%、98.03%,RSD分别为1.03%、1.13%、1.79%、1.65%、1.52%、1.85%、1.25%、1.40%。
2.4 相对校正因子计算
2.4.1 斜率校正法 参考文献[10]报道,根据标准曲线公式A=a·C+b,C=(A-b)/a=A/a-b/a,当a/b>100时b/a可忽略不计,即C=A/a,则相对校正因子fi/s可直接以斜率之比计,即fi/s=ai/as。待测成分i浓度为Ci=Ai/ai=Ai/(as·fi/s),其中as为内标标准曲线斜率,ai为待测成分标准曲线斜率,结果见表2。
2.4.2 多点校正法 参考文献[11]报道,校正因子fi/s计算公式为fi/s=fi/fs=(Ai/Ci)/(As/Cs),待测成分i浓度为Ci=Ai/[fi/s×(As/Cs)],其中Ai和Ci分别为待测成分峰面积、浓度,As、Cs分别为内标峰面积和浓度,结果见表2。
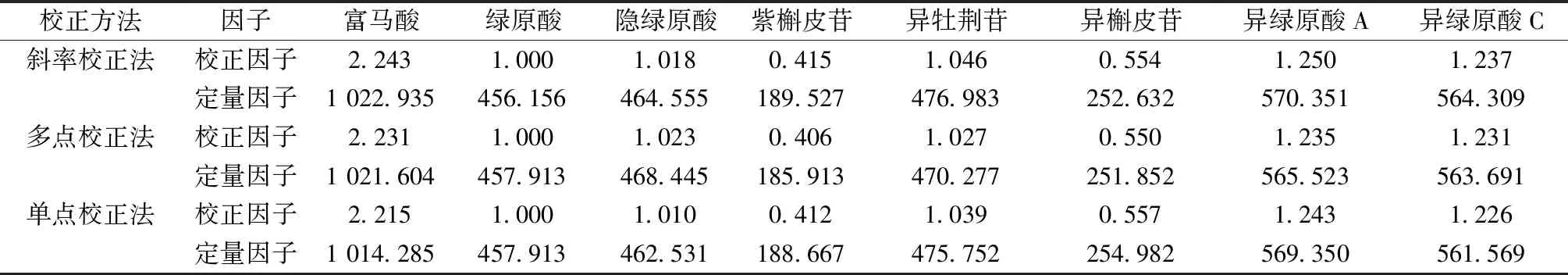
表2 各成分相对校正因子(内标绿原酸)Tab.2 Relative correlation factors for various constituents (with chlorogenic acid as an internal standard)
2.4.2 不同仪器和色谱柱考察 考察不同实验室、色谱仪(Dionex P680、Shimadzu LC2030)、色谱柱(Lubex Kromasil C18、AkzoNobel Kromasil C18、Dikma Inspire C18、Dikma Plastil C18,均为250 mm×4.6 mm,5 μm)对相对校正因子的影响,结果见表3,可知不同仪器和不同色谱柱对相对校正因子无明显影响(RSD<3%)。
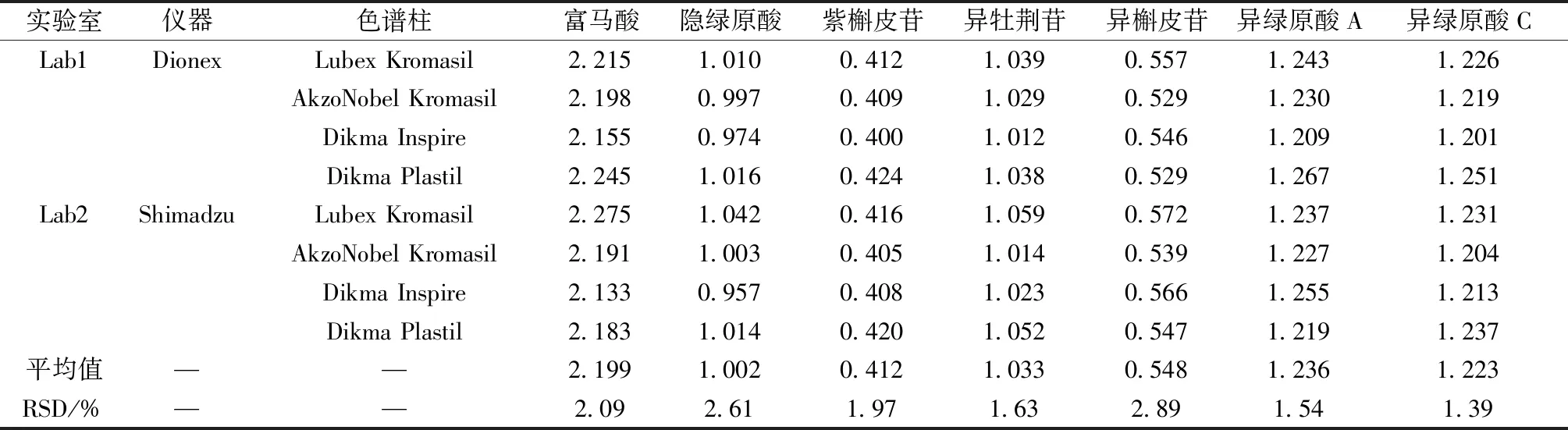
表3 不同仪器、色谱柱对相对校正因子的影响Tab.3 Effects of different instruments and columns on relutive corection factors
2.5 色谱峰定位 采用相对保留时间[12-15]对色谱峰进行定位,结果见表4。虽然该方法对保留时间靠前的色谱峰定位较准确,但随着保留时间延长,其预测值与实测值之间的相对误差越来越大,有些甚至超过±6%,并且两者往往相差近2 min,此时很难准确定位。
王龙星等[16]发现,在相同色谱条件下即使采用不同仪器和色谱柱,各成分保留时间之间也存在线性关系,根据此原理,以Dionex Lubex Kromasil所得保留时间为横坐标(X),其他仪器、色谱柱所得保留时间为纵坐标(Y)进行回归,测得其R2分别为0.999 0、0.999 3、0.999 8、0.999 3、0.999 3、0.999 9、0.999 4、0.999 4、0.999 7,表明所有数据点几乎都落在标准曲线上,即不论采用2个数据点还是8个,所得校正曲线基本重合,其结果也相差不大。由于本实验采用一测多评法时其他色谱峰未定位确认,故无法采用多个数据点绘制校正曲线,故在色谱图中前后各取一点,如以内标绿原酸与另1种常见、易辨认、对照品易获取的紫槲皮苷进行两点校正,同法绘制校正曲线,再以Dionex Lubex Kromasil所得标准保留时间代入校正方程,即可计算各成分预测出峰时间,从而实现快速指认定位,结果见表5。
采用两点校正时即使采用不同仪器、色谱柱,随着保留时间延长预测值与实测值之间的相对误差仍很低,即预测值与实际值非常接近,可实现精准定位,但其唯一不足是保留时间靠前的色谱峰(特别是10 min以内者)在未纳入两点校正其预测实测保留时间之间相对误差较高,故可利用表4相对保留时间来预测[17],即两点校正适合保留时间靠后的色谱峰,而相对保留时间校正适合保留时间靠前者,两者结合,所有峰均可获得准确的预测值。若该色谱峰附近还有其他色谱峰干扰定位,则可再根据各成分紫外吸收光谱、整体峰形、峰面积占比进一步准确定位。
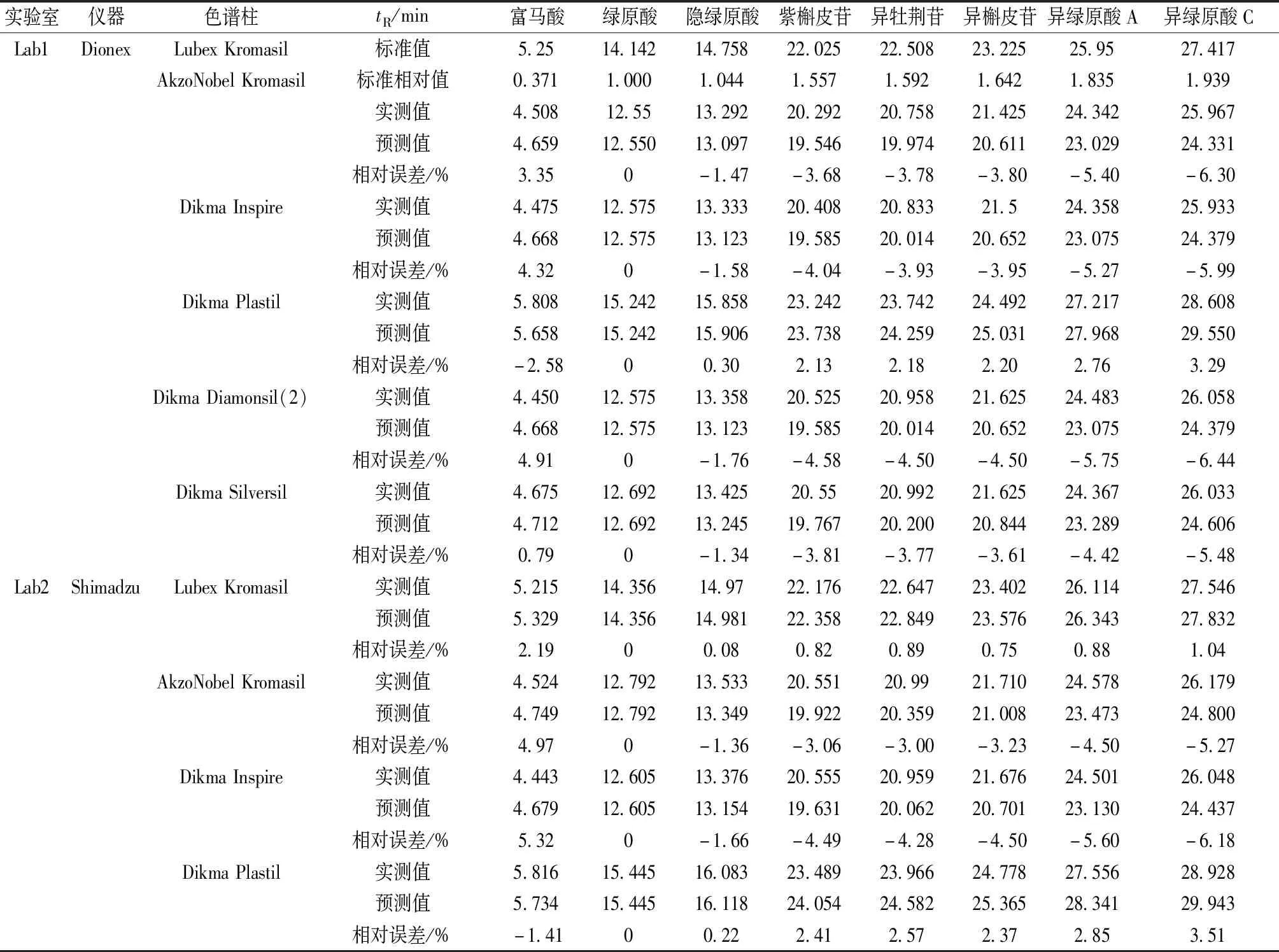
表4 相对保留时间定位色谱峰Tab.4 Location of chromatographic peaks by relative retention time
2.6 样品含量测定 精密吸取对照品、供试品溶液各10 μL,在“2.1”项色谱条件下进样测定,分别采用外标法、标准曲线法、一测多评法(斜率校正、多点校正、单点校正)计算含量,结果见表6。由此可知,各方法所得结果之间的RSD<2%;3种校正手段所得结果与外标法之间的相对误差绝对值<2%,通过t检验可知其差异均无统计学意义(P>0.05);不同采收期药材所含成分含量不同,在10月最高。另外,采用单点校正一测多评法时,各成分含量测定结果与外标法一致。
3 讨论
3.1 检测波长的选择 采用二极管阵列检测器在200~380 nm扫描白苞蒿中各成分的紫外吸收,实验发现富马酸在209 nm有最大吸收,绿原酸类在326 nm左右有最大吸收,而紫槲皮苷、异槲皮苷类黄酮在256、355 nm左右有最大吸收,异牡荆苷在271、338 nm有最大吸收。异牡荆苷在326、338 nm检测,峰高差异不大,顾异牡荆苷可采用326 nm检测。由于紫槲皮苷和异牡荆苷峰挨得很近,无法切换波长,顾紫槲皮苷仍以326 nm检测,同时异槲皮苷再换波长也无意义。为避免过多的切换波长,除富马酸采用209 nm外,其余成分均以326 nm检测。
3.2 单点校正的优势 校正因子的准确计算直接影响一测多评的准确性,它是一测多评推广应用的关键。校正因子的计算常用的是多点校正[18-21]和斜率校正[22-23]。不论是多点校正还是斜率校正,与外标法或标准曲线法结果相近但不一致。而单点校正是从多点校正和斜率校正演变而来,直接以外标法浓度点的单点斜率之比作为校正因子,计算更为快捷,其结果与外标法完全一致。单点校正完全等同于外标法,外标法适用的地方,单点校正即适用,否认单点校正也就是否认外标法。
3.3 不同定位方法的优缺点 一测多评推广应用的另一关键在于色谱峰的准确定位,定位不准就会出现所测成分非待测成分。本文详述了两点校正法用于定位色谱峰的方法,其特别适用于保留时间靠后的色谱峰定位,其相对误差普遍小于1.2%。两点校正法唯一的缺陷在于当保留时间太过靠前的色谱峰在未纳入校正方程时,其相对误差较大,从而导致定位不准。但保留时间靠前的色谱峰刚好是相对保留时间定位的优势。故一测多评的定位若结合相对保留时间和两点校正法,以相对保留时间定位10 min以内的色谱峰,以两点校正定位10 min以后的色谱峰,二者结合所有待测成分色谱峰均可实现精准定位(相对误差<2%),其特别适合相邻色谱峰众多、峰高批间差异较大、色谱峰紫外吸收相近或仪器无法检测紫外吸收的色谱峰定位。
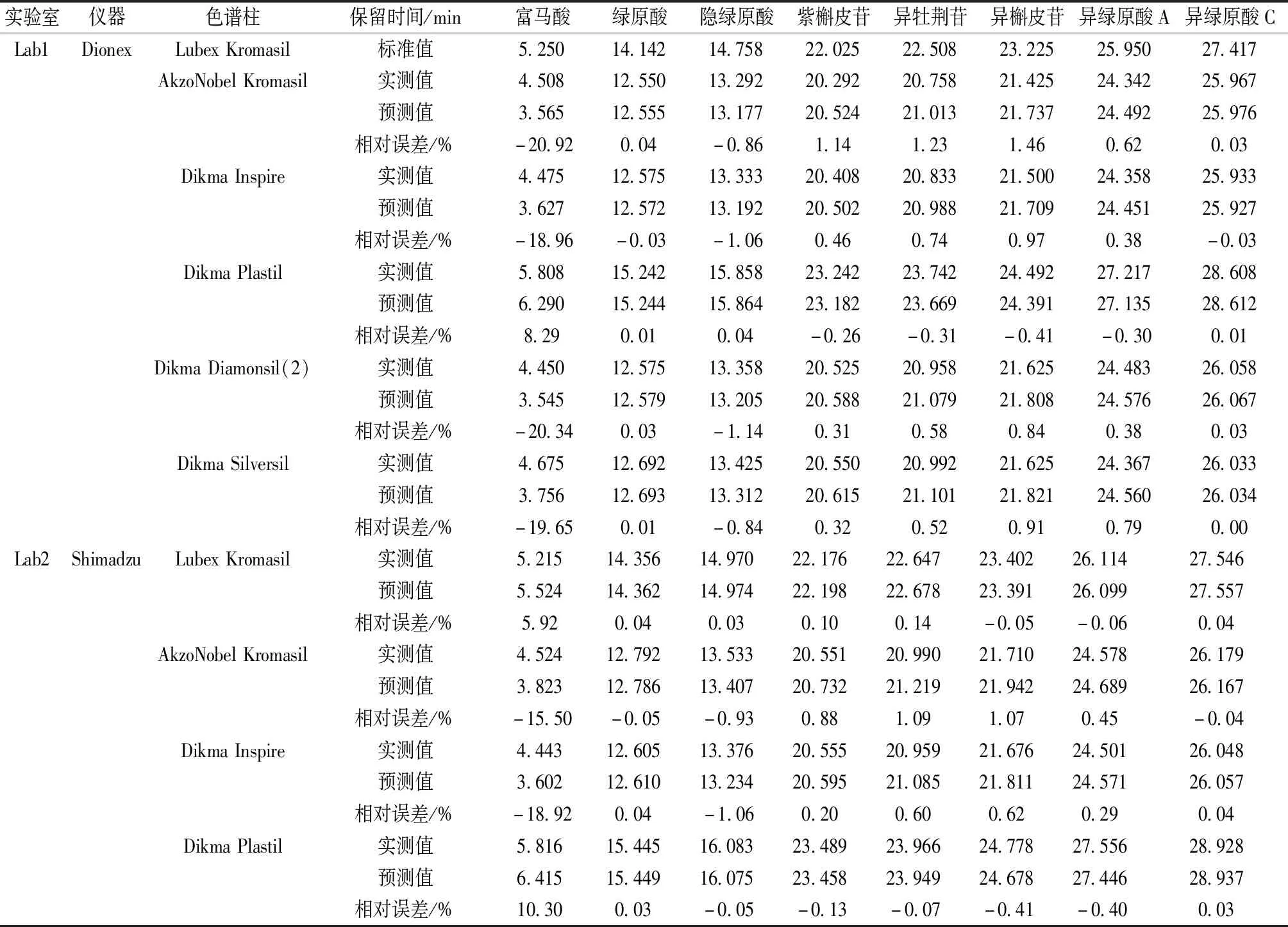
表5 两点校正定位色谱峰Tab.5 Location of chromatographic peaks by two-point correction
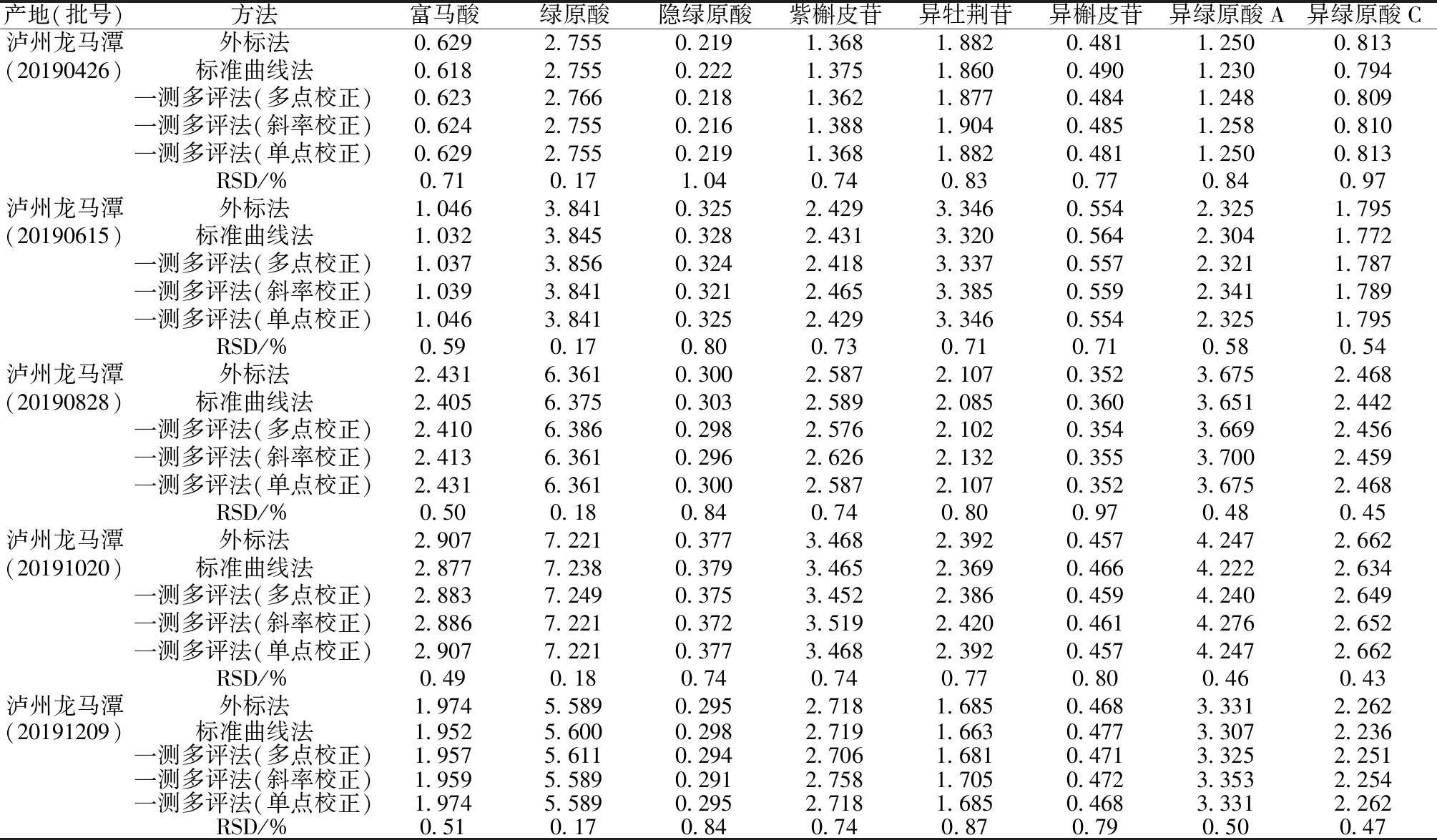
表6 各成分含量测定结果(mg/g,n=3)Tab.6 Results of content determination of various constituents (mg/g,n=3)
3.4 一测多评在白苞蒿质控中的优势 白苞蒿生态适应性较强,分布较为广泛,具有较高的药用价值。在《全国中草药汇编》、《中药大辞典》、《中华本草》等均有收载。目前白苞蒿未收载入《中国药典》一部,但在2020年版《中国药典》中,白苞蒿为中药刘寄奴的基原植物之一[2],白苞蒿有着优良的应用开发潜力。本研究采用HPLC-QAMS同时测定了不同采收期白苞蒿所含的8种主要活性成分的含量。为进一步完善和提高白苞蒿的质量标准提供科学依据,该法具有一定的推广应用价值。

