尕海湿地不同退化梯度土壤脲酶与蛋白酶活性时空分布特征①
常文华,马维伟,李 广,徐国荣,宋良翠
尕海湿地不同退化梯度土壤脲酶与蛋白酶活性时空分布特征①
常文华,马维伟*,李 广,徐国荣,宋良翠
(甘肃农业大学林学院,兰州 730070)
为探讨高寒湿地退化对土壤酶活性的影响,本文以青藏高原东缘尕海湿地未退化、轻度退化、中度退化和重度退化4种不同退化梯度的0 ~ 10、10 ~ 20和20 ~ 40 cm层土壤为研究对象,研究不同退化梯度土壤脲酶与蛋白酶活性时空变化特征。结果表明:随退化梯度加剧,土壤含水量降低,温度升高;土壤脲酶活性在0 ~ 40 cm土层中表现为随退化加剧而逐渐降低,而蛋白酶活性趋势恰好相反;除重度退化外,其他退化梯度土壤两种酶活性均随土层加深而降低;0 ~ 40 cm土层中脲酶与蛋白酶活性分别在7、8月和6、7月最高;相关性分析表明土壤脲酶活性与蛋白酶活性和温度极显著正相关(<0.01);土壤蛋白酶活性与微生物生物量氮极显著正相关(<0.01),与含水量和温度显著正相关(<0.05),与硝态氮显著负相关(<0.05)。沼泽化草甸退化显著增加土壤表层脲酶活性而降低蛋白酶活性;温度对土壤脲酶与蛋白酶活性起促进作用,含水量、微生物生物量氮对土壤蛋白酶活性具有促进作用。
尕海湿地;沼泽化草甸;土壤脲酶活性;土壤蛋白酶活性;退化
土壤酶参与土壤营养元素的一系列生化反应过程,不仅反映了土壤微生物养分含量需求及其生化反应过程的强度与方向[1],而且对土壤氮素的矿化、氨化、硝化和反硝化等过程具有促进作用[2]。土壤脲酶和蛋白酶是参与土壤有机氮向无机氮形式转化过程的关键酶,均在土壤氮素循环过程中发挥极其重要的作用[3],其中脲酶能促进土壤中尿素水解成氨,活性大小常用来表征土壤氮素转化的强度[4];蛋白酶能够促使蛋白质、肽类水解为氨基酸,与脲酶共同作用参与土壤氮素转化,是土壤氮素供给能力的重要表征[5]。因此,研究土壤脲酶和蛋白酶活性时空变化规律对于探究生态系统土壤氮素转化具有重要意义。
土壤酶活性能够反映土壤碳氮磷循环速率的强弱[6],其活性大小不仅受土壤环境状况、植被类型、微生物活性、土壤生物种类以及土壤养分可利用性[7-8]等因素的影响,而且还与凋落物降解及养分归还密切相关[9]。全球气候变化导致高寒地区部分生态系统发生一定程度的退化演替,进而引起区域植被、土壤等环境因子发生变化,而土壤酶活性也对这些变化产生不同程度的响应[10]。已有一些学者针对高寒生态系统不同退化梯度植被群落特征、土壤理化性质、生物学特性对土壤酶活性变化开展了相关研究[11-12],如蒋永梅等[13]对祁连山高寒退化草地研究发现,土壤酶活性随退化梯度加剧与土层加深呈现降低的趋势;Liu等[14]对高寒湿地退化区域研究显示,土壤表层温度、土壤水分和养分含量的变化必然会导致土壤酶活性的改变。这些研究在一定程度上揭示了高寒生态系统退化演替对土壤酶活性的影响,但对高寒沼泽化草甸退化过程中土壤脲酶、蛋白酶等氮素转化关键酶活性的时空变化特征鲜见报道。
尕海湿地位于青藏高原东缘,是若尔盖高寒湿地的重要组成部分,在维系黄河上游水源涵养功能和区域碳氮平衡中发挥重要作用。但近年来,受气候变化以及不合理的人为活动影响,湿地面积不断锐减,湿地发生明显退化[15],引起植被旱生化、土壤有机碳及其组分含量减小[16],这些植被和土壤特征的改变将会导致土壤脲酶和蛋白酶活性发生深刻变化,但对这一变化规律仍不清楚。与此同时,国内目前关于湿地退化演替土壤酶活性变化的研究多集中在三江源、黄河三角洲、滨海湿地以及三江平原地区[17],而对气候变化较为敏感的青藏高原高寒湿地研究较为匮乏。鉴于此,本研究以尕海湿地不同退化梯度的沼泽化草甸为研究对象,研究沼泽化草甸退化过程中土壤脲酶与蛋白酶活性的时空变化规律,揭示沼泽化草甸退化对土壤脲酶与蛋白酶活性的影响,以期为尕海湿地氮循环过程与酶活性机制研究提供基础数据,也为深入理解全球气候干暖化背景下高寒湿地生态系统土壤氮循环过程提供科学依据。
1 材料与方法
1.1 研究区概况
尕海湿地位于青藏高原东缘甘肃省甘南藏族自治州碌曲县境内(33°58′ ~ 34°32′N, 102°05′ ~ 102°47′E),海拔 3 430 ~ 4 300 m,区域内湿地面积为 58 067 hm2,其中沼泽化草甸约占总面积的88%。该地区气候类型属青藏高原气候带高寒湿润气候,年平均气温为 1.2 ℃,1 月和7 月平均气温分别为 –9.1 和 10.5 ℃;年均蒸发量为 1 150 mm,年平均降水量 782 mm,主要集中在 5—7 月,约占全年降水比重的80%。植物类型有藏篙草()、蕨麻()、散穗早熟禾()、高山棘豆(、乌拉苔草()、冷蒿()、密毛白莲蒿()、唐松草()、线叶蒿()等[18]。土壤类型以高山草甸土、高原沼泽土与泥炭土为主。
1.2 样地设置
本研究在团队前期工作的基础上,选择尕海湿地沼泽化草甸为研究对象,以尕海湖为中心沿原生湿地向外延伸设置退化梯度,根据植被优势种组成、盖度、地上生物量、地表裸露程度等特征,将研究区域划分为未退化(ND)、轻度退化(SD)、中度退化(MD)和重度退化(HD) 4种退化类型,并在每种退化梯度内随机布设10 m × 10 m的研究样地,每个样地内随机选择1 m × 1 m的3个重复样方,样方间至少保留5 m间隔,共12块样方,设置木栏围挡以防止人畜干扰。样地基本情况[19]见表1。
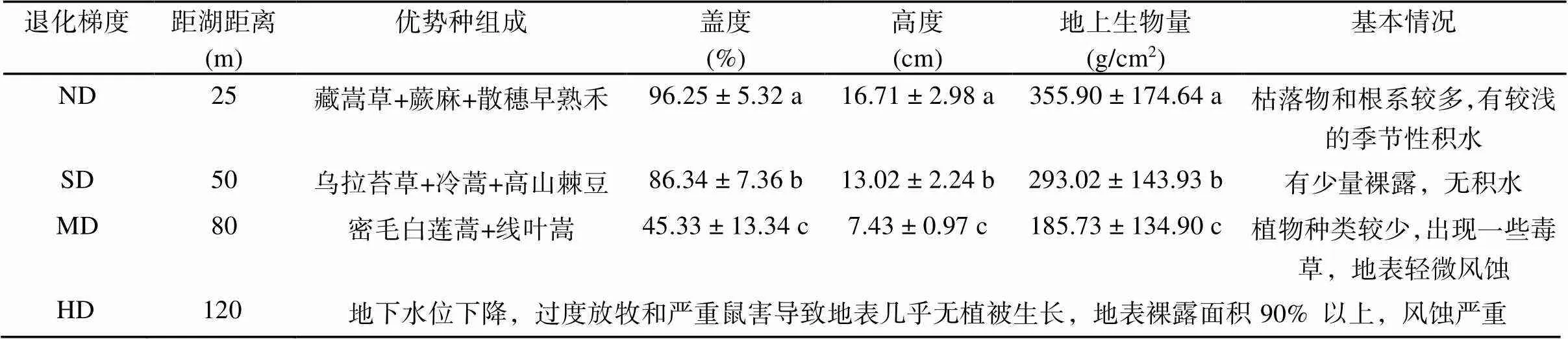
表1 尕海湿地样地基本情况
注:表中同列数据小写字母不同表示不同退化梯度间差异显著(<0.05),下同。
1.3 样品采集与测定
2019 年 5—9 月每月中旬左右,在上述不同样方内用土钻按照“蛇”形 5 点法采集 0 ~ 10、10 ~ 20 和 20 ~ 40 cm 土层土壤,依据相同退化梯度、相同土层土样混合成1份土样。去除土壤中可见杂物,四分法取部分土样,装入自封袋内,带回实验室。取一部分鲜土在4 ℃样品储存室保存用于土壤铵态氮、硝态氮与微生物生物量氮的测定;另一部分置于室内自然风干,过 2 mm筛后,用于土壤脲酶和蛋白酶活性及其他指标测定(重复3次)。
土壤脲酶活性采用脲素比色法测定,以 1 g 土壤在 37 ℃、24 h 内反应水解产生的氨氮毫克数表示;土壤蛋白酶活性采用酪素比色法测定,以 1 g 土壤在 30 ℃、24 h 内反应水解产生的氨基氮毫克数表示[20]。土壤温度与容积含水量数据利用 EM 50 数据收集系统(Decagon Devices, Inc, NE, USA)监测,第一次采样时进行布设,采样期内每间隔 10 min 自动记录一次数据。土壤容重采用环刀法测定;土壤全氮采用半微量凯氏法测定;土壤铵态氮、硝态氮采用 MgO-代氏合金蒸馏法测定;土壤微生物生物量氮含量采用氯仿熏蒸-K2SO4浸提法测定[21],相关测定结果见表2。

表2 土壤基本理化性质
注:表中数据为5—9月0 ~ 40 cm土层的平均值±标准误差(=3)。
1.4 数据处理
运用Microsoft Excel 365 进行数据整理与绘图,SPSS 26.0 进行数据统计分析处理。采用单因素方差分析(One-way ANOVA)及多重比较(LSD)分析不同退化梯度下土壤指标的差异显著性;采用双因素方差分析(Two-way ANOVA)比较不同退化梯度、土层深度以及二者交互作用对土壤酶活性的差异显著性;利用Pearson 相关系数分析探讨各因素间的相关关系。同一土层各退化梯度的土壤理化性质、酶活性、含水量与温度均为 5—9 月的均值,图表数据类型为平均值 ± 标准误差。
2 结果与分析
2.1 不同退化梯度沼泽化草甸土壤含水量和温度变化特征
尕海沼泽化草甸随退化梯度加剧,土壤含水量降低,土壤温度升高(表3)。其中 SD、MD 和 HD 相较于 ND,土壤含水量分别降低 24.35%、55.97% 和 62.98%,土壤温度分别升高 17.18%、24.39% 和 29.69%。在同一土层,ND 与 MD、HD 土壤含水量均存在显著差异(<0.05),且 MD 与 HD 间无显著差异,而 ND 和 SD 在 0 ~ 10 cm 与 10 ~ 20 cm 层差异显著(<0.05),在 20 ~ 40 cm 层差异不显著;土壤温度在各退化梯度间无显著差异。在垂直剖面,ND 的土壤含水量随土层加深显著降低(<0.05),而其他3 种退化梯度土壤含水量也有所降低,但差异不显著;各退化梯度的土壤温度也随土层加深而降低,但无显著差异。
2.2 不同退化梯度沼泽化草甸土壤酶活性空间分布特征
不同退化梯度土壤酶活性分布特征如图1 所示。与 ND 相比,SD、MD 和 HD 0 ~ 40 cm 层土壤脲酶活性分别增加了5.20%、8.49% 和10.06%,而蛋白酶活性分别降低了5.50%、8.39% 和12.05%。具体来说,在 0 ~ 10 与 10 ~ 20 cm 土层,与ND相比,各退化梯度间脲酶活性无显著差异,蛋白酶活性存在显著差异(<0.05);20 ~ 40 cm 层仅ND 与 HD 土壤脲酶与蛋白酶活性差异显著(<0.05)。在垂直剖面上,ND、SD、MD 土壤脲酶与蛋白酶活性均随土层加深而降低,HD 变化趋势为先升高后降低,说明重度退化改变了区域土壤脲酶与蛋白酶活性的垂直分布特征。方差分析也显示(表4),退化梯度对蛋白酶活性具有显著性影响(<0.05);土层深度对脲酶、蛋白酶活性也有显著性影响;退化梯度与土层深度对蛋白酶活性具有显著交互作用,而对脲酶活性无显著交互作用。
2.3 不同退化梯度沼泽化草甸土壤酶活性时间动态变化
土壤脲酶活性时间动态变化如图2A所示。0 ~ 10 cm 土层不同退化梯度脲酶活性呈“单峰”型分布,ND、SD 在7 月出现峰值,分别为1.79 mg/(g·24h) 和1.74 mg/(g·24h);而 MD、HD 峰值在8 月,为1.71 mg/(g·24h) 和1.72 mg/(g·24h)。10 ~ 20 cm 土层,除 MD 外峰值均出现在8 月,且 ND、SD 在 9 月大幅降低。20 ~ 40 cm 土层除 ND 峰值在8 月外,其余退化梯度峰值在9 月,且酶活性在不同退化梯度间趋于一致。在 0 ~ 20 cm 土层,5、7 月的脲酶活性 ND 均大于其余3种退化梯度,而在6、9 月恰好相反。在 20 ~ 40 cm 土层脲酶活性除 ND 在9 月降低外,其余退化梯度均持续增加。

表3 不同退化梯度土壤含水量和温度变化
注:表中小写字母不同表示同一土层不同退化梯度间差异显著(<0.05),大写字母不同表示同一退化梯度不同土层深度间差异显著(<0.05),下同。

图1 不同退化梯度土壤脲酶与蛋白酶活性

表4 不同退化梯度和土层深度交互作用下土壤酶活性方差分析
土壤蛋白酶活性时间动态变化如图2B所示。0 ~ 10 cm 土层不同退化梯度蛋白酶活性均呈“单峰”分布,ND、 SD与 MD 峰值出现在 7 月,分别为8.33、6.16和5.41 mg/(g·24h);HD 峰值在 6 月,为5.41 mg/(g·24h);5、7 和 8 月蛋白酶活性呈ND>SD> MD>HD 趋势。10 ~ 20 与 20 ~ 40 cm 土层均呈“N”型分布(除 ND 的 10 ~ 20 cm 土层外),且5、7 和 8 月的变化趋势与 0 ~ 10 cm 土层相同。在整个 0 ~ 40 cm 土层中,ND 在 5、7 月的蛋白酶活性均高于其余退化梯度,且前期波动增加到 9 月趋于一致。
2.4 土壤酶活性与土壤理化性质的关系
相关性分析结果表明(表 5),沼泽化草甸退化过程中土壤脲酶活性与蛋白酶活性和温度呈极显著正相关(<0.01);土壤蛋白酶活性与微生物生物量氮呈极显著正相关(<0.01),与含水量和温度呈显著正相关(<0.05),与硝态氮量呈显著负相关(<0.05);土壤脲酶和蛋白酶活性与其他土壤理化性质间均未达到显著相关。

图2 土壤脲酶与蛋白酶活性时间动态变化

表5 土壤酶活性与土壤理化性质的相关性

3 讨论
生态系统退化导致植被群落发生改变,优势物种逐渐消亡或被其他适应生境变化后的物种所替代,引起根系分泌物、凋落物及水热条件均发生改变[22],而土壤酶主要来源于植物根系分泌、土壤动物分泌和凋落物分解等活动,是土壤氮素循环转化过程中的重要催化剂[23],其中土壤脲酶与蛋白酶活性直接影响到土壤中氮转化的强度以及供氮能力的大小[24]。本研究中,我们发现尕海湿地沼泽草甸退化显著增加了土壤脲酶活性,这与徐静静等[25]在巴音布鲁克天鹅湖高寒湿地的研究结果相同。原因可能是与全氮含量有关,随退化梯度加剧,全氮含量减少,过高的全氮会抑制脲酶的分泌[26],二者间相关性呈现出负相关也进一步予以证实,因此脲酶活性升高。研究还发现土壤蛋白酶活性变化趋势与脲酶活性相反,胡雷等[27]研究认为退化降低了蛋白酶底物来源。由于本研究中未退化梯度植被覆盖度及物种丰富度最高,随退化梯度加剧,地表植被覆盖度下降,地上生物量逐渐减小(表1),植被枯落物与分泌物相应减少;同时土壤水分也相应降低,减少了蛋白酶酶促反应进行的条件与场所,因此在一定程度上限制了蛋白酶底物来源及其底物的扩散速率,蛋白酶活性降低。
在垂直剖面上,除重度退化梯度外,土壤脲酶和蛋白酶活性均随土层深度增加而逐渐降低,这与闫瑞瑞等[28]研究结果一致。一方面是由于土壤表层能够获得较多的植被枯枝落叶物与腐殖质,表层土壤有机碳含量高,有利于微生物生长,其代谢活跃使表层土壤酶活性较高[25];同时土壤温度、水分也随土层的加深而下降(表3),土壤微生物的代谢产酶能力受到限制[29]。另一方面是由于研究区域内植物根系也多存在于土壤表层中[30],地表聚积大量的凋落物,有丰富的土壤有机质供微生物分解吸收,因此表层土壤酶活性较底层高。此外由于高原鼠害的影响,重度退化梯度土层结构发生变化,孔隙度等理化性质有所改变,造成脲酶与蛋白酶活性出现波动变化。可见,沼泽化草甸退化能够显著增加土壤脲酶活性,降低蛋白酶活性的分布变化,进而影响高寒湿地土壤氮素循环转化过程。
土壤酶活性的时间动态变化主要受气候因素与植被生长节律共同影响,气候变化引起土壤温度、水分含量的变化,间接改变微生物的生长和营养物质可利用性,进而影响土壤酶活性的大小[31]。本研究中,土壤脲酶活性在0 ~ 40 cm土层中峰值出现在7、8 月,这是由于7、8 月温度较高,有利于植物新陈代谢速率的加快,根系分泌物含量相应增多[32],促使土壤微生物活动更加旺盛,土壤脲酶活性达到最大值。进入9 月后脲酶活性降低,可能与温度降低有关,低温使微生物的生长、繁殖代谢等活动受到抑制[33],导致其活性降低,而此时中度退化梯度地表具有最多的凋落物[20],增加了土壤中有机物含量,使得中度退化梯度的脲酶活性相对更高。本研究也发现土壤蛋白酶活性在0 ~ 40 cm土层中6、7 月较高,这是由于尕海湿地5 月植被开始返青,但由于气温较低,此时蛋白酶活性主要受低温控制,因此活性偏低;6 月植被地上部分生长相对缓慢,主要的营养物质仍在地下[19],土壤中有机质含量较高,所以蛋白酶活性升高;8 月植被生长进入后期,蛋白酶活性降低;9 月出现回升是因为植被生长后期枯枝落叶与微生物残体进入到土壤中,促使土壤有机质增加,增大了蛋白酶底物浓度水平,使得土壤蛋白酶活性处于上升态势,这与郭嘉等人[34]研究一致。此外不同学者对土壤酶活性的时间变化规律的研究结论尚无定论,如孙英杰等[35]对桂林会仙喀斯特湿地研究发现土壤脲酶活性最大值出现在4 月,蛋白酶活性出现在在9 月;万忠梅和宋长春[36]研究指出脲酶活性峰值出现在秋季;朱颖旸[37]的研究表明崇明东滩湿地蛋白酶活性冬季最低,秋季最高。本研究与大多数学者研究所认为土壤酶活性夏季较高,春、秋季较低的结果相似或者相同[38],但也与研究区域的环境条件、土壤特征和植物种类的不同而产生差异。
土壤酶活性与环境因素关系密切,环境因素可以通过改变土壤微生物的活动或者群落结构从而间接影响土壤酶的活性,调控土壤中一系列营养物质的转化速率[39],直接影响土壤系统营养物质循环。大量研究表明土壤温度是影响土壤酶活性的重要环境因素,温度变化会促使土壤理化过程发生改变,从而影响分泌土壤酶的数量发生变化。本研究发现土壤温度与脲酶和蛋白酶活性均存在显著正相关关系,Sharma和Kumar[40]研究发现高寒生态系统土壤酶活性随增温显著增加,绝大多数土壤酶为蛋白质物质,对温度变化较为敏感,增温提高了微生物的活性和分泌酶的能力,但超过土壤酶的最适温度条件,土壤酶活性会降低,也说明了土壤温度升高可以提高土壤酶活性,酶活性提高能促进土壤氮素的转化。土壤水分是土壤酶活性变化的重要驱动因素[41],本研究表明土壤含水量与土壤蛋白酶活性呈显著正相关关系,可能是沼泽化草甸退化过程中地表土壤裸露程度增大,蓄水保水能力降低,导致土壤干燥,最终抑制了土壤蛋白酶活性,与黄海莉等[42]研究结果一致。另有研究认为土壤酶活性能够间接地影响土壤的养分水平和转化循环状态[34]。本研究中,土壤脲酶活性与铵态氮、微生物生物量氮正相关,而与全氮、硝态氮负相关;土壤蛋白酶活性与微生物生物量氮极显著正相关,而与全氮、铵态氮、硝态氮负相关,结果表明土壤酶活性与土壤养分含量间既有拮抗作用,也有协同作用,存在一定的耦合关系[43],多种因素共同作用于土壤氮素循环转化过程。综上,沼泽草甸退化显著改变土壤理化性质与土壤酶活性,进而影响高寒湿地沼泽草甸生态系统土壤氮素循环。
4 结论
尕海湿地沼泽化草甸随退化梯度加剧,土壤含水量与蛋白酶活性降低,土壤温度与脲酶活性增加。随土层加深,土壤含水量、温度、蛋白酶与脲酶活性(除重度退化梯度外)均降低。0 ~ 40 cm土层中脲酶活性峰值出现在7、8 月,蛋白酶活性出现在6、7 月。土壤脲酶活性与蛋白酶活性和温度极显著正相关;土壤蛋白酶活性与微生物生物量氮极显著正相关,与含水量和温度显著正相关,与硝态氮含量显著负相关。尕海湿地沼泽化草甸退化显著增加了土壤表层脲酶活性而降低了蛋白酶活性,温度对脲酶与蛋白酶活性起促进作用,含水量与微生物生物量氮对蛋白酶活性具有促进作用。
[1] 徐国荣, 马维伟, 宋良翠, 等. 植被不同退化状态下尕海湿地土壤氮含量及酶活性特征[J]. 生态学报, 2020, 40(24): 8917–8927.
[2] Dunn C, Jones T G, Girard A, et al. Methodologies for extracellular enzyme assays from wetland soils[J]. Wetlands, 2014, 34(1): 9–17.
[3] Wang L X, Pang X Y, Li N, et al. Effects of vegetation type, fine and coarse roots on soil microbial communities and enzyme activities in eastern Tibetan Plateau[J]. CATENA, 2020, 194: 104694.
[4] Su Y Z, Li Y L, Cui J Y, et al. Influences of continuous grazing and livestock exclusion on soil properties in a degraded sandy grassland, Inner Mongolia, Northern China[J]. CATENA, 2005, 59(3): 267–278.
[5] Wallenstein M D, Mcmahon S K, Schimel J P. Seasonal variation in enzyme activities and temperature sensitivities in Arctic tundra soils[J]. Global Change Biology, 2009, 15(7): 1631–1639.
[6] Burns R G, DeForest J L, Marxsen J, et al. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216–234.
[7] 王理德, 田青, 郭春秀, 等. 不同退耕年限干旱绿洲植被群落及灰棕漠土特性变化[J]. 土壤学报, 2021, 58(6): 1436–1447.
[8] Schimel J, Becerra C A, Blankinship J. Estimating decay dynamics for enzyme activities in soils from different ecosystems[J]. Soil Biology and Biochemistry, 2017, 114: 5–11.
[9] Dong L L, Sun T, Berg B, et al. Effects of different forms of N deposition on leaf litter decomposition and extracellular enzyme activities in a temperate grassland[J]. Soil Biology and Biochemistry, 2019, 134: 78–80.
[10] 李海云, 张建贵, 姚拓, 等. 退化高寒草地土壤养分、酶活性及生态化学计量特征[J]. 水土保持学报, 2018, 32(5): 287–295.
[11] 李军豪, 杨国靖, 王少平. 青藏高原区退化高寒草甸植被和土壤特征[J]. 应用生态学报, 2020, 31(6): 2109–2118.
[12] 李邵宇, 孙建, 王毅, 等. 青藏高原不同退化梯度草地土壤酶活性特征[J]. 草业科学, 2020, 37(12): 2389–2402.
[13] 蒋永梅, 师尚礼, 田永亮, 等. 高寒草地不同退化程度下土壤微生物及土壤酶活性变化特征[J]. 水土保持学报, 2017, 31(3): 244–249.
[14] Liu L F, Chen H, Jiang L, et al. Water table drawdown reshapes soil physicochemical characteristics in Zoige peatlands[J]. CATENA, 2018, 170: 119–128.
[15] 胡容, 叶春, 蒲玉琳, 等. 若尔盖高寒沼泽湿地退化过程中土壤有机氮组分的演变特征[J]. 土壤学报, 2019, 56(6): 1425–1435.
[16] 唐艳梅, 马维伟, 李广, 等. 尕海湿地退化演替过程中土壤有机氮组分的变化特征[J]. 应用生态学报, 2021, 32(11): 4077–4084.
[17] 马维伟, 孙文颖. 尕海湿地植被退化过程中有机碳及相关土壤酶活性变化特征[J]. 自然资源学报, 2020, 35(5): 1250–1260.
[18] Ma W W, Alhassan A R M, Wang Y S, et al. Greenhouse gas emissions as influenced by wetland vegetation degradation along a moisture gradient on the eastern Qinghai-Tibet Plateau of North-West China[J]. Nutrient Cycling in Agroecosystems, 2018, 112(3): 335–354.
[19] Wu J Q, Wang H Y, Li G, et al. Vegetation degradation impacts soil nutrients and enzyme activities in wet meadow on the Qinghai-Tibet Plateau[J]. Scientific Reports, 2020, 10(1): 21271.
[20] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.
[21] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
[22] Cao R, Wei X, Yang Y, et al. The effect of water table decline on plant biomass and species composition in the Zoige peatland: A four-yearfield experiment[J]. Agriculture, Ecosystems & Environment, 2017, 247: 389–395.
[23] 闵凯凯, 何向阳, 吴倩怡, 等. 参与碳氮磷转化的水解酶对不同施肥响应的差异[J]. 土壤, 2020, 52(4): 718–727.
[24] Du E, Terrer C, Pellegrini A F A, et al. Global patterns of terrestrial nitrogen and phosphorus limitation[J]. Nature Geoscience, 2020, 13(3): 221–226.
[25] 徐静静, 刘隋赟昊, 朱新萍, 等. 巴音布鲁克天鹅湖高寒湿地不同水分梯度土壤微生物及酶活性的差异[J]. 新疆农业大学学报, 2017, 40(5): 337–344.
[26] 张莹, 刘畅, 宋昂, 等. 基于典范对应分析的会仙岩溶湿地土壤理化性质与土壤酶活性关系研究[J]. 中国岩溶, 2016, 35(1): 11–18.
[27] 胡雷, 王长庭, 王根绪, 等. 三江源区不同退化演替阶段高寒草甸土壤酶活性和微生物群落结构的变化[J]. 草业学报, 2014, 23(3): 8–19.
[28] 闫瑞瑞, 闫玉春, 辛晓平, 等. 不同放牧梯度下草甸草原土壤微生物和酶活性研究[J]. 生态环境学报, 2011, 20(2): 259–265.
[29] 王小燕, 姚宝辉, 张彩军, 等. 甘南“黑土滩”型退化草甸土壤理化特性及酶活性季节变化[J]. 草地学报, 2021, 29(2): 220–227.
[30] Ma W W, Li G, Wu J H, et al. Response of soil labile organic carbon fractions and carbon-cycle enzyme activities to vegetation degradation in a wet meadow on the Qinghai-Tibet Plateau[J]. Geoderma, 2020, 377: 114565.
[31] 刘超, 赵光影, 宋艳宇, 等. 气候变化背景下湿地土壤酶活性研究进展[J]. 中国农学通报, 2019, 35(33): 91–97.
[32] Wang X M, Yan B G, Fan B, et al. Temperature and soil microorganisms interact to affectgrowth on mountainsides[J]. Plant Ecology, 2018, 219(7): 759–774.
[33] 许可. 氮、磷添加对高寒泥炭湿地温室气体排放的影响及其酶学机制研究[D]. 北京: 北京林业大学, 2017.
[34] 郭嘉, 陈纪香, 于一雷, 等. 黄河三角洲湿地典型盐生植物群落土壤酶活性研究[J]. 湿地科学与管理, 2020, 16(1): 55–59.
[35] 孙英杰, 徐广平, 沈育伊, 等. 桂林会仙喀斯特湿地芦苇群落区土壤酶活性[J]. 湿地科学, 2018, 16(2): 196–203.
[36] 万忠梅, 宋长春. 三江平原小叶章湿地土壤酶活性的季节动态[J]. 生态环境学报, 2010, 19(5): 1215–1220.
[37] 朱颖旸. 崇明东滩湿地四种典型生境土壤胞外酶活性及影响因素[D]. 上海: 华东师范大学, 2020.
[38] 王理德, 王方琳, 郭春秀, 等. 土壤酶学硏究进展[J]. 土壤, 2016, 48(1): 12–21.
[39] Zhu X M, Liu M, Kou Y P, et al. Differential effects of N addition on the stoichiometry of microbes and extracellular enzymes in the rhizosphere and bulk soils of an alpine shrubland[J]. Plant and Soil, 2020, 449(1/2): 285–301.
[40] Sharma N, Kumar S. Nitrogen transformation rates in the Himalayan soils at different temperature and elevation conditions[J]. Journal of Soils and Sediments, 2021, 21(1): 13–26.
[41] 罗琰, 苏德荣, 吕世海, 等. 辉河湿地河岸带土壤养分与酶活性特征及相关性研究[J]. 土壤, 2017, 49(1): 203–207.
[42] 黄海莉, 宗宁, 何念鹏, 等. 青藏高原高寒草甸不同海拔土壤酶化学计量特征[J]. 应用生态学报, 2019, 30(11): 3689–3696.
[43] 马书琴, 汪子微, 陈有超, 等. 藏北高寒草地土壤有机质化学组成对土壤蛋白酶和脲酶活性的影响[J]. 植物生态学报, 2021, 45(5): 516–527.
Temporal and Spatial Distribution Characteristics of Soil Urease and Protease Activities in Different Degraded Gradients of Gahai Wetland
CHANG Wenhua, MA Weiwei*, LI Guang, XU Guorong, SONG Liangcui
(College of Forestry, Gansu Agricultural University, Lanzhou 730070, China)
In order to investigate the effect of alpine wetland degradation on soil enzyme activities, this paper investigated the spatial and temporal characteristics of soil urease and protease activities in 0–10, 10–20 and 20–40 cm layers in Gahai wetlands on the eastern edge of the Qinghai-Tibetan Plateau with four different degraded gradients: not degraded, slightly degraded, moderately degraded and severely degraded. The results showed that soil water content decreased but temperature increased with the increase of the degradation. Soil urease activity decreased but protease activity increased gradually with the increase of degradation in the 0–40 cm layer; Except for severely degraded, the two enzyme activities decreased with the increase of soil depth. The activity was the highest in the 0–40 cm layer in July and August for urease and in June and July for protease, respectively; Soil urease activity was positively correlated with protease activity and temperature (<0.01), while soil protease activity was positively correlated with microbial nitrogen (<0.01), water content and temperature (<0.05), and negatively correlated with nitrate nitrogen (<0.05). The degradation of marshy meadows significantly increased urease activity but decreased protease activity in topsoil; temperature promoted soil urease and protease activities, and water content and microbial nitrogen promoted soil protease activity.
Gahai wetland; Swampy meadow; Soil urease activity; Soil protease activity; Degeneration
S154.2
A
10.13758/j.cnki.tr.2022.03.012
常文华, 马维伟, 李广, 等. 尕海湿地不同退化梯度土壤脲酶与蛋白酶活性时空分布特征. 土壤, 2022, 54(3): 524–531.
国家自然科学基金项目(31860143)、甘肃省教育厅青年博士基金项目(2021QB-024)和甘肃农业大学青年导师基金项目(GAU-QDFC-2021-11)资助。
(mww-007@163.com)
常文华(1997—),男,甘肃临夏人,硕士研究生,主要从事退化湿地生态研究。E-mail: changwh@st.gsau.edu.cn

