基于核磁共振技术的合欢种子吸水特性
杜恬恬 代 松 钱 滕 朱铭玮 陈 丽张中会 李淑娴
(1.南京林业大学南方现代林业协同创新中心 南京 210037; 2.铜仁科学院 铜仁 554300;3.安徽林业职业技术学院 合肥 230031; 4.苏州泰纽测试服务有限公司 苏州 215163)
核磁共振(Nuclear magnetic resonance,NMR)是指具有固定磁矩的原子核在恒定磁场与交变磁场作用下,与交变磁场发生能量交换的现象(Chenetal., 2020)。近年来,核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)和核磁共振成像(magnetic resonance imaging,MRI)技术作为核磁共振的两个分支,凭借着其快速、准确、无损的特点,在医学、化学、生物学等领域得到广泛应用(Scheenenetal.,2000; Köckenberger, 2001; Köckenbergeretal., 2004; 王振华等, 2014)。NMR技术主要是通过测得样品中氢质子密度与分布,得到T1、T2值(T2横向弛豫时间,T2的长短可以反应样品内部水分自由度的大小即水分的相态),用其反映样品中水分的相态分布及含量(Takeuchietal., 1997),如水稻(Oryzasativa)浸种过程中水分相态及含量的变化(宋平等, 2015)、欧洲油菜(Brassicanapus)种子萌发过程中水分相态的变化(Lechowskaetal.,2019)。随着核磁共振技术的发展,MRI成像技术能确定种子的初始吸水位点,并能判断水分在种子内部的迁移规律,在种子吸水研究中的应用越来越普遍(Volkovetal., 2019)。烟草(Nicotianatabacum)种子吸水在萌发的第二和第三阶段吸水是不均匀的(Manzetal.,2005); 如利用MRI技术确定大豆(Glycinemax)种子的吸水的主要吸水位点(Koizumietal., 2008); 明确向日葵(HelianthusAnnus)种子在吸水不同阶段的水分分布规律(Rani,2014)。
合欢(Albiziajulibrissin)是含羞草亚科(Mimosaceae)合欢属落叶乔木,适应性强,生长速度快,其树冠开展,树姿优美,盛夏绒花满树,广泛用作庭院树、行道树。合欢主要用种子繁殖,但该种子硬实,种皮表面的蜡质严重影响了吸水作用,导致出苗不整齐,最终阻碍育苗顺利进行(韩多红等, 2016)。吸水是种子萌发的先决条件,研究种子吸水过程的传统方法是采用染色法(Huetal., 2008)或吸水曲线法(周健, 2015),前者需将种子切开根据颜色变化推断种子吸水情况,属于破坏性测定; 后者只能定量分析种子各部位吸水量随时间的变化(霍仕平等, 2004),无法判断不同种子部位的水分分布差异及动态迁移过程。鉴于此,本研究应用低场核磁共振及其成像技术,探究合欢种子初始吸水位点和吸水后种子内的水分迁移规律,测定不同吸水时间合欢种子的T2值,判断吸水过程中的水分相态变化,旨在为深入了解合欢种子生物学及吸水特性提供理论依据。
1 材料与方法
1.1 试验材料及处理
2018年11月于江苏宿迁采集合欢种子,剔除虫害粒、种皮受损粒,再水选去除空粒,剩余饱满种子在室内自然阴干后保存在4 ℃冰箱中待用,于2018年12月开始相关试验。试验用种子的千粒质量为(36.06±1.31)g; 含水量为11.4%±0.2%; 生活力为95.02%。
1.2 种子吸水率的测定
随机取合欢种子30粒,3个重复,用千分之一天平称自然阴干种子初始质量(m1,g)。按陈丽等(2019)的方法,用初始温度80 ℃的热水浸种5 min后,将种子置于装有清水的烧杯中使其吸水。分别于吸水后2、4、6、8、10、12、24 h后取出种子,用吸水纸擦拭种子表面水分后称取浸种后质量(m2,g); 之后将种子重新置于装有清水的烧杯中,重复上述操作,直至种子达到吸水平衡。对照种子未进行热水处理,直接浸种,时间相同。按下式计算种子的吸水率,绘制吸水曲线。
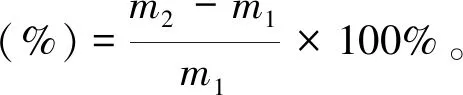
(1)
1.3 MRI技术确定种子吸水位点及吸水后的水分迁移路径
随机选取3颗不同吸水时间后的种子,对吸水过程进行MRI成像观察。将装有种子的玻璃试管置于梯度磁场中按受射频脉冲的激发,产生磁共振,通过对梯度磁场进行相位和频率的编码,经过计算机处理获得其横切面的二维层面图像。核磁共振扫描仪(Verios 7 T,德国Siemens 公司)主频率为300.337 MHz,主要参数为: 视野FOVRead=FOVPhase=2.8 cm; 重复时间TR=2 000 ms; 回波时间TE=13 ms,以FID格式保存成像结果。
1.4 T2弛豫总信号幅值与种子水分质量的关系
采用硬脉冲回波序列(carr-purcell-meiboom-gill, CPMG)测定吸水过程中的种子,用SIRT(联合迭代重建技术)算法反演操作,得到T2弛豫图谱及峰面积,峰面积反映了种子内的含水量(彭宇飞, 2018)。随机取出一定数量的种子(>300粒),按前面所述方法进行浸种和吸水不同时间后,取出30粒种子,每10粒为1个重复,擦干表面水分,装入玻璃试管中,放置在低场核磁共振仪中检测。再将种子拿出后称重,之后放入103 ℃烘箱中干燥至恒质量,从而得到种子的水分质量。通过回归分析,确定T2弛豫谱总峰面积与种子水分质量的回归方程,并通过R2检验回归方程的拟合效果。
1.5 NMR技术测定种子吸水过程中各相态水分含量的变化
参照1.4 中的方法得到T2弛豫图谱,具体为: 用初始温度80 ℃的热水浸种5 min后,将种子置于装有清水的烧杯中,分别于吸水0、2、4、6、8、10、12、24、36、48 h后取出种子,擦干表面水分,在低场核磁共振仪中检测,每个重复取10粒种子,重复采样3次。测定后立刻将种子放入清水中继续浸种。CPMG脉冲序列的主要参数: 主频SF=23 MHz,偏移频率Ο1=347 207 Hz,90°脉冲射频脉宽P1=8 us,180°脉冲射频脉宽P2=15.52 us,信号采样点数TD=320 008,重复采样等待时间TW=3 000 ms,重复采样次数NS=16,回波时间TE=0.2 ms,回波个数NECH=8 000。
1.6 数据分析
利用Excel对整理采集的数据,用SPSS 22.0对测定指标进行方差分析、相关性分析; 采用OriginPro 8.5和Photoshop CS6软件作图和处理。

图1 合欢种子的吸水曲线Fig. 1 Absorption curves of A. julibrissin seeds during imbibition数值为(M±SE),下同。Each value is the mean ± standard error (SE) of three replicates. The same below.
2 结果与分析
2.1 合欢种子的吸水曲线
由图1可知,热水处理后的合欢种子吸水过程呈“S”型,在0~4 h,吸水率仅缓慢增加至17.30%。之后进入快速吸水阶段(4~12 h),其中在8 h后快速增至94.10%。之后进入缓慢吸水阶段,在24 h后缓慢增至106.40%,并逐渐趋于平衡。在24~48 h内,吸水极为缓慢,在48 h时增至107.29%,仅增加了0.89%。基于这个吸水过程,可确定后续试验选取的时间点。
2.2 种子吸水过程中核磁成像结果分析
合欢种子吸水过程中纵截面(冠状面)的核磁共振成像见图2。核磁共振成像得到的种子内部质子密度加权图像可较好反映样品中H质子的分布。通常H质子越密集的区域,加权图像越明亮(图中显示白色)。在种子吸水过程中,其内部的H质子主要来源于水分子,因此加权图像明亮的区域表明含水量较高即吸水较多,通过观测图像的灰度可判断吸水过程中水分在种子体内的移动规律。
合欢种子吸水过程核磁共振成像见图2。干种子的颜色较暗(图2A),含水量很低。吸水2 h时,种子上半部分明显胀大(图2B),说明此部位已开始吸水。从MRI图片的冠状面还可知,种孔处有个小亮点,胚根尖端及其周围小部分子叶区域也开始变亮。结合种子的结构(陈丽等, 2019)可发现,从种孔处吸收的水分,一部分沿着种皮右侧的维管束向合点端移动; 另一部分到达胚根尖端的水分,沿着种皮与子叶的缝隙向合点端移动的同时,还向子叶中扩散,故胚根尖端及其周围的子叶变得较亮,且右侧子叶变亮区域更大,致使右侧种皮的吸胀面积明显大于左侧; 此时胚轴还是比较暗,没有水分进入。吸水4 h时,胚根尖端更加明亮,且绝大部分胚轴也开始变亮(图2C),说明到达胚根尖端的水分又多了一条移动路径(即进入到胚轴中); 此时左侧种皮中间也出现一条明亮的窄长区域。这些明亮区域的变化,清晰地说明了从种孔进入种子内水分的移动规律。吸水8 h时,种子内部的水分持续增加,吸胀部位已超过二分之一,已吸胀部位的子叶与种皮的边界更加明显(图2E)。左侧种皮的吸水通道更加清晰可见,水分在左侧子叶加速移动致使两侧子叶的吸水面积差异不大。胚根明显胀大,胚轴的轮廓更加清晰,进入胚轴的水分继续向子叶的中心移动,此时中间部分的子叶也开始变亮,但水分移动距离明显短于两侧的子叶。吸水12 h时,整粒种子已充分胀大,胚的各部位都较之前更明亮。至24 h时,子叶与种皮的界限更明显(图2G)。此时水分虽已充满整粒种子,但不同部位的明亮程度即水分含量并不相同: 靠近左右两侧种皮的子叶比中间绝大部分更明亮,水分更充盈; 胚轴比绝大部分子叶明亮。
2.3 种子吸水过程中T2弛豫时间与水分相态的划分
种子吸水过程中横向弛豫时间T2的反演图谱如图3。根据核磁技术的原理,T2为横向弛豫时间,T2的长短可以反应样品内部水分自由度的大小即水分的相态。弛豫时间越短,水分的自由度越低,反之,弛豫时间越长,水分自由度越高(宋平等, 2018),而峰面积的变化反映该相态水分含量的变化。
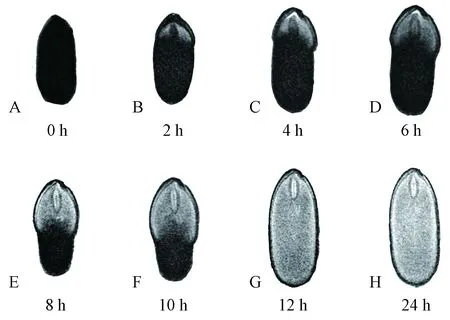
图2 合欢种子吸水过程中的核磁共振成像图Fig. 2 NMR images of A. julibrissin seed after soaking in the coronal plane
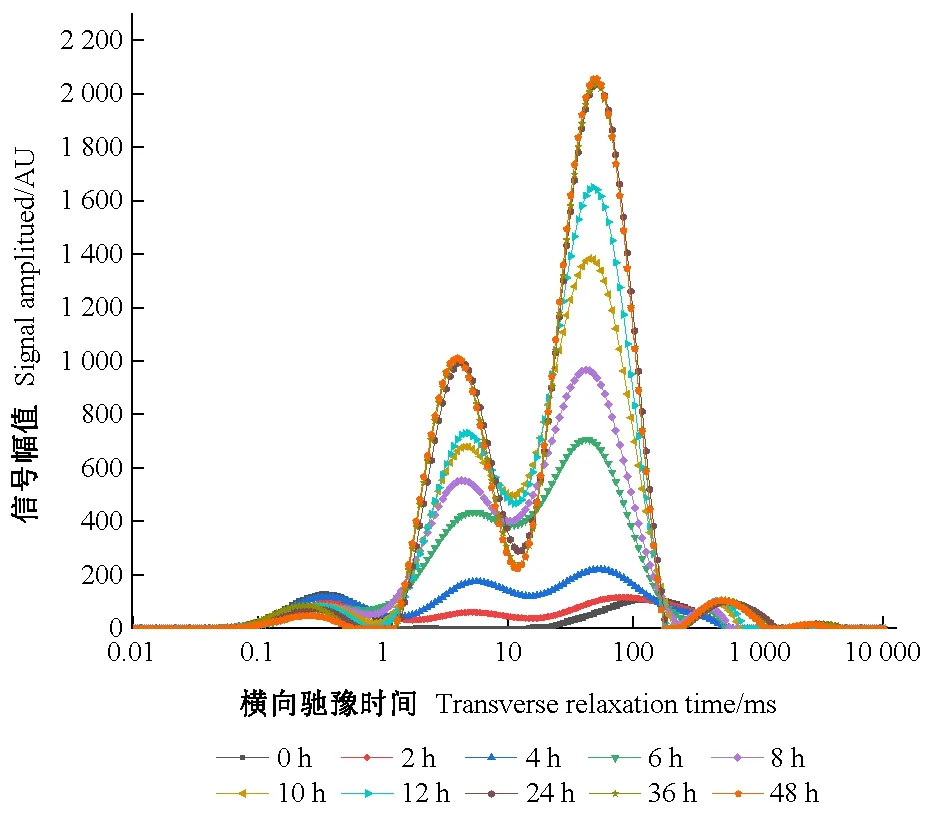
图3 吸水不同时间段合欢种子的T2反演图谱Fig. 3 Spectrum inversion of transverse relaxation time T2 of A. julibrissin seed during imbibition
由图3可知,不同吸水阶段的合欢种子,其T2变化范围主要在0.1~1 000 ms,在该范围内出现了3个有规律的峰和1个无规律的峰,从左往右各峰值所在区间对应的T2弛豫时间分别为T2a、T2b、T2c、T2d,种子存在4种不同状态的水。其中弛豫时间最短的T2a(0.1~1 ms)为种子内的结合水(bound water),该状态水主要是种子内部被淀粉、蛋白质等大分子包围或在细胞内通过氢键吸附于大分子物质上的水,流动性差,只能缓慢运动;T2b(1~10 ms)为种子的胞内水(cytoplasmic bulk water, immobile water),主要是被毛细管作用束缚或被淀粉等大分子颗粒表面的羟基氢质子快速交换形成的水分,其流动性虽受到一定限制,但略高于结合水; 弛豫时间较长的T2c(10~100 ms)为胞外自由水(extra-cellular free water),生物体内或细胞内可自由流动,暂时不会被植物细胞内胶体颗粒或大分子所吸附,主要起溶剂作用;T2d(>100 ms)为刚进入种子内部的水分,流动性极强,活性极大(宋平等, 2015)。
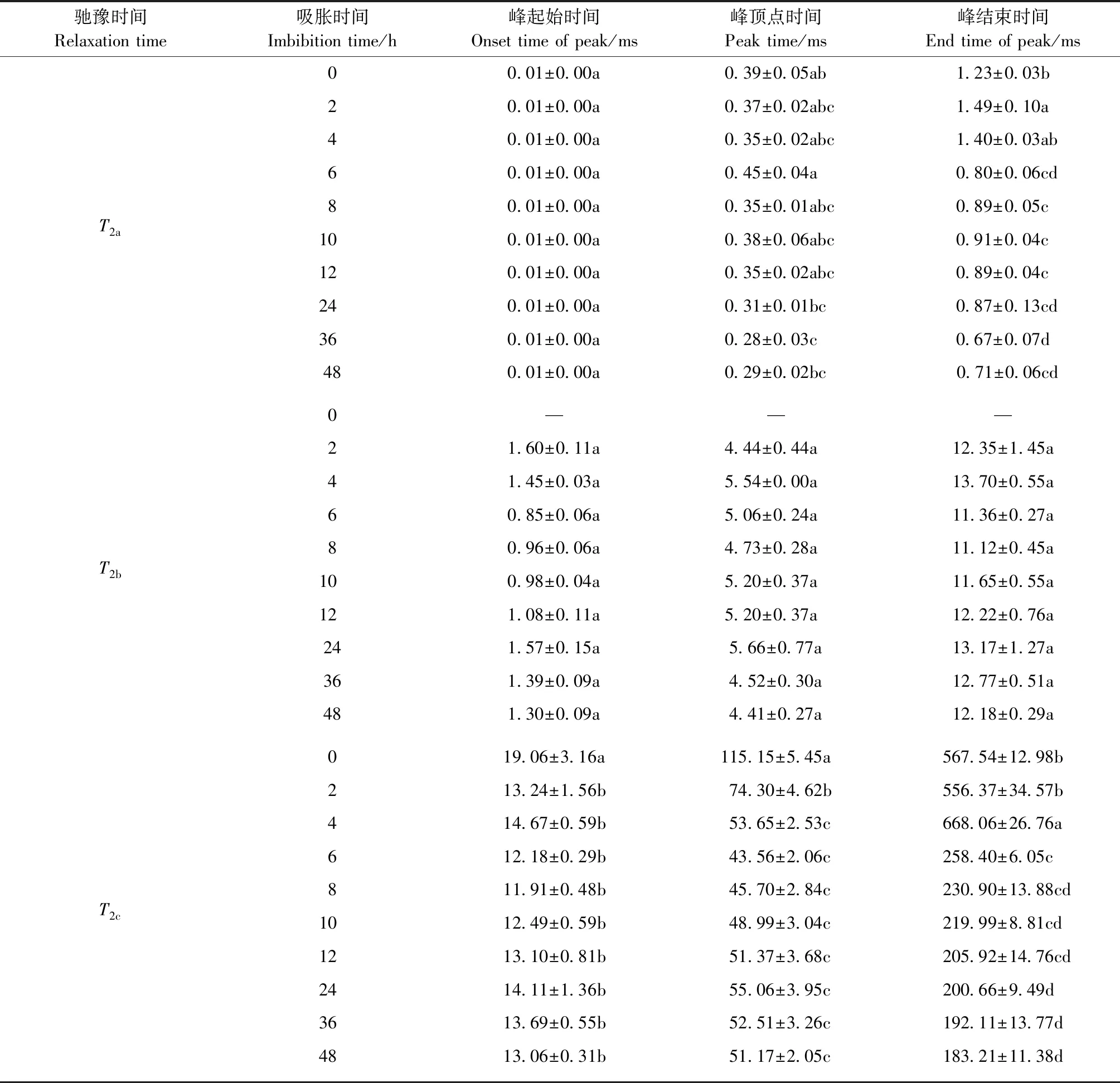
表1 不同吸水阶段合欢种子的T2反演表Tab.1 T2 inversion of A. julibrissin seeds at different imbibition stages
合欢种子吸水过程中T2横向驰豫时间及信号幅值的变化见表1。由于T2d在吸水过程中变化不大,并且该状态的水主要是刚进入种子内部残留在种皮间隙的水的信号量,不属于被种子营养组织吸附的水分,故表1、表2未计算此部分。吸胀过程中,结合水T2a峰的起始时间无显著变化,但峰顶点时间及峰结束时间却在不断下降,有左移现象: 吸水24 h时,峰顶点时间明显向左偏移; 而峰结束时间则在吸水6 h时即开始显著左移。0 h的种子即热水处理后的种子,胞内水含量很低,可忽略不计。随吸水时间的延长,作为胞内水的T2b,该峰的起始时间、峰顶点时间、峰结束时间呈波动变化趋势,但所有结果差异不显著; 相比上述2个峰,流动性较强的T2c在各测定时间点的变化较大,吸水2 h时,峰起始时间由0 h的19.06 ms显著下降到13.24 ms,随后各峰起始时间点呈波动变化,但差异均不显著; 吸水初期,峰顶点时间也呈下降趋势,特别在0~2 h时下降的幅度更大些,由0 h的115.15 ms显著下降到74.30 ms,2~4 h时峰顶点仍为显著下降,随后峰顶点时间逐渐趋于稳定; 随吸水时间延长,峰结束时间在0~2 h首先略有下降,但差异不显著。2~4 h时显著上升,但在6 h时突然迅速下降,由4 h时的668.06 ms显著下降到258.40 ms。吸水6 h后,峰结束时间呈缓慢下降的变化趋势。因此,T2c的峰在整个吸水过程中明显左移,说明浸种过程中胞外自由水中氢质子的自由度在降低,水分的流动性逐渐减弱。
2.4 核磁共振T2弛豫总信号幅值与种子水分质量的关系
由图4可知,种子核磁共振弛豫图谱峰面积(S)与水分质量(X,g)线性拟合关系:S=21 132X+695.05,R2=0.999 6,拟合较好。因此,可用峰面积反映种子内水分含量。
2.5 种子吸胀过程中各相态水分相对含量的动态变化
吸水过程中种子各峰面积比例的动态变化见表2。T2a、T2b、T2c对应的峰面积即各相态水的含量,分别用S2a、S2b、S2c表示,峰面积比例为某一状态水的峰面积与总峰面积的比值。在吸胀过程中,合欢种子的峰面积S2a、S2b、S2c处于动态变化中。结合水S2a在前期0~4 h内呈现上升趋势,但各峰面积差异不显著; 6 h时峰面积突然显著下降,由4 h时的3 022.60下降到1 537.42,下降了49.14%,随后S2a呈波动变化; 48 h时的结合水峰面积由初始吸水阶段的2 751.16降低至测定过程的最低值1 210.71,下降55.99%(P<0.05),说明浸种过程中结合水含量在明显减少。S2b的变化与S2a大不相同,随浸种时间延长呈逐渐增加趋势。在前期吸水阶段峰面积快速增加,由吸水2 h时的1 502.58增加至6 h的10 879.07,增加了624.03%; 浸种6 h后,S2b上升速度变慢,但整体仍呈显著增加趋势; 浸种36 h时,S2b较2 h时增加了1 061.45%; 浸种48 h时,S2b略有下降,但较36 h时差异不显著。在吸水前期(0~4 h),胞外自由水S2c虽呈增加趋势,但差异不显著; 在吸水4~10 h过程中,S2c进入迅速增加阶段,且相邻两阶段之间差异显著(P<0.05),在10 h时的峰面积增至32 103.99,较0 h时增加了884.20%; 随后S2c峰面积增加速度开始放缓,在48 h时增至39 948.16,较0 h时增加1 124.68%。

图4 合欢种子核磁共振T2弛豫峰面积与水分质量之间的回归关系Fig. 4 Relationship between NMR peak area of T2 relaxation spectrum and thewatermass of A. julibrissin seeds
吸水过程中,合欢种子各峰面积的比例即各吸水阶段每一相态水的相对含量在不断变化。结合水S2a的峰面积比例呈先快速下降(0~6 h)再逐渐缓慢下降(6~48 h)趋势: 0 h时种子内结合水较多,占水分总量的45.13%; 6 h后迅速下降至4.80%; 48 h时仅为2.08%。浸种过程中,种子中胞内水S2b的比例呈先迅速增加后逐渐减小的变化趋势,浸种2 h时种子内开始出现较多的胞内水,比例迅速增加到17.09%; 6 h时进一步增到33.98%; 8 h时为31.29%,较6 h时略有下降; 随后几个测定时间段,胞内水比例基本维持在30.00%左右。种子内胞外自由水在0 h时占53.51%,说明热水处理后合欢种子中主要的水分为胞外自由水; 在最初吸水阶段(0~4 h)胞外自由水S2c的比例变化不大,都在50.00%左右; 吸水6 h时迅速增至61.22%,10 h时达67.43%; 10 h后基本稳定在67.00%以上。总的来说,种子内部不同相态水的比例在吸水过程中呈动态变化,即种子内部不同相态的水分存在相互转化关系,并且胞外自由水的含量远高于其他相态的水。

表2 浸种过程中合欢种子各峰面积及其比例的变化Tab.2 The changes of peak area of A. julibrissin seeds
3 讨论
3.1 种子的初始吸水位点
植物体内各部位水分(也就是说氢质子)的分布并不均匀,因此用MRI技术可得到亮度不同的图像,进而分析植物体内水分分布情况(张新宇, 2020)。本研究用核磁共振成像技术观察合欢种子吸水过程, 吸水2 h时种孔首先变亮,是初始吸水位点。但陈丽等(2019)采用苯胺蓝染色法发现种脊是合欢种子的初始吸水位点。这可能由于合欢种子太薄,核磁共振仪无法以种脊为核心扫描其吸水情况,因此种脊和种孔在初始吸水时的作用还有待进一步研究。不同植物种子的种皮结构不同,初始吸水位点也不同(Turneretal., 2009; Grazielaetal., 2017)。Baskin(2003)发现豆科(Leguminosae)植物种子的吸水位点大多数是种脊,但加拿大紫荆(Cerciscanadensis)(张琪等, 2020)和薄叶腊肠树(Cassialeptophylla)是种孔(De Paulaetal., 2012),象牙花(Erythrinaspeciosa)(Delgadoetal, 2015)和凤凰木(Delonixregia)(Jaganathanetal., 2017)为种脐。
3.2 吸水后水分在种子中的移动路径
通过MRI图像发现,进入种孔的水分一部分沿着种皮两侧的维管束向合点端移动; 到达胚根尖端的水分,又有如下移动路径: 一部分沿种皮与子叶的缝隙向合点端移动,并进入子叶的外侧; 还有一部分水分由胚根尖端进入胚轴中,并向子叶中移动。Kaori等(2006)发现小豆(Vignaangularis)种子吸水后水分主要通过种皮和子叶的空隙部分运输。不同植物种子的种皮结构不同,水分移动路径也就不同。Koizumi等(2016)发现刺槐(Robiniapseudoacacia)种子吸水中的水分通过种脊进入种子后,以两条途径移动,一条通过种脐缓慢迁移至胚根,另一条经过合点端后继续沿着种脐对面的种皮到达胚轴。
在本研究中,吸水初期(0~6 h),合欢种子右侧吸胀面积较左侧稍大。由合欢种子的解剖结构(陈丽等, 2019)可发现,两侧种皮中虽都存在维管束结构,但右侧维管束直接连接种脐区域,而维管束又利于水分运输(郭学民等, 2020; 张琪等, 2021),这可能是初期右侧种子吸水较快的主要原因。本研究通过MRI图像还发现,水分在子叶外侧的移动速度比中间部分快些。陈丽等(2019)采用TTC染色法也发现合欢子叶外侧最先染成红色,后向中间扩散。种子结构、营养物质的种类不同,水分移动速度也不同(Kikuchietal., 2006; Malgorzataetal., 2007; Koizumi, 2014)。合欢种子热水处理后浸种24 h即可完全胀大,水分之所以能如此迅速进入种子,是因合欢种子主要由种皮和胚两部分组成,其中子叶在整个种子中占有很大的比例,而子叶又以蛋白质为主,蛋白质表面分布着许多-COOH,-OH,-NH2等亲水基团,这些基团对水有很强亲和性(金银根, 2010)。而豆科其他植物的种子,如紫荆(C.chinensis),由于存在胶状胚乳残余组织,完全吸胀所需时间较长(周健, 2016)。
3.3 吸水过程中水分相态的变化
吸水是水分子与种子内大分子物质结合的过程。植物体内氢质子的状态反映了水分的分布与束缚程度(贾超, 2018)。根据T2变化范围,可将合欢种子中的水区分为胞外自由水、胞内水和结合水3种相态,这与多数植物种子的水分组成相似(Malgorzataetal., 2007; 李然等, 2009; Anantaetal., 2012)。但吸水过程中,各相态水的峰面积即含水量变化规律并不相同: 合欢种子胞外自由水和胞内水的峰面积呈“S”型增加趋势,而结合水的峰面积在前期(0~4 h)略有上升,但差异不显著,6 h时峰面积突然显著下降,随后波动下降,所以总的来说结合水呈下降趋势,这与玉米(Zeamays)种子萌发过程中的结合水变化趋势相同(彭宇飞, 2018)。
吸水过程中种子内不同相态水分是可相互转化。 在0 h时,合欢种子内部的水分多为胞外自由水。随着浸种时间延长,胞外自由水含量虽在持续上升(峰面积在增加),但比例却略有下降,这主要是由于部分胞外自由水与种子中的一些大分子物质结合,转化为起溶剂作用的胞内水(宋平等, 2016)。当胞内水的含量增加后,种子中的细胞开始活化,代谢更加旺盛,可溶性小分子物质的浓度增加,当胞内水达到一定饱和程度后种子就具备了萌发条件。浸种过程中水稻种子各相态水分的变化规律与合欢种子类似(宋平等, 2015),而彭宇飞(2018)发现玉米(Zeamays)种子萌发中的结合水峰面积也就是含量呈现先迅速增加后逐渐减小的趋势,胞内水含量持续上升,胞外自由水含量则为先减小后持续增加的趋势,这可能由于玉米种子在吸水过程中,大部分淀粉分解为葡萄糖,可溶性蛋白质被直接氨基酸化,非可溶性蛋白被水解成水溶性较小的小分子物质,水分大量参与细胞活化,与种子中的亲水胶体结合。吸水过程中结合水T2a的峰顶点、峰结束时间发生左移,也就是说吸结合水的流动性在减弱,这主要是由于吸水过程中结合水含量下降幅度较大,所剩结合水较少,为了吸附种子中的大分子物质,需使T2a束缚能力进一步增强,从而造成峰左移,宋平(2016)对水稻浸种过程中的水分研究也得出相同结论。胞外自由水T2c在吸水0~6 h内也明显发生峰左移,可能是胞外自由水开始向胞内水转化,种子内的蛋白,淀粉等物质活化增多,水分胶合更加紧密,结合能力更强,合欢种子吸水6 h时,结合水的含量陡然下降,胞外自由水的含量急剧上升,可能与代谢物质突然变化有关,具体原因有待进一步研究。但是在糙米浸种过程中,3个峰则随着时间推移,向右移动,这可能因糙米是淀粉类种子,内部淀粉等大分子物质吸水膨胀,细胞间隙变大,使得氢质子所受束缚力下降(刘潇等, 2018)。
4 结论
1) 运用MRI技术无损观察了合欢种子吸水规律: 种孔为初始吸水位点,水分由种孔进入后在向合点端移动的过程中主要有3条路径: 一是水分进入种皮,通过两侧维管束运输; 二是水分到达胚根,通过种皮与子叶的缝隙迁移至合点端,同时进入子叶外侧; 三是通过胚根进入胚轴,经子叶向合点端移动。水分在子叶外侧的移动速度比中间部分快。
2) 回归分析发现,合欢种子水分质量与峰面积呈很好的线性关系:S=21 132X+695.0,R2=0.996 8。
3) 用T2反演图谱可区分出种子内部水分的相态,浸种过程中合欢种子主要存在3种相态的水,分别为结合水、胞内水和胞外自由水。
4) 合欢种子吸水过程结合水含量逐渐减少,比例整体呈下降趋势; 胞内水含量呈上升趋势,所占比例先上升后逐渐稳定。胞外自由水与胞内水变化趋势尽管相同,但胞内水含量增加更显著。各相态的水分在吸水过程中一直在相互转化,含量处于动态变化之中。