皂荚与野皂荚刺中次生代谢物的差异*
耿瑜欣 李红姣 郑建伟 张 芹 于丽娜 李佳秋 李保会
(1.河北农业大学林学院 保定 071000; 2.河北农业大学园林与旅游学院 保定 071000)
皂荚属(Gleditsia)是双子叶植物纲、蔷薇目、豆科植物,约12种,多分布于热带和温带地区(兰彦平等, 2006),中国原产8种,引进1种,分布与栽培于我国各个省区,覆盖区约占国土面积的50% (顾万春等, 2003),喜光,稍耐荫,具有较强的耐旱性,多生于山坡林中或谷地、路旁,属深根性植物,在微酸性、石灰质、轻盐碱土甚至粘土或砂土也能正常生长,寿命可达六七百年(范理璋, 2008)。皂荚树的干燥棘刺,又称皂刺、皂针等,中国药典中记载: 皂刺有消肿、脱毒、排脓和杀虫等功效。用于痈疽初起或脓成不溃; 外治疥癣麻风(国家药典委员会, 2020),是传统的药材用料。
近年来,国内外众多学者发现皂刺中含有黄酮、酚酸、香豆素、甾醇、内酯、三萜皂苷等多种成分,具有抗氧化(宋忠兴等, 2019)、抗菌(Lietal., 2016)、抗癌(Parketal., 2014)、提高免疫力等作用,因此皂刺在临床上应用非常广泛(张妍等, 2017; 刘伟杰, 2013),且皂刺的萜类化合物在工业上也发挥着重要作用(Jiangetal., 2007)。因其综合利用价值高,供需不平衡,导致皂荚树种植面积迅速扩大,但由于过分关注前期效益,皂荚栽培过程中出现种类杂乱、低产量、低质量等问题,影响了皂荚产业的发展和效益的提升。
代谢组学用于特定时期生物体内所有代谢物的定性和定量分析,研究对象多为相对分子质量小于1000的小分子物质(杨军等, 2005)。植物代谢组学分析的对象包括初级代谢产物和次级代谢产物。前者主要包括碳水化合物、氨基酸、普通脂肪酸、核酸等,是维持植物生长和生命活动的必需物质(Bourgaudetal., 2001),后者的产生受发育程度、组织分化和影响生物合成基因表达的外界刺激因素的控制(邱立友等, 2010),它的产生和分布通常与物种、器官、组织和生长阶段有关(Vinaleetal., 2010)。许多植物的活性药用成分都是其中的次生代谢物,并且在人工种植条件下,产量有赖于初级代谢产物的积累,品质取决于次生代谢产物的积累。植物次生代谢的过程是保证药用成分质量和有效性的基础(苏文华等, 2005)。近年来,众多学者利用代谢组学的方法研究苦荞(Fagopyrumtataricum)(Lietal., 2019)、银杏(Ginkgobiloba)(Mengetal., 2019)、柑橘(Citrusreticulata)(Wangetal., 2019)等植物中代谢产物的差异。
本研究以皂荚(G.sinensis)和野皂荚(G.microphylla)干燥棘刺为研究对象,基于UPLC-MS/MS自建平台和自建数据库,检测并分析皂刺中的次生代谢物,探索和分析差异代谢物的代谢途径和代谢机制,为皂刺功能性化合物的分离鉴定以及研究开发提供理论依据,进而为皂荚优良品种的开发利用和产业化效益的提升奠定理论基础。
1 材料及方法
1.1 试验材料
皂荚刺粗壮,有长的分枝,多呈圆锥状,长达16 cm(CS-1-3); 野皂荚刺通常较细,1或2个短分支,刺长约1.5~5 cm,(WS-1-3)(王世依等, 2016)(图1)。
皂刺采集地点为河北省保定市(38°29′15.42″N,115°34′39.65″E),生长环境、栽培措施一致,采集时间为2020年11月,两个种分别选取3株长势一致的植株作为3个重复,均为种子繁殖,约20年生,随机采集其1年生刺,迅速用酒精擦拭干净,切成小段放入离心管后放入液氮中,后放入-80 ℃冰箱保存备用。

图1 皂刺取样示例Fig. 1 Examples of spina gleditsiae sampling
1.2 样品处理
生物样品放置于冻干机(Scientz-100F)中真空冷冻干燥; 利用研磨仪(MM 400, Retsch)研磨(30 Hz,1.5 min)至粉末状; 称取100 mg溶于1.2 mL 70% 的甲醇提取液中; 每30 min涡旋1次,每次持续30 s,共涡旋6次,样本置于4 ℃冰箱过夜; 离心(转速 12 000 r·min-1,10 min)后,吸取上清液,用微孔滤膜(0.22 μm)过滤,保存于进样瓶中,用于UPLC-MS/MS分析。
1.3 UPLC-MS/MS分析条件
1.3.1 液相条件 色谱柱: Agilent SB-C18 1.8 μm,2.1 mm×100 mm; 流动相: A相为超纯水(加入0.1%的甲酸),B相为乙腈(加入0.1%的甲酸); 洗脱梯度: 0.00 min B相比例为5%,9.00 min内B相比例线性增加到95%,并维持在95% 1 min,10.00~11.10 min,B相比例降为5%,并以5%平衡至14 min; 流速0.35 mL·min-1; 柱温40 ℃; 进样量4 μL。
1.3.2 质谱条件 LIT和三重四极杆(QQQ)扫描是在三重四极杆线性离子阱质谱仪(Q TRAP)的AB4500 Q TRAP UPLC/MS/MS联用系统上获得的,该系统配备了ESI Turbo离子喷雾接口,可由Analyst 1.6.3软件(AB Sciex)控制运行正负两种离子模式。ESI源操作参数如下: 离子源,涡轮喷雾; 源温度550 ℃; 离子喷雾电压(IS)5 500 V(正离子模式)/-4 500 V(负离子模式); 离子源气体I(GSI),气体II(GSII)和帘气(CUR)分别设置为50、60和25.0 psi,碰撞诱导电离参数设置为高。在QQQ和LIT模式下分别用10和100 μmol·L-1聚丙二醇溶液进行仪器调谐和质量校准。QQQ扫描使用MRM模式,并将碰撞气体(氮气)设置为中等。通过进一步的DP和CE优化,完成了各个MRM离子对的DP和CE。根据每个时期内洗脱的代谢物,在每个时期监测一组特定的MRM离子对。
1.4 质控样本
质控样本(QC)是3种皂刺的混合物,用于分析样本在相同的处理方法下的重复性。仪器分析过程中,每10个样本插入1个质控样本,用来观察分析过程的重复性是否良好。
1.5 数据结果评估
基于自建数据库MWDB4.0(metware database),该数据库属于自建库,物质的信息来源包括公共数据库、标品数据库和自解谱的数据,根据二级谱信息进行物质定性。代谢物定量是利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)分析完成。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱出峰进行积分校正(Fragaetal., 2010)。采用多元统计分析,对2组样本进行主成分分析(Principal component analysis,PCA)、聚类分析(Hierarchical cluster analysis,HCA)、 重复相关性评估、正交偏最小二乘法判别分析(OPLS-DA)检测所采集的数据,结果表明这项研究中记录的数据具有良好的可重复性和可靠性。结合单变量统计分析和多元统计分析的方法,初步筛选出不同品种或组织间的差异代谢物。后结合单变量分析P值(P-value)或差异倍数值(fold change,FC)来筛选出显著差异代谢物。用差异倍数值、OPLS-DA模型的VIP值来筛选差异代谢物,其筛选标准: VIP ≥ 1,P< 0.05,差异倍数值 ≥ 2 和差异倍数值 ≤ 0.5的代谢物为差异代谢物,并将对应的显著差异代谢物KEGG的注释结果按照KEGG中通路类型进行分类分析。
2 结果与分析
2.1 皂刺样品的代谢组总体分析
基于UPLC-MS/MS自建平台和MWDB4.0数据库,图2是皂荚刺和野皂荚刺的样品在正、负2种离子模式下的总离子流图(total ion chromatography,TIC),2个种的皂刺基本趋势相似,但在个别时间有所差异。共检测到457种次生代谢物(图3),包括酚酸169种,占36.9%; 黄酮137种,占29.9%; 木脂素和香豆素27种,占5.9%; 其他 32种,占7.0%; 鞣质22种,占4.8%; 生物碱59种,占12.9%,萜类11种,占2.4%。酚酸物质种类占比最多,其次是黄酮、生物碱等代谢物。酚酸、生物碱类在皂荚刺和野皂荚刺中含量均较多。

图2 皂荚刺和野皂荚刺的总离子流图Fig. 2 TIC of G. sinensis and G. microphylla spinesa:皂荚刺负离子模式; b:野皂荚刺负离子模式; c:皂荚刺正离子模式; d:野皂荚刺正离子模式。a: TIC of G. sinensis spines negative ion mode; b: TIC of G. microphylla spines negative ion mode; c: TIC of G. sinensis spines positive ion mode; d: TIC of G. microphylla spines positive ion mode.
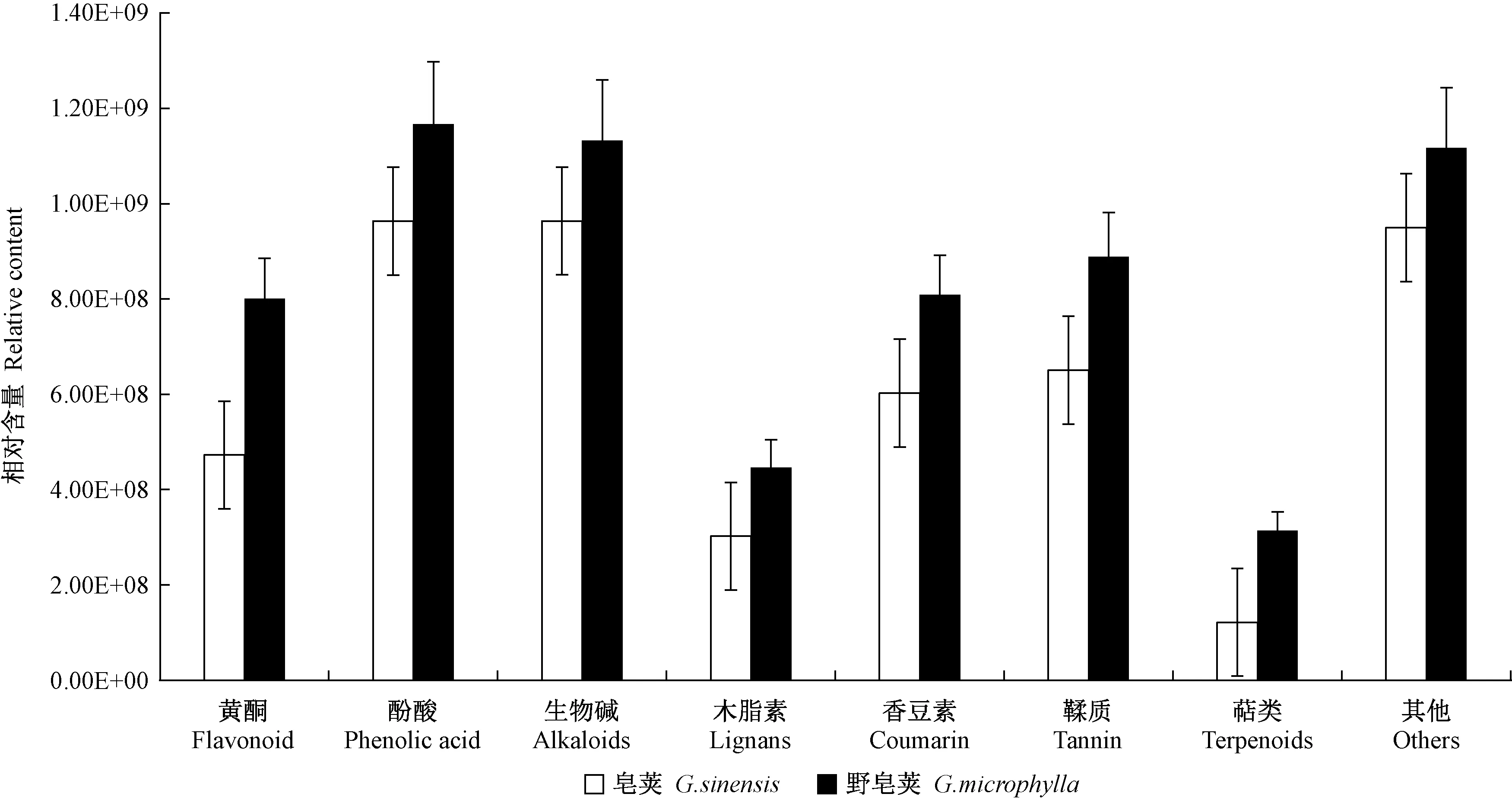
图3 皂荚和野皂荚刺中代谢物含量差异Fig. 3 Differences in the content of G. sinensis spines and G. microphylla spines metabolites

图4 2组样品的代谢组主成分分析(a)与聚类热图(b)Fig. 4 PCA(a) and HCA(b) of the 2 groups of samplesCS:皂荚G. sinensis; WS:野皂荚G. microphylla; Mix:混合样本Mixed samples.
2.2 皂荚和野皂荚刺次生代谢物差异分析与筛选
通过对样本(包括质控样品)进行主成分分析,以便初步了解各组样本之间的总体代谢差异和组内样本之间的变异度大小。全部样本的主成分分析如图4a所示,2组之间第一主成分贡献值达39.36%,第二主成分贡献值达15.9%,2组之间代谢有明显的分离趋势,且组间代谢物存在差异。利用代谢物在不同样本间的积累模式进行聚类分析,显示不同种皂刺的次生代谢物可明显分为2个聚类(图4b),样本间的次生代谢物积累有显著差异。
为进一步了解皂荚和野皂荚刺次生代谢物间的差异,以皂荚刺为对照,结合差异倍数值来进一步筛选出差异代谢物,选取差异倍数值 ≥ 2和差异倍数值 ≤ 0.5的代谢物。2个种的皂刺的显著差异代谢物共213种,其中121种代谢物的含量在野皂荚刺中含量较高,包括55种酚酸,这些代谢物涉及到苯丙烷生物合成、黄酮类生物合成、色氨酸代谢、茋类、二芳基庚烷类和姜酚的生物合成; 54种黄酮,其涉及到黄酮类生物合成、异黄酮生物合成、黄酮和黄酮醇生物合成、花色素生物合成; 5种木脂素和香豆素; 4种生物碱,涉及到脂代谢、精氨酸和脯氨酸代谢、烟酸和烟酰胺代谢; 2种萜类,1种其他物质(图5)。92种物质的含量在皂荚刺中含量较高,包括21种酚酸,它们涉及到泛醌和其他萜类-醌生物合成、叶酸生物合成、异喹啉生物碱的生物合成、苯丙氨酸代谢、酪氨酸代谢; 19种黄酮,它们涉及到黄酮类生物合成、异黄酮生物合成、黄酮和黄酮醇生物合成; 14种鞣质; 14种生物碱,它们涉及到脂代谢、色氨酸代谢、植物激素信号转导通路、精氨酸和酪氨酸代谢; 8种木脂素和香豆素,涉及到苯丙烷生物合成、各种次生代谢产物的生物合成-第2部分; 16种其他,涉及到硫胺代谢、乙醛酸和二羧酸的代谢、碳代谢、2-氧代羧酸代谢、氨基酸的生物合成。
通过比较得出皂荚刺和野皂荚刺的差异代谢物主要集中在黄酮和酚酸类物质。酚酸类差异代谢物主要集中在氨基酸代谢途径和辅助因子和维生素代谢中; 黄酮类差异代谢物主要集中在和黄酮类次生代谢途径中,生物碱类差异代谢物主要集中在氨基酸代谢途径中,氨基酸可经过一些特殊途径转变成生物碱。

图5 差异代谢物分类Fig. 5 Differential metabolite classification
在对所检测到的代谢物进行定性和定量分析后,结合具体样品的分组情况,比较了各分组中代谢物定量信息发生的差异倍数变化。表1展示出经差异倍数log2处理后排在前10的差异表达代谢物。与皂荚刺相比,野皂荚刺中含量升高的物质包括5种酚酸、3种黄酮、1种木脂素和1种萜类; 含量降低的物质包括3种黄酮,2种鞣质,2种茋类,2种生物碱,1种香豆素。松柏苷属于酚酸,在野皂荚刺中含量较高,是皂荚刺的19.41倍; 异牡荆素-2″-O-鼠李糖苷属于黄酮,在皂荚刺中含量较高,是野皂荚刺的20.32倍。
2.3 皂荚和野皂荚刺相同代谢产物分析
皂荚和野皂荚刺的相同代谢产物如图6所示,相同代谢产物中皂荚刺中含量较高(>1.00E+07)的有东莨菪苷、异莨菪亭、原花青素 B2、苯甲酰苹果酸、二氢山奈酚-3-O-葡萄糖苷、柠檬酸*、对羟基苯甲酸、香草醛、奎宁酸、原花青素 B1、落新妇苷、异槲皮苷*,含量中等(1.00E+07-1.00E+06)的有香橙素、异杞柳苷、樱桃苷、葫芦巴碱、泽兰黄酮、3-O-甲基槲皮素、原花青素 B3、芹菜素-6-C-(2″-葡萄糖基)阿拉伯糖苷、阿魏酰腐胺、异鼠李素-3-O-葡萄糖苷*、异鼠李素-7-O-葡萄糖苷*、芦丁、5-O-对香豆酰奎宁酸、香叶木素-7-O-半乳糖苷、3-O-阿魏酰奎宁酸、阿魏酸-4-O-葡萄糖苷、木犀草素,含量较少(<1.00E+06)的有新绿原酸*、香叶木素*、高车前素*、绿原酸*、二咖啡酰基莽草酸、槲皮素-7-O-芸香糖苷-4′-O-葡萄糖苷、槲皮素-3-O-芸香糖苷-7-O-葡萄糖苷、异绿原酸B、异绿原酸C。
野皂荚刺中相同代谢产物含量较高(>1.00E+07)的有香叶木素-7-O-半乳糖苷、3-O-阿魏酰奎宁酸、二咖啡酰基莽草酸、香叶木素*、5-O-对香豆酰奎宁酸、葫芦巴碱、芹菜素-6-C-(2″-葡萄糖基)阿拉伯糖苷、芦丁、泽兰黄酮、高车前素*、香橙素、异鼠李素-3-O-葡萄糖苷*、异鼠李素-7-O-葡萄糖苷*、3-O-甲基槲皮素、阿魏酸-4-O-葡萄糖苷,含量中等(1.00E+07~1.00E+06)的有槲皮素-7-O-芸香糖苷-4′-O-葡萄糖苷、绿原酸*、异绿原酸C、香草醛、槲皮素-3-O-芸香糖苷-7-O-葡萄糖苷、木犀草素、异槲皮苷*、异绿原酸B、新绿原酸*、苯甲酰苹果酸、东莨菪苷、柠檬酸*、对羟基苯甲酸、奎宁酸、二氢山奈酚-3-O-葡萄糖苷、异杞柳苷,含量较少的有樱桃苷、异莨菪亭、落新妇苷、阿魏酰腐胺、原花青素B2、原花青素B1、原花青素B3。
皂荚刺中优势代谢物(>2.00E+07)为东莨菪苷、异莨菪亭、原花青素B2,野皂荚刺的优势代谢物为香叶木素-7-O-半乳糖苷、3-O-阿魏酰奎宁酸、二咖啡酰基莽草酸、香叶木素*、5-O-对香豆酰奎宁酸、葫芦巴碱。

表1 皂荚和野皂荚刺差异表达代谢物Tab.1 Differentially expressed metabolites of G. sinensis spines and G. microphylla spines

图6 皂荚和野皂荚刺相同代谢产物的相对含量Fig. 6 Relative content of the same metabolites of G. sinensis spines and G. microphylla spines1:葫芦巴碱Trigonelline; 2:对羟基苯甲酸4-hydroxybenzoic acid; 3:香草醛Vanillin; 4:柠檬酸*Citric acid*; 5:异莨菪亭Isoscopoletin; 6:奎宁酸Quinic acid; 7:苯甲酰苹果酸Benzoylmalic acid; 8:阿魏酰腐胺N-Feruloylputrescine; 9:木犀草素Luteolin; 10:香橙素Aromadendrin; 11:高车前素*Hispidulin*; 12:香叶木素*Diosmetin*; 13:泽兰黄酮Nepetin; 14:3-O-甲基槲皮素3-O-methylquercetin; 15:5-O-对香豆酰奎宁酸5-O-p-coumaroylquinic acid; 16:绿原酸*Chlorogenic acid*; 17:东莨菪苷Scopolin; 18:新绿原酸*Neochlorogenic acid*; 19:阿魏酸-4-O-葡萄糖苷Ferulic acid-4-O-glucoside; 20:3-O-阿魏酰奎宁酸3-O-feruloylquinic acid; 21:异杞柳苷Isosalipurposide; 22:樱桃苷Prunin; 23:落新妇苷Astilbin; 24:二氢山奈酚-3-O-葡萄糖苷Dihydrokaempferol-3-O-glucoside; 25:香叶木素-7-O-半乳糖苷Diosmetin-7-O-galactoside; 26:异槲皮苷*Isoquercitrin*; 27:异鼠李素-3-O-葡萄糖苷*Isorhamnetin-3-O-glucoside*; 28:蔓菁苷*Brassicin*; 29:二咖啡酰基莽草酸Dicaffeoylshikimic acid; 30:异绿原酸C Isochlorogenic acid C; 31:异绿原酸B Isochlorogenic acid B; 32:芹菜素-6-C-(2″-葡萄糖基)阿拉伯糖苷Apigenin-6-C-(2″-glucosyl)arabinoside; 33:原花青素B1 Procyanidin B1; 34:原花青素B3 Procyanidin B3; 35:原花青素B2 Procyanidin B2; 36:芦丁Rutin; 37:槲皮素-3-O-芸香糖苷-7-O-葡萄糖苷Quercetin-3-O-rutinoside-7-O-glucoside; 38:槲皮素-7-O-芸香糖苷-4′-O-葡萄糖苷Quercetin-7-O-rutinoside-4′-O-glucoside.

图7 皂荚刺特有代谢物的相对含量Fig. 7 Relative content of G. sinensis spines metabolites1:东莨菪内酯Scopoletin; 2:白皮杉醇Piceatannol; 3:紫檀芪Pterostilbene; 4:水杨苷Salicin; 5:黄颜木素Fustin; 6:芥子酰腐胺Sinapoylputrescine; 7:3,3′,5-三羟基-4′,7-二甲氧基黄烷酮3,3′,5-Trihydroxy-4′,7-dimethoxyflavanone; 8:罗汉松树脂醇Matairesinol; 9:2,4,6,4′-四羟基-二苯乙烯-2-O-葡萄糖苷2,4,6,4′-tetrahydroxy-stilbene-2-O-glucoside; 10: N-对香豆酰-N′-阿魏酰基腐胺N-p-coumaroyl-N′-feruloylputrescine; 11: 对香豆酰阿魏酰腐胺p-coumaroylferuloylputrescine; 12: N,N′-二阿魏酰腐胺N,N′-diferuloylputrescine; 13:原花青素 A1 Procyanidin A1; 14:葛根素-4′3-葡萄糖苷Puerarin-4′3-glucoside; 15:异牡荆素-2″-O-鼠李糖苷Isovitexin-2″-O-rhamnoside; 16:原花青素 A6Procyanidin A6; 17:香叶木素-8-C-(2″3-鼠李糖基)葡萄糖苷Diosmetin-8-C-(2″-O-rhamnosyl)glucoside; 18: 2′-乙酰毛蕊花糖苷2′-Acetylacteoside; 19:肉桂单宁 B1 Cinnamtannin B1; 20:槟榔鞣质 B1 Arecatannin B1; 21:原花青素 C2 Procyanidin C2; 22:肉桂单宁 B2 Cinnamtannin B2.
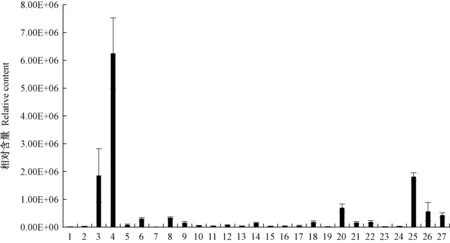
图8 野皂荚刺特有代谢物的相对含量Fig. 8 Relative content of G. microphylla spines metabolites1:云杉苷Picein; 2:柚皮素-4′,7-二甲醚Naringenin-4′,7-dimethyl ether; 3:5-O-咖啡酰莽草酸5-O-caffeoylshikimic acid; 4:松柏苷Coniferin; 5:咖啡酰对羟基苯甲酰酒石酸Caffeoyl(p-hydroxybenzoyl)tartaric acid; 6: 咖啡酰对香豆酰酒石酸Caffeoyl-p-coumaroyltartaric acid; 7: 6-O-葡萄糖基-阿魏酰苯甲酸6-O-glucosyl-feruloylbenzoic acid; 8:4-O-(6′-O-葡萄糖基咖啡酰)-4-羟基苯甲酸4-O-(6′-O-glucosylcaffeoyl)-4-hydroxybenzoic acid; 9:洋丁香苷A Syringalide A; 10:4-对香豆酰鼠李糖基-(1→6)-D-葡萄糖4-p-cumaroyl-rhamnosyl-(1→6)-D-glucose; 11:3,4-二没食子酰莽草酸3,4-digalloylshikimic acid; 12:4-O-(6′-O-葡萄糖基咖啡酰)-3,4-二羟基苯甲酸4-O-(6′-O-glucosylcaffeoyl)-3,4-dihydroxybenzoic acid; 13:4-O-(6′-O-葡萄糖基-阿魏酰)-3,4-二羟基苄醇4-O-(6′-O-glucosylferuloyl)-3,4-dihydroxybenzyl alcohol; 14: 1′-O-(3,4-二羟基苯乙基)-O-咖啡酰基-葡萄糖苷1′-O-(3,4-dihydroxyphenethyl)-O-caffeoyl-glucoside; 15:阿魏酰阿魏酰酒石酸Feruloylferuloyltartaric acid; 16:芥子酰对香豆酰酒石酸Sinapoyl-p-coumaroyltartaric acid; 17: 对香豆酰奎宁酸-4′-O-葡萄糖醛酸苷p-coumaroylquinic acid-4′-O-glucuronide; 18:3,5-二咖啡酰奎尼酸3,5-dicaffeoylquinic acid; 19:3-O-阿魏酰奎宁酸-O-葡萄糖苷3-O-feruloylquinic acid-O-glucoside; 20:1-羟基松脂醇-1-O-葡萄糖苷1-hydroxypinoresinol-1-O-glucoside; 21:5′-甲氧基罗汉松脂苷5′-methoxymatairesinoside; 22:异杞柳苷-6″-O-对香豆酸Isosalipurposide-6″-O-p-coumaric acid; 23:二芥子酰葡萄糖苷Disinapoyl glucoside; 24:槲皮素-3-O-(2″-肉桂酰)葡萄糖苷Quercetin-3-O-(2″-cinnamoyl)glucoside; 25:槲皮素-3-O-(2″-对香豆酰)葡萄糖苷Quercetin-3-O-(2″-p-Coumaroyl)glucoside; 26:金圣草黄素-7-O-(6″-阿魏酰)葡萄糖苷Chrysoeriol-7-O-(6″-feruloyl)glucoside; 27:苜蓿酸-3-O-葡萄糖醛酸苷-28-O-鼠李糖基(1,2)-阿拉伯糖苷Medicagenic acid-3-O-glucuronide-28-O-rhamnosyl(1,2)-arabinoside.
2.4 皂荚和野皂刺特有代谢物分析
皂荚刺中特有的代谢物有22种(图7),分属于酚酸、木脂素、香豆素、生物碱、黄酮、鞣质、茋类、其他类物质,其中异牡荆素-2″-O-鼠李糖苷、N,N′-二阿魏酰腐胺、香叶木素-8-C-(2″-O-鼠李糖基)葡萄糖苷、紫檀芪、原花青素C2相对含量较高(> 1.00E+06),其他代谢物的相对含量较低。
野皂荚刺中特有的代谢物有27种(图8),分别属于黄酮、木脂素、萜类、酚酸类物质,其中松柏苷、5-O-咖啡酰莽草酸、槲皮素-3-O-(2″-对香豆酰)葡萄糖苷的相对含量较高(> 1.00E+06),其他代谢物的相对含量较低。
2.5 差异代谢物富集分析
差异显著代谢物KEGG的注释结果按照KEGG中通路类型进行分类(图9),发现皂荚和野皂荚刺有60个差异显著的代谢物被注释到28条代谢途径中(表2),显著富集的代谢途径是茋类、二芳基庚烷类和姜酚的生物合成,其次是黄酮类生物合成、异黄酮生物合成、精氨酸和脯氨酸代谢、硫胺代谢、苯丙烷生物合成。其中茋类、二芳基庚烷类和姜酚的生物合成最为显著,此代谢途径中,含量升高的差异代谢物为酚酸类物质5-O-咖啡酰莽草酸、5-O-对香豆酰奎宁酸,含量降低的差异代谢物为茋类物质白藜芦醇、白皮杉醇、紫檀芪,差异倍数值为1.53~17.33。黄酮类生物合成和苯丙烷生物合成富集了较多的差异代谢物。
3 讨论
本试验采用UPLC-MS/MS代谢组学方法对皂荚和野皂荚2个种的皂刺进行分析,共鉴定出8类457种代谢物,主要包括酚酸、黄酮、木脂素、香豆素、鞣质、生物碱、萜类和其他多种化合物。就2个种的皂刺的差异次生代谢物来看,代谢物差异种类较多的是黄酮和酚酸类,其他类差异代谢物种类相对较少。
3.1 皂荚和野皂荚刺差异代谢物
黄酮类物质是一类植物次生代谢产物,不仅具有抗癌、抗衰老、抗氧化、抗肿瘤等功效(Russoetal., 2012),在植物体内还发挥着保护植株、抗逆性、抗病虫害、激素运输调节等作用(Griffiths, 1964)。皂荚刺中的黄酮优势代谢物异牡荆素-2″-O-鼠李糖苷、香叶木素-8-C-(2″-O-鼠李糖基)葡萄糖苷具有抗氧化(王晓丽, 2014; 郑新恒, 2018; 陈永芬等, 2004)、抗肝癌、宫颈癌(彭钰芳等, 2010; 龙玲, 2006; 张妍等, 2017; 何光志等, 2012)等作用,上述两种物质在野皂荚刺中未发现; 野皂荚刺中的黄酮优势代谢物香叶木素-7-O-半乳糖苷和香叶木素,前者对血管内皮细胞具有保护作用,后者对癌细胞具有抑制作用,因此两种物质可能成为保护血管内皮细胞的潜在物质(王月华等, 2017)。
酚酸类物质是一种分布广泛、应用历史悠久的芳香类物质。在植物体内的养分吸收、蛋白质合成、促进酶活性以及光合作用等过程或阶段起到重要作用。近年来,已从皂刺中分离鉴定了多种酚酸类化合物,具有一定的抗菌消毒(Zhouetal., 2007)和抗炎效果(Seoetal., 2015)。以皂荚刺为对照,野皂荚刺特有的且含量较高的酚酸类物质5-O-对香豆酰奎宁酸、松柏苷、5-O-咖啡酰莽草酸、二咖啡酰基莽草酸,具有抗氧化、清除DPPH自由基(王慧等, 2009; 陶鑫等, 2016)、和ABTS自由基(范金波等, 2015)、抑菌抗炎(赵雪飞, 2018; 陈向阳, 2016)的作用; 皂荚刺中特有的且含量较多的酚酸类物质丁香酸具有抗内毒素的作用(刘云海等, 2003),和石酚斛联合可抗白内障(刁红星等, 2012),含量较多的还有阿魏酸,具有降压(Suzukietal., 2002)、抗氧化(Kawabataetal., 2000)、增强大脑血液循环的作用(Yanetal., 2001; Hsiehetal., 2002),因其性质稳定,毒副作用小,是很多药的活性成分(黄云剑等, 1998)。上述研究结果为提取皂刺中的药用成分提供了依据,最重要的是为皂荚育种提供了方向,并为创新高质量皂刺品种提供了重要见解。
3.2 皂荚和野皂荚刺差异代谢物富集途径
植物的次生代谢是利用初生代谢的产物加工合成次生代谢产物,这些产物被称为“植物免疫物质”,对人类健康有着举足轻重的作用,属于功能性代谢。2个种的皂刺的差异代谢物主要来自于茋类、二芳基庚烷类和姜酚的生物合成、苯丙烷生物合成、黄酮类生物合成途径。
茋类、二芳基庚烷类和姜酚的生物合成代谢途径显著富集代谢物(P< 0.05)。参与此代谢途径的有5-O-咖啡酰莽草酸、5-O-对香豆酰奎宁酸、绿原酸、白藜芦醇、白皮杉醇和紫檀芪等6种物质,皂荚刺中紫檀芪、白皮杉醇含量分别是野皂荚刺的17.34和14.84倍,白皮杉醇是白藜芦醇的衍生物,紫檀芪被称为第二代白藜芦醇,3种物质均具有抗癌、抗菌、抗氧化等作用(田京伟等, 2001)。5-O-咖啡酰莽草酸、5-O-对香豆酰奎宁酸、绿原酸在野皂荚刺中含量较高,绿原酸具有广泛的生物活性,已深入到食品、保健、医药和日用化工等多个领域(王晓梅等, 2019)。在茋类、二芳基庚烷类和姜酚的生物合成代谢途径中,上述6种物质是由对香豆酰辅酶A在两种不同酶的作用下形成,未来可挖掘对香豆酰辅酶A或两种酶的合成基因,可通过转基因或后代基因型选择的方式来选育新的品种。
植物苯丙烷生物合成途径是植物体内一条重要的代谢途径,东莨菪苷在苯丙烷生物合成途径中生成东莨菪内酯和东莨菪苷,两种物质皆在皂荚刺中含量较高,东莨菪内酯在野皂荚刺中未被发现,异莨菪亭是东莨菪内酯的同分异构体,有研究发现这两种物质都具有一定的平喘效果,在一定的浓度下,表现出良好的清除自由基能力、抗氧化能力和还原能力(Leeetal., 2013; 孔玉珊等, 2014),但东莨菪内酯在合成过程中要比异莨菪亭复杂,因此在后续的医学工作中,异莨菪亭代谢物显得尤为重要(梁晓天等, 2013)。
茋类、二芳基庚烷类和姜酚的生物合成代谢途径中的对香豆酰辅酶A在黄酮类生物合成中进一步合成异甘草素,异甘草素会产生甘草苷元和紫铆花素,这两种物质都可生成黄颜木素,有研究发现皂刺中的黄颜木素可抑制癌症细胞的增殖(徐哲等, 2008),还有研究推测黄颜木素可激活神经营养因子信号通路中的小分子,促进长期记忆,用于治疗神经系统疾病(Maheretal., 2006)。上述物质黄颜木素和紫铆花素在皂荚刺中含量较高,甘草苷元在野皂荚刺中含量较多,黄颜木素在野皂荚刺中未发现。因此未来可通过挖掘皂荚刺和野皂荚刺中相关基因来调控苯丙烷生物合成或黄酮类物质代谢过程,促进皂刺优良品种中黄酮相关物质的积累,同时也为研究相关代谢途径的关键代谢物及其生物合成提供参考。
4 结论
本试验在皂荚和野皂荚刺中共鉴定出457种代谢物; 差异代谢物分析结果显示共鉴定出213种,主要集中在黄酮和酚酸类物质; 皂荚刺中特有的代谢物有22种,异牡荆素-2″-O-鼠李糖苷、N,N′-二阿魏酰腐胺、香叶木素-8-C-(2″-O-鼠李糖基)葡萄糖苷、紫檀芪、原花青素C2相对含量较高,野皂荚刺中特有的代谢物有27种,松柏苷、5-O-咖啡酰莽草酸、槲皮素-3-O-(2″-对香豆酰)葡萄糖苷的相对含量较高; 茋类、二芳基庚烷类和姜酚的生物合成显著富集差异代谢物(P< 0.05),苯丙烷生物合成和黄酮类生物合成代谢途径富集差异代谢物较多。本研究对皂荚和野皂荚的干燥棘刺的代谢物进行初步比较,对后续皂刺的深入研究和开发利用提供参考。