超声造影定量评估兔肝VX2肿瘤新生血管与CD34、血管内皮生长因子的相关性研究*
程颢,阮骊韬,杨艳秋
(1.西安交通大学附属陕西省肿瘤医院,陕西西安 710061;2.西安交通大学第一附属医院,陕西西安 710061;3.青海省第五人民医院,青海西宁 810001)
肿瘤新生血管在肿瘤生长、转移及预后过程中具有关键作用[1]。肿瘤新生血管的生成与血管内皮生成因子的释放密切相关,如CD34、血管内皮生长因子(VEGF)等的表达促进新生血管形成,加快肿瘤的生长、浸润及转移[2]。在肿瘤患者的长期随访与远期疗效评估过程中,组织学方法观察肿瘤新生血管是有创性的,多次重复测定不切实际。近年来影像学技术对肿瘤血管形态和功能的评估进展显著,通过影像手段反映肿瘤新生血管及瘤内微血管灌注情况已成为肿瘤诊断治疗的研究热点。其中超声造影(contrast-enhanced ultrasound,CEUS)技术发展迅速。研究表明CEUS 能够显示肿瘤血管灌注变化情况,是一种敏感且可靠的影像学手段[3]。本实验通过观察兔肝VX2 肿瘤的进展过程,分析CEUS 定量参数与CD34 和VEGF 的相关性,进一步深入探讨肿瘤血管生成基础与CEUS 定量参数的关系,为影像学准确地评估肝肿瘤血管生成、预后及复发的相关研究提供参考。
1 材料与方法
1.1 仪器与试剂
LOGIQ E9 超声诊断仪和ML6-15 高频探头购自美国GE 公司,仪器配置低机械指数反向编码造影成像技术(coded phased inversion, CPI)。兔抗兔CD34 多克隆抗体(一抗稀释浓度为1∶100)、兔抗兔VEGF 多克隆抗体(一抗稀释浓度为1∶100)、即用型链霉亲和素-生物素复合物(strept avidin-biotin complex, SABC)免疫组织化学试剂盒均购自武汉博士德生物工程有限公司。
1.2 动物模型复制
选择健康新西兰白兔24 只,体重(2.5±0.5)kg,雌雄不限。手术剥离出荷瘤兔肝VX2 肿瘤,选取肿瘤边缘生长旺盛的鱼肉样组织,制备成大小约1 mm×1 mm 的肿瘤块。用3%戊巴比妥钠(剂量30 mg/kg)经耳缘静脉麻醉接种兔后,在超声引导下,用穿刺针经皮经肝将肿瘤块接种于兔肝左叶深部位置,完成兔肝VX2 肿瘤模型复制。术后正常饲养,预防感染。共复制24 只兔肝VX2 肿瘤模型,肿瘤种植成功后正常饲养14 d,选取24 个肿瘤灶进行观察。
1.3 CEUS与定量分析
VX2 肿瘤植入14 d 后1 进行CEUS 检查。启用CPI 技术,Small Parts 造影模式。常规扫查选定兔肝肿瘤的最大中心切面行CEUS 检查,将观察目标放置于屏幕中央,局部放大图像。使用5 号头皮针建立耳缘静脉通道,制备SonoVue 微泡混悬液,经耳缘静脉团注射1 mL 混悬液后,随即快速注射2 mL 生理盐水冲洗静脉通路。团注对比剂同时启动系统内存储计时器,实时、动态观察选定的肝肿瘤显影情况2 min,所有影像资料存盘。对存盘图像进行CEUS 定量参数分析。
利用CEUS 定量分析软件,选取感兴趣区域(ROI)进行动态量化分析,选取肿瘤实质内或坏死周边显著增强的病灶区域,避开肿瘤内坏死液化的无增强区。选取周围肝组织时避开肝内大血管走行。仪器自动拟合出时间-强度曲线,软件自动计算并显示肿瘤组织与周围正常肝组织曲线增强上升斜率(AS)、对比剂强度、达峰时间(TTP)及曲线下面积(AUC)等CEUS 定量参数。同一肿瘤及周围组织选择不同感兴趣区域重复测取3 次,取其平均值。
1.4 免疫组织化学染色
24 只兔肝VX2 肿瘤模型进行CEUS 检查后立即处死荷瘤兔,制作肿瘤标本并进行免疫组织化学染色。所有标本用10 %甲醛溶液固定,常规石蜡包埋、切片、染色,并采用SABC 法进行免疫组织化学染色,判定CD34 和VEGF 的表达水平。
1.4.1 CD34 的检测肿瘤细胞染色呈棕黄色为CD34 阳性细胞,在低倍光镜下随机选取热点,然后转换到400 倍镜下随机选取5 个热点视野计数阳性细胞,计算每个视野中阳性细胞占总细胞数的百分率,将其平均值作为CD34 阳性细胞的表达率。CD34 阳性细胞表达分为:0%~30%为弱阳性,>30%~70%为阳性,>70%~100%为强阳性。
1.4.2 VEGF 的检测肿瘤细胞胞质中出现黄色、棕黄色、棕褐色颗粒为阳性细胞。随机选取5 个热点视野,高倍镜下计算每个视野中阳性细胞占总细胞数的百分率,将其平均值作为VEGF 阳性细胞的表达率。VEGF 阳性细胞表达率分级:0%~25%为Ⅰ级,> 25%~50%为Ⅱ级,> 50%~75%为Ⅲ级,>75%~100%为Ⅳ级。
1.5 统计学方法
数据分析采用SPSS 18.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;相关性分析采用Pearson 法。P<0.05 为差异有统计学意义。
2 结果
2.1 肝肿瘤与周围正常肝组织CEUS参数比较
兔肝VX2 肿瘤的对比剂强度、AS、TTP、AUC与周围正常肝组织比较,差异有统计学意义(P<0.05),对比剂强度、AS 及AUC 均明显大于周围正常肝组织,TTP 明显短于周围正常肝组织。本实验兔肝VX2 肿瘤CEUS 直观表现均呈“速升速降”特点,肿瘤在动脉相呈整体显著增强,瘤内出现液化坏死者表现为不均匀增强或环状增强,坏死灶无增强。造影时间-强度曲线表现为动脉相上升支陡直,快速达峰,静脉相迅速下降。见表1和图1。
表1 兔肝VX2肿瘤与周围正常肝组织CEUS参数的比较 (n=24,±s)
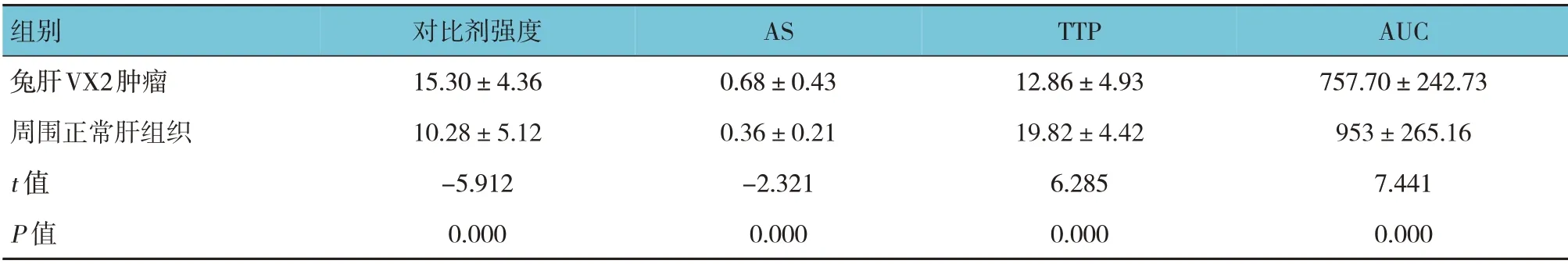
表1 兔肝VX2肿瘤与周围正常肝组织CEUS参数的比较 (n=24,±s)
组别兔肝VX2肿瘤周围正常肝组织t 值P 值对比剂强度15.30±4.36 10.28±5.12-5.912 0.000 AS 0.68±0.43 0.36±0.21-2.321 0.000 TTP 12.86±4.93 19.82±4.42 6.285 0.000 AUC 757.70±242.73 953±265.16 7.441 0.000
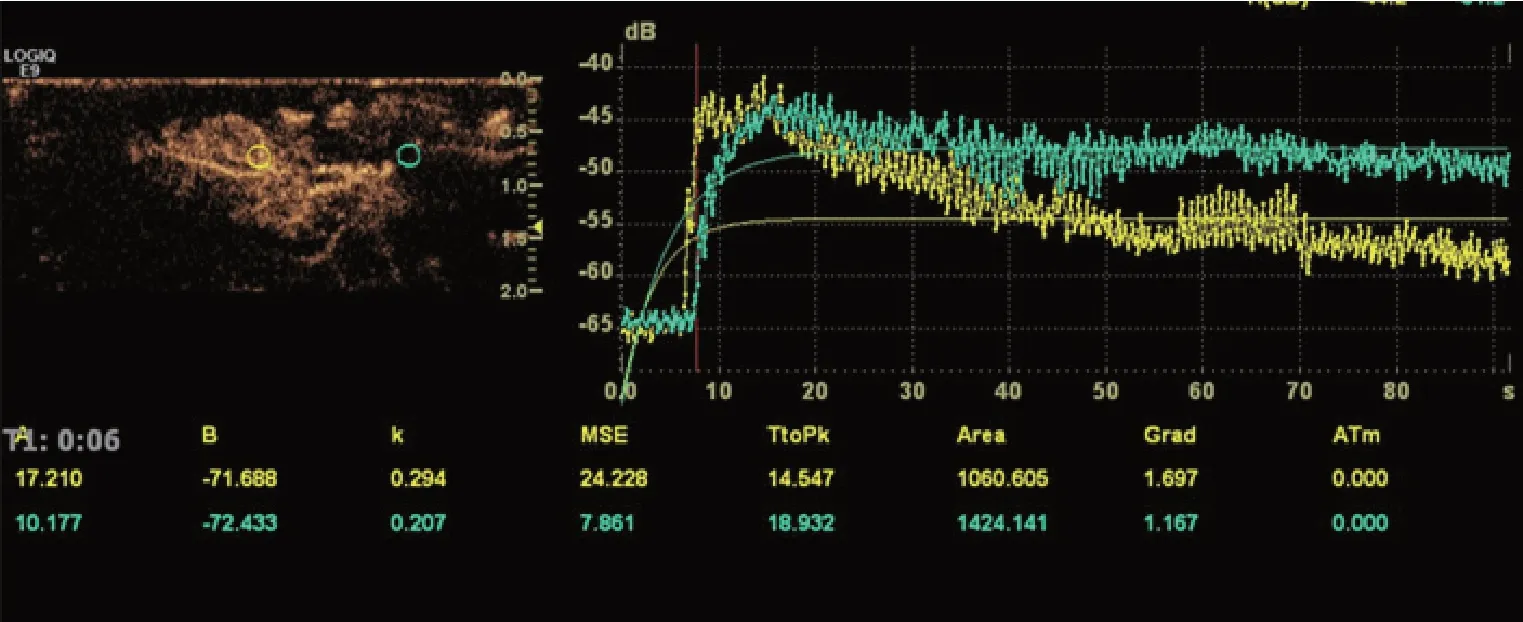
图1 兔肝VX2肿瘤与正常肝组织CEUS时间-强度曲线
2.2 免疫组织化学检查结果
兔VX2 肿瘤CD34 与VEGF 表达均为阳性(见图2A、B),其中弱阳性5 个,阳性16 个,强阳性3 个。CD34 阳性表达的平均值为(56.12±6.72),VEGF 阳性表达率的平均值为(61±24)%。VEGF 阳性细胞表达率Ⅰ级:0%~25%阳性细胞的肿瘤5个;Ⅱ级:>25%~50%阳性细胞的肿瘤6 个;Ⅲ级:> 50%~75%阳性细胞的肿瘤10 个;Ⅳ级:> 75%~100%阳性细胞的肿瘤3 个。见表2。
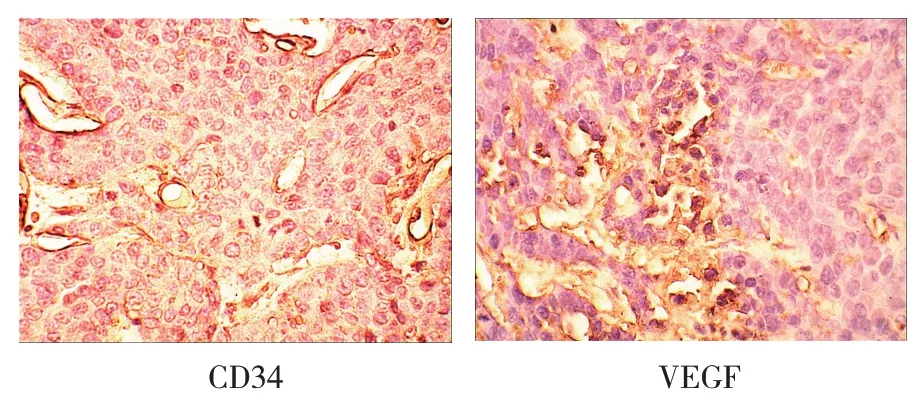
图2 兔肝VX2肿瘤CD34和VEGF的表达(SABC染色×400)
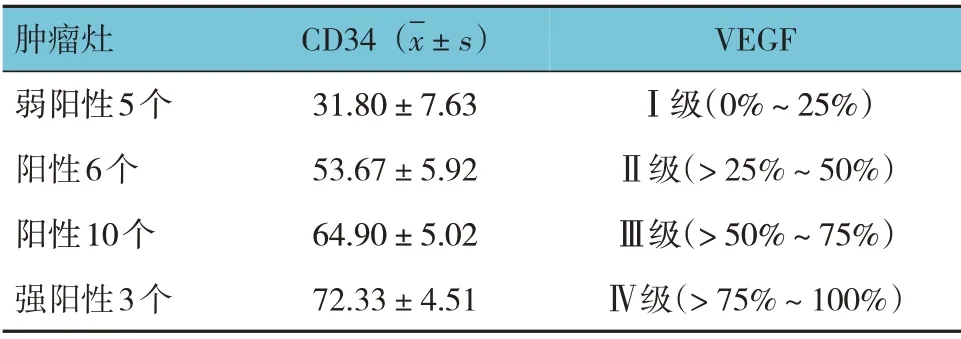
表2 兔VX2肿瘤CD34与VEGF阳性表达结果
2.3 CEUS定量指标与CD34、VEGF的相关性
CEUS 各定量指标中,TTP 与CD34、VEGF 呈负相关(r=-0.843 和-0.692,均P=0.000);对比剂强度与CD34、VEGF 呈正相关(r=0.386 和0.365,均P=0.042);AS 与CD34、VEGF 呈正相关(r=0.497 和0.631,均P=0.005);AUC 与CD34、VEGF 呈正相关(r=0.425 和0.485,均P=0.016)。
3 讨论
兔肝VX2 肿瘤的生长特性类似于人类肝细胞癌,其生长演变过程迅速,肿瘤血供丰富,被广泛用于肝肿瘤影像诊断、介入治疗等基础研究[4-6]。近年来,肿瘤精准治疗技术不断发展,对肿瘤疗效和预后的判断需要更加准确的评估方法。
肿瘤的生长转移依赖于新生血管生成[7],因此对肿瘤新生血管的评估成为肿瘤研究的热点。肿瘤血管具有特殊的形态,血管走形扭曲,粗细不均并会生成较多异常分支,结构特点也不同于正常组织血管,其内皮细胞基底膜不完整,没有平滑肌成分,仅由有孔的内皮细胞和片状基膜结构组成,导致肿瘤血管渗透性增加等,这种异常的形态结构特点更加促进恶性肿瘤的生长、转移。因此有研究认为,肿瘤新生血管的定量是一个重要的独立预后因素[8]。
恶性肿瘤细胞还会分泌多种血管内皮生成因子,如CD34、VEGF、vWF、CD105 等,血管内皮生成因子的释放促进了肿瘤血管的生成。肿瘤新生血管旺盛形成与多种血管内皮生成因子的高表达密切相关。因此在进行肿瘤新生血管计数时,可采用CD34、VEGF 等内皮细胞标志物定量法,但此法具有损伤性且易受取材范围的影响。一直以来,各种临床和基础实验都致力于找到一种安全有效、操作简便的技术用来精确评估肿瘤的生长和新生血管的生成。目前应用于临床和研究的主要有CT 灌注[9]、CEUS[10]等影像学技术手段。
由于肿瘤血管特殊的形态结构特点,造成肿瘤的血流灌注量和血容量明显高于正常组织,超声对比剂是一种血池显影剂,CEUS 过程中对比剂能快速进入肿瘤,并且快速廓清[11]。CEUS 通过测定对比剂强度、AS、TTP、AUC 等参数,反映肿瘤内对比剂灌注随时间变化的特点,能够比较客观地评价肿瘤新生血管的生成和功能情况[12]。
本实验兔肝肿瘤CEUS 时间-强度曲线参数中,TTP 与CD34 和VEGF 表达具有较好的负相关性,AS 与CD34 和VEGF 呈正相关,肿瘤血供越丰富,对比剂的灌注速度越快,对比剂所表示的肿瘤血流信号也更丰富[13]。肿瘤动脉血液供应的多寡与新生肿瘤血管形成关系密切,肿瘤新生血管是以血管生成因子为中介诱导产生,CD34 和VEGF 等血管内皮生成因子的高表达与新生血管的旺盛程度密切相关,因此CEUS 参数在一定程度上能够客观地反映肿瘤血管内皮生成因子的表达水平。同时AUC 与CD34 和VEGF 呈正相关,AUC 是流速、流量及时间三者的全面评估,可较好地反映一定时间内局部组织造影增强的累积效应,同时受血流速度的影响,与局部血流量呈线性正相关[14],因此AUC 能够综合反映肿瘤血管床的血流动力学情况[15],也表明AUC 与肿瘤血管内皮生成因子的表达密切相关。
综上所述,肿瘤的CEUS 表现与肿瘤新生血管及血管内皮生成因子密切相关,CEUS 时间-强度曲线能够量化肿瘤血管内对比剂流速和流量的变化情况[16],从而更加客观地反映出肿瘤新生血管的生成情况及瘤内灌注特点,CEUS 定量参数也能够客观反映出肿瘤血管内皮生成因子CD34 和VEGF 表达水平。因此,CEUS 定量分析技术的应用实现了由主观判断肿瘤强化程度到客观定量评价肿瘤血流灌注情况的转变。这种无创而实用的影像学技术在评价肿瘤微血管密度及抗肿瘤血管治疗疗效等方面具有重要的临床应用价值。

