超声应变成像获得的左房机械离散度可作为新发房颤的预测指标
黄志勇,胡孜阳,吴杰莹,罗伟权,刘娟娟
中山市中医院1超声科,2心内科,3检验科,广东 中山528400
心房颤动与左房结构及功能改变有关[1]。左房扩大是房颤的预测因素[2],但左房不扩大患者也可发生房颤,因为左房功能受损先于左房结构改变[3]。心肌应变成像可反映整体及局部心肌功能,左房应变受损提示患者有发生房颤的风险[4]。心肌应变成像也可测量心肌运动时间[5],左房心肌收缩时间不同提示存在心房纤维化和电生理异常[6]。目前,国内已有研究报道应用左心房应变及机械离散度可预测房颤患者行射频消融术后的房颤复发[7],但暂未有关于新发房颤患者的相关报道。二维超声心动图和组织多普勒成像可用于评估左心房的功能和同步性[8],但该技术具有角度依赖性、重复性较差等缺点。二维斑点追踪超声心动图是一种非多普勒方法,可识别常规超声心动图无法识别的细微心肌像素并量化心肌形变,可测量左房各节段心肌的应变值[9-10]。本研究通过应用二维斑点追踪应变成像技术定量评估左房离散度与新发房颤的关系,探讨其是否新发房颤风险分层的有效预测指标及其预测新发房颤在左房功能障碍及左房扩张之外的增量价值。
1 资料与方法
1.1 一般资料
本病例对照研究来源于一项前瞻性队列研究,选取2018~2021年有房颤风险的376例一般人群作为受试者,随访3年期间选取有新发房颤的35例受试者作为研究组,并在同一队列中选取与研究组相等例数且年龄性别相匹配的未出现房颤受试者作为对照组。纳入标准:既往无房颤病史;高血压;冠心病;2 型糖尿病;肥胖(BMI≥30 kg/m2)。排除标准:首诊心电图确认房颤;风湿性瓣膜病;先天性心脏病;心衰病史;合并感染性疾病、肿瘤和严重肝肾功能不全患者;服用抗心律失常药物者;随访时间不足;应变分析不满意。
1.2 研究指标
一般资料(年龄、性别、体表面积、BMI);既往疾病史(2型糖尿病、高脂血症、高血压、冠心病);用药情况(降血压药、降血脂药、抗血小板药);记录CHA2DS2-VASc及CHARGE-AF风险评分。
1.3 新发房颤的识别
新发房颤定义为既往无房颤病史,门诊或住院期间使用常规心电图、动态心电图、心电监护设备记录到房颤(P波消失,R-R间期不等,节律不规则持续>30 s)。随访时间为3年,受试者分别在第1、6、12、18、24、30、36月接受监测。
1.4 超声心动图检查
1.4.1 仪器与软件 使用西门子ACUSON SC2000超声诊断仪采集图像,配备4V1c超声探头(1.25~4.5 MHz),设置成像帧频60~80 帧/s。使用TomTec Imaging Systems对图像进行应变分析。
1.4.2 图像采集 超声诊断仪连接心电图,受检者取左侧卧位,分别在心尖二腔、三腔、四腔心切面及左室长轴、短轴切面采集5个心动周期动态图像,存图后脱机分析。
1.4.3 图像分析与参数获取(1)使用斑点追踪成像测量应变参数,手动描记左房心内膜边界后,软件自动追踪整个心动周期的心肌,并自动生成各节段应变曲线及应变达峰时间(图1A),左心房应变曲线的两个峰值分别为左房储器应变(LARS)、左房泵应变(LAPS),两个峰值之间为左房管道应变(LACS)(图1B),左房机械离散度(SD-TPS)定义为经R-R间期标化的左房各节段储器应变达峰时间标准差(图2)。
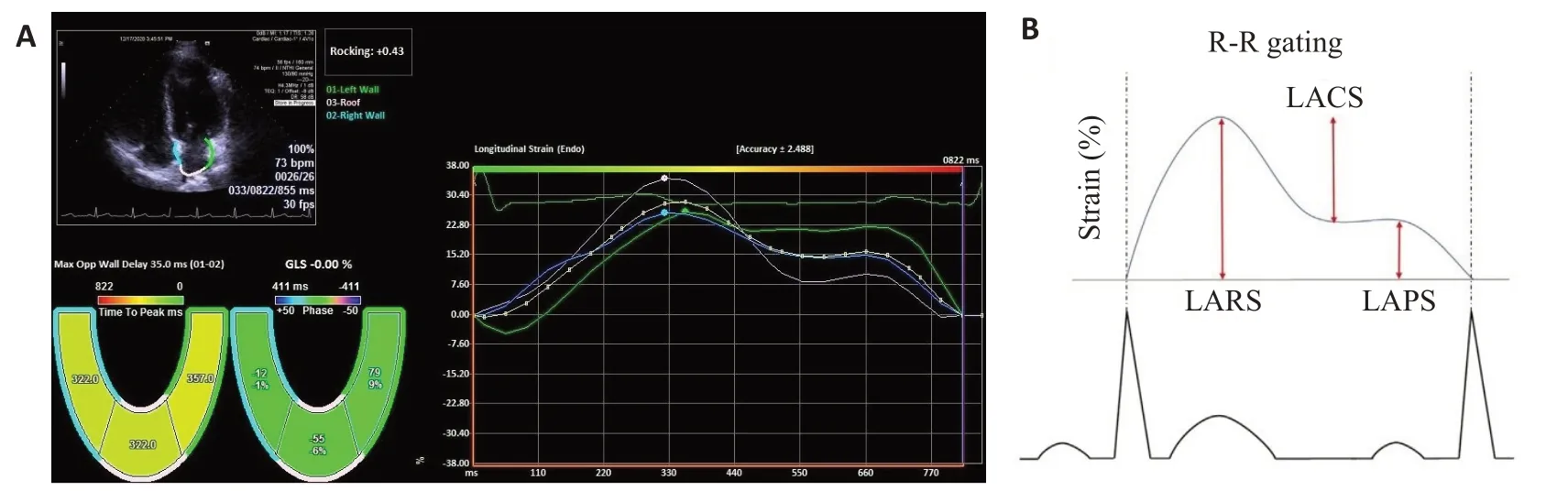
图1 左房应变参数的测量Fig.1 Measurement of left atrial strain parameters.

图2 两组代表性案例的左房应变曲线和SD-TPSFig.2 Measurements of left atrium dispersion and representative cases in patients with and without AF
(2)使用双平面Simpson法测量左房容积并计算经体表面积标化后的左房容积指数(LAVI),测量左室射血分数(LVEF)。
(3)使用频谱多普勒测量舒张早期二尖瓣口血流速度E峰,使用组织多普勒成像测量舒张早期二尖瓣瓣环运动速度e’,并计算E/e’。
1.5 统计学分析
对符合正态分布的计量资料以均数±标准差表示,对不符合正态分布的计量资料以中位数(四分位数间距表示;计数资料以n(%)表示。正态分布的计量资料组间比较采用独立样本t检验,非正态分布计量资料组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验或Fisher确切概率法。采用多变量线性回归分析SD-TPS与其他超声心动图参数的相关性。采用Cox比例风险回归模型分析新发房颤的独立危险因素,并分析SD-TPS的独立性、稳定性及增量价值。采用ROC曲线分析SD-TPS对新发房颤的预测效能。应用Kaplan-Meier法估计生存函数,并采用Log-rank检验比较生存曲线间分布差异。以P<0.05为差异有统计学意义。
2 结果
2.1 患者基线特征
376名受试者中,有35名受试者在3年的随访中发生了新发房颤,作为研究组。研究组年龄70±4岁,57%为男性,49%为阵发性房颤,51%为非阵发性房颤。对同一队列中未发生房颤的35名受试者进行了年龄和性别匹配,作为对照组。两组中大多数患者有2型糖尿病(54%)、肥胖(44%)、高胆固醇血症(48%)和高血压(76%),但LAVI和LVEF平均值都在正常范围,两组的LAVI差异无统计学意义,但研究组的LAPS和LARS低于对照组(P<0.01),研究组的SD-TPS高于对照组(P<0.01,表1)。两组代表性案例的左房应变曲线和SDTPS(图2)。

表1 患者基线特征Tab.1 Patient baseline characteristics
2.2 SD-TPS与其他超声心动图参数的关系
采用单变量和多变量线性回归分析评价SD-TPS与其他超声心动图参数的相关性,在多变量分析中,SDTPS 与LVEF(r=0.38,b=0.27;P=0.03)和LARS(r=0.39,b=0.27;P=0.04)存在相关性(表2~3)。由于存在共线性,在多变量模型排除了LAPS和LACS。

表2 SD-TPS与其他超声心动图参数的线性回归分析Tab.2 Associations of SD-TPS and other echocardiographic parameters
2.3 新发房颤的预测因素
在单因素Cox 回归分析中,新发房颤与LAVI、LARS和SD-TPS有关;在多因素Cox回归分析中,使用3个不同的模型研究了SD-TPS与新发房颤的独立关系,在每个模型中,SD-TPS与新发房颤有显著相关,而且危险比(HRs)相似(1.28~1.37,表4)。在调整了CHARGE-AF评分、LAVI和LARS后,SD-TPS与新发房颤独立相关(HR=1.26,95%CI:1.10~1.45,P<0.01,表5)。

表3 SD-TPS与其他超声心动图参数的相关性Tab.3 Correlation between SD-TPS and other echocardiographic parameters
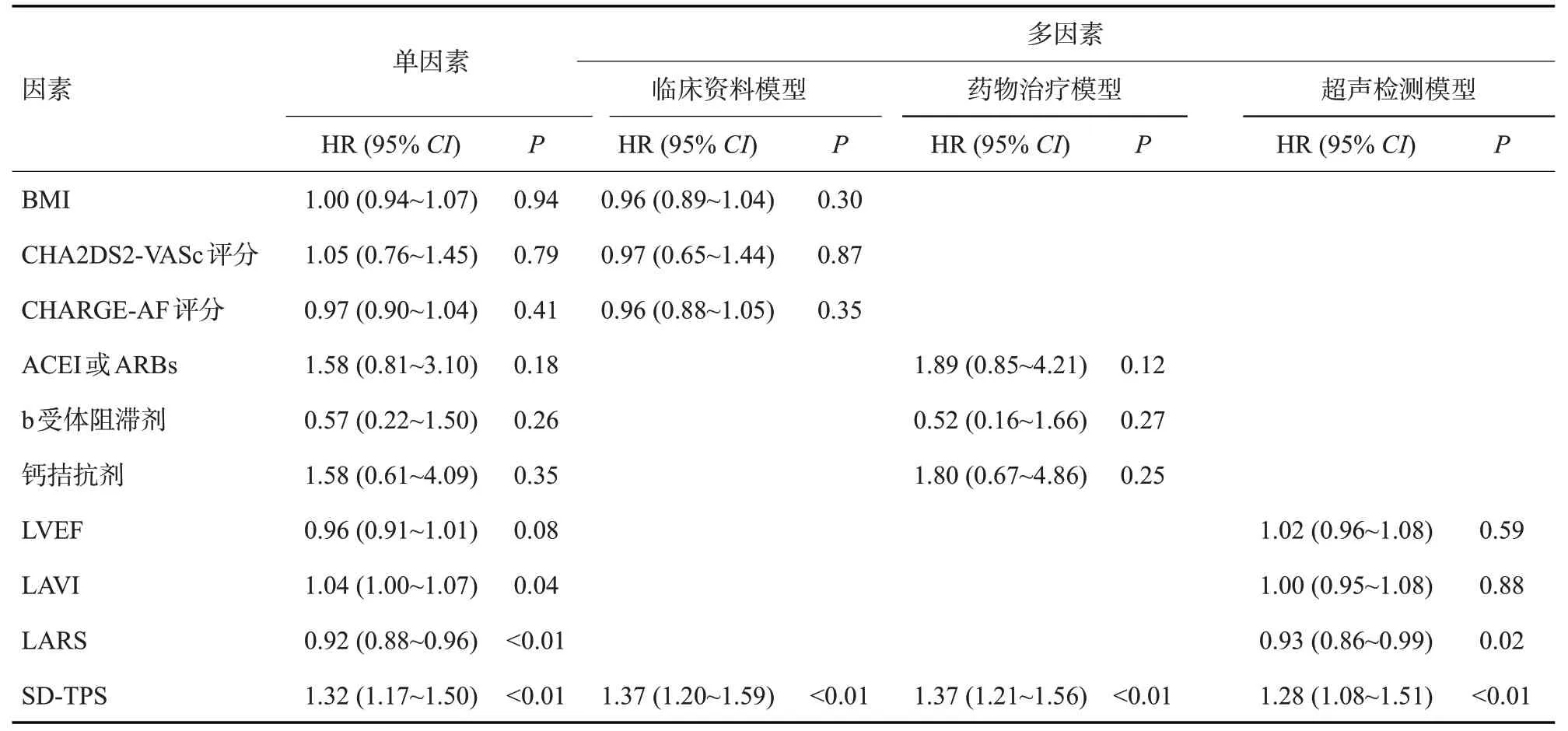
表4 新发房颤相关因素的Cox比例风险回归模型分析Tab.4 Univariable and multivariable Cox regression analysis for new-onset atrial fibrillation

表5 LARS与SD-TPS预测新发房颤的增量价值Tab.5 Incremental value of LARS and SD-TPS in predicting new-onset atrial fibrillation
ROC曲线结果显示,SD-TPS和LARS被确定为具有高曲线下面积的新发房颤预测因素(SD-TPS为0.80,LARS为0.75),其中SD-TPS的曲线下面积最高,SDTPS的截点值为5.3%时具有最高敏感度和特异性,分别为65.7%和85.7%。根据ROC曲线分析中得出的截点值进行重新分组并制作Kaplan-Meier生存曲线,SDTPS≥5.3%患者较SD-TPS<5.3%患者更早发生房颤事件(21.4±7.5月vs28.7±8.2月),组间生存时间分布差异有统计学意义(Log-rankP<0.01,表6、图3)。

图3 新发房颤的生存曲线分析(SD-TPS=5.3%)Fig.3 Kaplan-Meier curves showing freedom from new-onset atrial fibrillation(SD-TPS=5.3%).

表6 超声心动图参数的ROC曲线分析Tab.6 ROC curve analysis of echocardiographic variables
2.4 SD-TPS的增量价值
基于临床资料和超声参数建立预测模型,表5显示了LARS与SD-TPS预测新发房颤的增量效益,模型1包括CHARGE-AF评分和LAVI(χ2=5.3),模型2通过添加LARS(χ2=17.8,P<0.01)得到明显改善,模型3通过添加SD-TPS(χ2=27.5,P<0.01)进一步改善。
3 讨论
近年来,通过超声应变评估的心肌机械离散度已经成为评估室上性和室性心律失常的有用工具。有研究证明,在各种心血管疾病中,评估左心室机械离散度是一个独立而有力的预测室性心律失常的因素[5]。最初,斑点追踪应变成像被开发用于研究心室功能,但近年来也被广泛用于评估心房功能,左心房应变是一种新兴的技术,具有潜在的应用价值,可对早期的心房功能障碍进行识别[11]。本研究所应用的二维斑点追踪应变成像是一种非多普勒方法,可识别常规超声心动图无法识别的细微心肌像素,从标准二维数据中客观量化心肌形变,从而实现测量左房各节段心肌的应变值,并分析左房各节段心肌应变值的差异性,定量评估左房节段机械运动同步性,具有较好的可行性和可重复性,且无角度依赖性等特点[9-10]。
左房的结构和功能重塑均与房颤相关,左房扩大是房颤的预测因素,但左房不扩大患者也可发生房颤,因为左房功能受损先于左房结构改变[1-3]。一项包括45例阵发性孤立性房颤患者和30例健康对照者的研究表明,两组的左房容积无差异,而房颤组的LARS、LAPS及LACS均低于对照组,其中LARS是区分房颤组与对照组的最准确参数[9]。本研究结果与上述研究一致,本研究显示新发房颤患者的LAVI平均值在正常范围,两组LAVI 的差异无统计学意义,但研究组的LARS 和LAPS明显低于对照组,说明房颤患者的左房应变功能受损可发生在左房结构重塑之前。
既往研究报道心房颤动患者的左房离散度比健康人大[12],与心房颤动的持续时间成比例增加[13]。在接受房颤消融术的患者中,与左房体积和整体功能相比,左房离散是心脏磁共振评估左房瘢痕的一个更具体的标志[6]。一项关于房颤消融术患者的电解剖图和左房应变的研究中,左房离散在低电压区的患者中明显增加,左房离散的严重程度与左房传导延迟有关[14]。应用二维斑点追踪应变成像所获取的左房离散度可预测从阵发性房颤到持续性房颤的进展,并可预测导管消融后复发的房颤[7,15],且左房离散度还能检测出没有左房增大患者的左房功能损伤和不同步[15]。有学者发现左心房舒张末期到最小收缩期体积的时间标准差是房颤的独立预测因子[16];有研究在心房收缩期间评估18个左房节段的峰值负纵向应变,测量18个左房节段的收缩持续时间,作为从心电图上P波的峰值到每个节段最大心肌缩短的时间,收缩持续时间的标准偏差定义为左房机械分散度,发现左房机械分散度是阵发性房颤的独立预测因子[15]。本研究也基本证实了以上结论。本研究结果显示,研究组的SD-TPS 高于对照组,SD-TPS 与LARS存在相关,且在调整了CHARGE-AF评分、LAVI和LARS 后,SD-TPS 与新发房颤呈独立相关。对于ROC曲线分析,有研究显示左房机械分散度的AUC为0.88,敏感度为77%,特异性为85%[16],与本研究所得SD-TPS的AUC(0.80)相接近,表明左房机械离散度对房颤有较高预测效能;另一项关于左房机械离散度预测房颤患者射频消融后复发的研究表明,持续性和阵发性房颤组中GLS的AUC均大于SD-TPS,GLS对预测射频消融术后房颤复发的效果优于SD-TPS[7],而本研究中SD-TPS的AUC最高,对预测新发房颤的效能优于LARS及GLS,表明左房机械离散度对新发房颤与复发房颤的预测效能可能不相同。
在目前临床工作中,CHA2DS2-VASc评分常用于对房颤患者的风险评估。有研究表明,在预测房颤患者血栓形成的风险方面,左房离散度比CHA2DS2-VASc评分有增量价值[17]。本研究通过添加SD-TPS建立的预测模型对新发房颤的预测效益得到进一步改变。此外,使用既定的SD-TPS截点值,左房离散度对识别新发房颤患者的敏感度和特异性较高,能够更早提示患者发生房颤事件。基于这些发现,左房离散度有助于对发生房颤和血栓形成的风险分层,而更好的风险分层有利于房颤的预防与早期诊断,亦有助于临床制定随访决策。
本研究有以下几个局限性:首先,本研究是一个选定的小群体病例对照研究,抽样人数相对较少,这可能是房颤与其他因素(如左心室肥大和功能障碍)不存在关联的原因[18],需要进一步的前瞻性多中心研究来证实本研究结果的外部有效性,特别是截止值,并将左房离散度转化为房颤的风险分层;第二,队列中的房颤病例数可能被低估,因为一些房颤事件是无症状的,间歇性监测可能会错过房颤发作;第三,本研究没有将左房应变和离散度与心电图参数如P波持续时间和PR间期进行比较,后者也是房颤的既定预测因素[19-20]。
综上,从超声应变成像中获得的左房机械离散度可作为新发房颤风险分层的有效预测指标,可独立于临床危险因素和传统超声心动图参数预测指标,在预测新发房颤方面可提供左房容积及左房功能障碍之外的增量价值。

