基施控释氮肥提高华北露地大白菜产量并减少土壤NH3和N2O排放
乔 丹,张树清,陈延华,吕春玲,刘建斌,肖 强*,王学霞*
(1 中国农业科学院农业资源与农业区划研究所,北京 100081;2 北京市农林科学院植物营养与资源环境研究所,北京 100097;3 北京市缓控释肥料工程技术研究中心,北京 1000971;4 农业农村部环境保护科研监测所,天津 300191)
氮肥作为增加农作物产量和提高作物品质的重要驱动因素之一,在农业生产中发挥关键作用[1]。氮肥过量施用是国内农业生产中普遍存在的问题,超量氮肥施入农田后除少部分被土壤固定供植物吸收利用外,大部分通过NH3排放、淋洗和径流等迁移途径及硝化、反硝化等氮素转化途径进入大气和水体,不仅导致氮肥资源的大量浪费,而且对农业生态环境造成不利影响[2–5]。氮素损失作为我国农田系统中面源污染的重要途径之一,也是我国农田氮肥利用率低的重要原因[6–7]。农田土壤氨(NH3)和氧化亚氮(N2O)产生及其排放是土壤氮素气态损失的主要途径[8–9]。NH3排放是土壤中铵态氮气态损失的主要形式。研究表明,每年农业系统中NH3排放量占据全球NH3排放总量的55%~60%,挥发到大气中的NH3与大气中的NO2、SO2等酸性气体以及排放性有机物结合,生成铵盐气溶胶引发酸雨、雾霾和水体富营养化等一系列环境问题,对自然生态系统产生负面影响[10–11]。N2O排放是土壤硝态氮气态损失的重要途径之一。研究表明,每年全球农田土壤排放的N2O气体占N2O总排放的80%~90%,由此农田系统是全球重要的N2O 排放源[12]。N2O 不仅是一种长寿命、高增温潜势的重要温室气体,而且对平流层臭氧有一定的破坏作用[13]。因此,农田氮素的气态损失及其环境效应已成为我国和全球农业可持续发展的重要制约因素。
国内外研究证实,施氮量、氮肥种类、施肥和灌溉方式等农业管理措施,通过影响土壤理化性状和土壤微生物活性直接或者间接影响农田生态系统中NH3和N2O排放[14–16]。首先,施氮量是决定土壤NH3和N2O排放通量的最关键因素,NH3和N2O排放与施氮量间呈显著正相关,在不影响作物产量的前提下适当减氮,降低土壤无机氮含量可降低种植过程中氮素气态损失[17]。其次,氮肥种类也是影响农田氮素气态损失的关键因子之一。农田生态系统中,氮肥的养分释放速率与作物生长需求之间不匹配也是导致氮素气态损失增加的重要原因。控释氮肥通过树脂包衣能有效控制肥料中氮素的释放,在一定程度上有效调控土壤养分供给和作物养分需求之间平衡[3, 18–19]。控释氮肥可通过延缓、控制养分的释放来延长氮肥的作用期,有利于养分的合理供应,提高肥料利用率,实现作物稳产与增产的同时减少土壤氮淋溶、NH3和N2O排放,并且可以节省追肥人工成本[19–20]。众多研究证实控释氮肥一次性施肥在提高水稻[18, 20–21]、玉米[3]、谷子[22]等粮食作物产量,减少大田土壤NH3和N2O排放等氮素气态损失方面起到积极作用[3,21,23]。再次,水肥一体化及滴灌在一定程度上也对降低土壤NH3和N2O排放起到积极作用[14,18]。因此,在作物种植过程中运用科学合理的氮肥管理措施是降低氮素气态损失的最有效途径。
随着我国人均蔬菜消费量不断提高,我国蔬菜种植面积逐年增加,到2018年蔬菜种植面积达到20438.9×103hm2,占农作物总种植面积的12.3%,成为我国农业生态系统重要组成部分。为追求高经济效益,蔬菜作物的氮肥投入量远高于粮食作物,导致菜地氮肥的利用率更低,NH3和N2O排放更高[24–25],菜地成为我国农业NH3和N2O的重要排放源。针对蔬菜种植过程中日益凸显的高水氮投入、低效率、高污染等问题,采用合理氮肥管理措施减少菜地氮素气态损失,提高氮素利用率,减少氮素盈余造成的环境污染,是实现我国蔬菜产业可持续发展的重要保障。前人研究证实控释氮肥作为基肥配施水溶肥(常规施氮量或者减氮10%~30%),是实现蔬菜稳产与增产,提高经济效益,降低气态氮素损失积极有效的方式[26–28]。但是关于控释氮肥一次性底施对大白菜产量、氮肥利用率、氮素气态损失及经济效益的影响报道还比较少。
大白菜作为我国栽培面积最大的蔬菜作物,2018年其全年种植面积约占全国蔬菜总面积的15%,其中华北地区是露地秋季大白菜的主产区。本研究以华北地区露地秋季大白菜为研究对象,探讨在减氮10%条件下,控释氮肥一次性基施对大白菜产量、经济效益、氮肥利用率、土壤NH3和N2O 排放、土壤理化性质的影响,明确NH3、N2O 在不同施氮处理下的排放动态、积累量变化规律及影响因素。旨在为华北地区大白菜生产寻求最优氮肥管理方案和科学依据,促进该地区蔬菜产业绿色和可持续发展。
1 材料与方法
1.1 研究区概况
田间试验地设在河北省赵县 (N37°47′34.94″,E114°41′37.71″)。该地区属温带季风大陆性气候,年平均温度为12.4℃,年平均日照时数为2126 h,年平均降雨量为820 mm,2019年大白菜生长季降水与土壤温度变化如图1所示。供试样地土壤为褐土,0—30 cm土壤耕层养分状况:全氮1.60 g/kg、速效磷 10.4 mg/kg、速效钾 164 mg/kg、有机质 19.20 g/kg、pH 8.45。
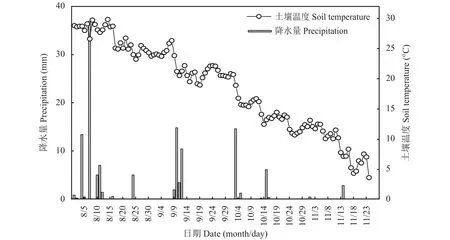
图1 生长季降水量与土壤温度Fig.1 Precipitation and soil temperature during growing season
1.2 试验设计与取样
田间试验共设4个处理,分别为:不施氮对照(CK)、常规施氮 (尿素 N 400 kg/hm2,基追比为4∶6,U);常规施氮基础上减氮10% (尿素N 360 kg/hm2,基追比为4∶6,90U);控释氮肥减氮10%一次性基施 (减施N 10%,总施N量360 kg/hm2,90CRU),各处理均底施 P2O5180 kg/hm2和K2O 360 kg/hm2。供试控释氮肥由北京市农林科学院提供,释放期60天,含N 45.4%,追肥所用水溶肥(N∶P∶K=10∶0∶0)由河北萌帮水溶肥有限责任公司生产,随水追施基肥为过磷酸钙(P2O5≥16%)和硫酸钾(K2O≥50 %)。每个处理4次重复,完全随机排列,小区面积27 m2。供试作物为秋季大白菜(BrassicabaraL.,新抗80),于2019年8月14日播种,11月26日收获,栽培方式为当地常规不起垄点播种植,行距50 cm,株距35 cm,每小区种植150棵。U和90U处理追肥在莲座期和结球期时进行,两时期各追总施氮量的30%,而 90CRU处理灌溉相同量的水 (100 m3/hm2)。
1.3 试验方法
土壤取样时间分别为8月25日(苗期取样),9月15日(莲座期),10月18日(结球期)及11月26日收获后,共取4次。取样方法为每个小区按照“S”形取样,用直径2.5 cm土钻取土壤,取样深度为0—30 cm,每个小区取6钻,充分混匀后作为一个样品。土壤样品分为三部分:一部分用于土壤理化性状分析;一部分于–20℃冰箱保存,用于NH4+-N、NO3–-N和土壤酶活性检测;还有一部分于–80℃冰箱保存,用于土壤功能微生物数量检测。
大白菜产量和含氮量:每小区选取长势均匀一致的10株,采收后称重,测其产量;每株白菜取相同部位的部分样品,烘干,用凯氏定氮法检测其氮素含量。采用流动分析仪 (Auto Analyzer 3,SEAL,德国)分析土壤NH4+-N和NO3–-N含量。采用苯酚钠–次氯酸钠比色法测定土壤脲酶活性,其活性以每克土中24 h内产生的NH3-N的mg数表示。
土壤微生物DNA提取:称取冷冻土壤样品0.5 g,采用土壤DNA提取试剂盒(MO BIO Laboratories,美国)进行总DNA基因组提取。对提取到的基因组DNA 进行琼脂糖电泳检测 (10 mmol/L Tris-HCl,1 mmol/L EDTA pH 8.0) DNA 的完整性,用 NanoDrop 2000 (Thermo Scientific,美国)测定 DNA 含量与质量。
荧光定量 PCR (real-time PCR):以提取的土壤微生物总 DNA 为模板,利用 QuantStudio 7 Flex Real-Time PCR System (Applied Biosystems,美国)对AOB-amoA、nirS和nirK功能基因进行序列拷贝数分析,引物序列参照表1。荧光定量PCR反应体系(10 μL)包含:0.5 μL 模板 DNA,5.2 μL of SYBR Green 和 ROX 混合液 (2 X, Takara Bio Inc., Shiga,Japan),上下游引物各 0.25 μL (10 μmol/L),补ddH2O 3.8 μL。反应条件为:初变性 95℃ 15 s;然后变性 95℃ 5 s,复性 56℃ 30 s,延伸 72℃ 45 s,共40 个循环,延伸 80℃ 30 s。最后获得y=–3.4348 logx+38.580 (AOB-amoA),y=–3.5842 logx+40.236(nirS),y=–3.5402 logx+ 34.938 (nirK)标准曲线的R2值均大于0.99,扩增效率为85%~93%。

表1 标靶基因和荧光定量PCR 引物Table 1 Target genes and primers used in fluorescent quantitative PCR
土壤NH3排放取样与测定采用磷酸甘油海绵通气法。每个处理放置高11 cm、内径12 cm的PVC管,测定时分别将两块厚度均为2 cm、直径为11 cm 的海绵均匀浸以 10 mL 的磷酸甘油溶液 (50 mL 磷酸+40 mL 丙三醇,定容至 1000 mL)放入 PVC 管中。上层海绵视干湿情况每3~4天更换1次,保证湿润。基肥期连续取15天,追肥后连续取8天,排放量较少时取样时间延长到5~7天取样1次。每次采样时,更换下层海绵,将换回的海绵带回实验室中,分别装入 500 mL 的塑料瓶中,加 300 mL 1.0 mol/L的 KCl 溶液,使海绵完全浸于其中,振荡 1 h 后,采用连续流动分析仪测定浸取液中的NH4+-N含量。
土壤N2O气体排放检测分析:采用常规静态箱法‒气相色谱法。静态箱采用不透明的PVC板制作(长 50 cm、宽 50 cm、高 54 cm)。测定前 24 h 将水槽底座插入土壤中5 cm,取样时将静态箱置于水槽底座中形成密闭空间,其后分别在0、5、15、30 min后用密封气瓶收集箱内气体。于白菜种植后进行土壤N2O排放通量取样,取样时间均为晴朗日上午9:00―11:00。N2O气体样品利用气相色谱仪(HP6890N,Agilent公司)测定,其检测器为电子捕获检测器(ECD),载气为N2,流量为2 mL/min,测定温度为330℃,色谱柱为PorpakQ填充柱,柱温70℃。
1.4 计算方法与数据分析
NH3排放通量计算公式:
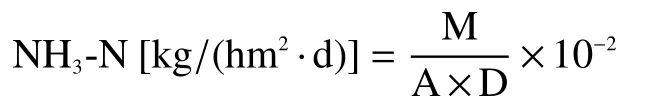
式中,M为单个装置平均每次测得的NH3量(NH3-N,mg);A 为捕获装置的横截面积(m2);D为每次连续捕获的时间(d)。
N2O气体排放通量计算公式:
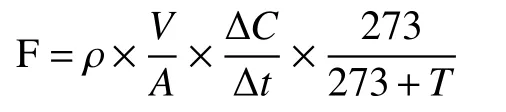
式中,F表示N2O排放通量[μg/(m2·h)];ρ表示标准状态下N2O的密度;V为采样箱体积(m3);A为采样底座内土壤表面积(m2);∆C/∆t表示气体的排放速率[μL/(L·h)];t为采样箱内温度 (℃)。
N2O积累量计算公式:
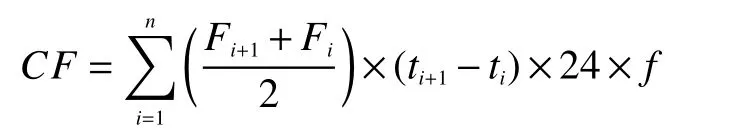
式中,CF为测定N2O气体的积累排放量(kg/hm2);Fi为第i次测定N2O气体的排放通量;24为1 h的排放通量换算为1天排放通量的换算系数;(ti+1–ti)为连续2次的测定时间间隔天数;n为观测总次数;f为单位换算系数 10−5。
氮肥利用率(NUE)计算公式:
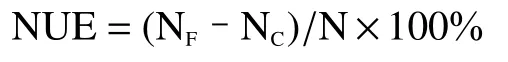
式中,NF和 NC分别为施氮区和对照区大白菜地上部氮素积累量;N 为当季施氮肥量。
基于SPSS 22.0,运用单因素方差分析(one-way analysis of variance),对不同处理的土壤理化性状、功能微生物数量、NH3排放、N2O排放通量进行单因素方差分析。数据均为平均数±标准误,用Origin 2021作图。
2 结果与分析
2.1 不同施氮处理土壤NH3排放的变化
土壤NH3排放通量总体呈现出CK<90CRU<90U
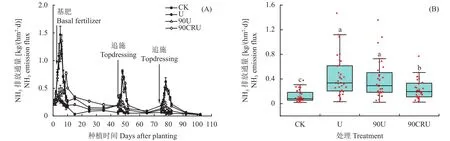
图2 不同施肥处理下NH3排放通量动态变化(A)和排放通量(B)Fig.2 NH3 emission variation (A) and emission flux (B) as affected by fertilizer treatments
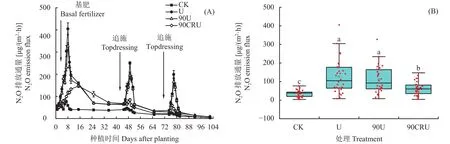
土壤NH3累积排放量呈现为CK<90CRU<90U 表2 不同施肥处理下生长季NH3累积排放量(kg/hm2)Table 2 The cumulative NH3 emission in different treatments during growing season 土壤N2O 排放通量与土壤NH3排放速率变化一致(图3)。CK、U、90U处理下,基肥期(种植0~40天),N2O 排放通量峰值出现在基施后7~9天,而90CRU处理峰值出现在基施后14~17天,90CRU峰值低于U和90U处理;追肥期后N2O 排放峰值出现在追肥后4~6天,90CRU处理峰值远低于U和90U处理。CK、U、90U和90CRU处理基肥期N2O排放最大峰值分别为 43.8、404.9、326.8 和 147.2 μg/(m2·h),高于追肥后峰值(图3A)。大白菜生长季土壤N2O排放通量(均值)如图3B所示。与CK相比,U、90U和90CRU处理土壤N2O排放通量分别显著增加了262.9%、223.1%和92.6% (P<0.01);与U处理相比,90U和90CRU处理其排放通量分别降低了11.1%和显著降低了50.5% (P<0.01);与90U相比,90 CRU处理N2O排放通量显著降低了44.3% (P<0.01)。 图3 不同施肥处理下土壤N2O排放通量动态变化(A)与N2O排放通量(B)Fig.3 N2O emission variation (A) and emission flux (B) as affected by fertilizer treatments 土壤N2O累积排放量呈现为CK<90CRU<90U 表3 不同施肥处理下生长季N2O累积排放量(kg/hm2)Table 3 The cumulative N2O emission in different treatments during growing season 与U处理相比,90CRU处理白菜产量增加了7.8%,差异不显著;与U处理相比,90U和90CRU处理吸氮量分别增加了5.2%和11.9%,差异未达到显著水平。与U处理相比,90U和90CRU处理氮素利用率分别提高了2.5和5.7个百分点,差异不显著(表4)。与U处理相比,90CRU 处理白菜产值增加了7.8%,差异不显著。同时降低了管理过程中因施肥所消耗的劳动力投入成本,与U处理相比,90CRU处理净经济效益增加了8.0%,差异不显著。由此,90CRU处理在减少劳动力投入、提高大白菜种植经济效益方面起到积极作用。 表4 不同施肥处理下大白菜产量、氮素利用率及经济效益的影响Table 4 Yields and nitrogen use efficiency of Chinese cabbage under different fertilizer treatments 施氮对土壤温度和湿度的影响不明显(表5),与CK相比,施氮处理显著增加了土壤NH4+-N、NO3–-N含量、脲酶(UR)活性、功能基因AOB-amoA、nirK数量(P<0.05)。与U处理相比,90CRU处理土壤NO3–-N含量和UR活性分别显著降低了26.4%和25.4%(P<0.05)。与U处理相比,90CRU处理AOB-amoA数量显著降低了34.8% (P<0.05)。与U处理相比,90CRU处理nirK基因数量显著降低了27.2% (表5)。因此,90CRU处理降低了NO3–-N含量、UR活性AOB-amoA、nirK功能微生物数量。 表5 不同施肥处理下土壤理化性质和功能微生物数量Table 5 Soil physical and chemical properties and function microbial population as affected by fertilizer treatments NH3排放通量与土壤环境因子、生物因子的关系如图4所示。NH3排放通量与土壤湿度、温度、NH4+-N、NO3–-N含量及脲酶活性呈现极显著线性正相关关系(P<0.01);而NH3排放通量与功能基因AOB-amoA、nirS和nirK数量关系不密切。N2O排放通量与土壤温度、湿度、NH4+-N、NO3–-N含量及功能基因AOB-amoA、nirS和nirK数量关系密切,均呈现显著线性正相关关系(P<0.001);而与脲酶活性关系不明显(图5)。由此可知,土壤NH4+-N、NO3–-N含量对土壤NH3排放和N2O排放起到积极作用,脲酶活性和不同功能基因对NH3排放和N2O排放的影响不同。 图4 NH3排放通量与土壤理化性质和功能微生物数量的关系Fig.4 Relationship between NH3 emission flux and soil property indexes, function microbial population 图5 N2O排放通量与土壤理化性质及功能微生物数量的关系Fig.5 Relationship between N2O emission flux and soil property indexes, function microbial population NH3排放是农田氮肥损失的重要途径之一,其排放速率主要受土壤状态、水肥管理等因素的综合影响[5,29–30]。本研究显示基肥期,U和90U处理NH3排放峰值均出现在施肥后3~6天,而90CRU处理其排放峰值延迟到施肥后9~11天,最高值峰值也由 U处理的 1.5kg/(hm2·d)和 90U处理的 1.4 kg/(hm2·d)降到 0.8 kg/(hm2·d)。究其原因,尿素施入土壤后与其中的脲酶直接接触,迅速水解为NH4+-N,而NH4+-N是NH3产生的底物,因而NH4+-N含量直接影响土壤NH3排放通量,故导致施肥初期出现土壤NH3排放峰[18]。本研究中使用的控释氮肥,其外层的纳米聚氨酯包膜材料具有疏水性,可以控制膜内尿素缓慢持续释放,使土壤中NH4+-N含量维持在较低水平,同时阻断包膜内尿素态氮与脲酶的直接接触,而土壤NH4+-N含量和脲酶活性是决定NH3排放的关键因素,因此施用控释氮肥能明显降低基肥NH3排放峰值并且延迟峰值出现时间,与前人研究结果[21,23,30–33]一致。 本研究结果证实,追肥后U和90U处理NH3排放峰值低于基肥期,与此同时90CRU处理 NH3排放通量显著低于U和90U处理。这主要是由于大白菜生长前期(基肥期)处于华北地区的8月份和9月份,为华北平原地区的炎热多雨期(图1),因而土壤温湿度高于生长中后期(10月和11月,追肥期),土壤温湿度高导致土壤脲酶活性增强,同时也促进了土壤微生物活性,因而导致NH3排放增大。另一原因是基肥施氮量占生育期的40%,此阶段大白菜处于苗期,需氮量少,多余的无机氮在高温高湿条件下很容易转化为气态氮排放到环境中;追肥每次施氮量占总施氮量的30%,此阶段大白菜处于生育中后期需氮量高,追施的氮肥大部分被作物吸收利用,无机氮在土壤中残留量相对较低,因而降低了土壤NH3排放。本研究中施用的控释氮肥释放周期是60天,前期氮素释放低,中后期氮素释放高,与大白菜需氮相吻合,控释氮肥释放后快速被大白菜吸收,减少了无机氮在土壤滞留时间,因而降低了NH3排放。由此可见控释氮肥一次性基施降低了大白菜种植中土壤NH3排放通量,尤其是显著降低了大白菜生长中后期的NH3排放通量。这与Xie等[19]在玉米、Guo等[21]和黄思怡等[31]在水稻种植中的研究结果一致,与单施尿素相比,控释氮肥减施10%~30%明显降低土壤中NH4+-N含量,减少农田土壤NH3排放损失。 土壤氮含量、通气状况、氮转化微生物及酶活性是影响农田N2O排放的关键因子[24–25,34–36]。其中化学氮肥施用是决定菜地N2O排放的最主要因素[17,24],本研究再次证实了这一结论,与不施氮肥土壤比较,施氮可显著增加N2O排放,减氮10%处理可降低N2O排放。这是由于土壤N2O是硝化和反硝化过程的产物,而硝化和反硝化过程均为酶促反应,其反应速度与底物浓度呈正相关,随着施氮量的增加,尿素水解反应的NH4+-N增加,其在土壤中转化为NO3–-N量也增加,为土壤硝化和反硝化提供丰富的底物,充足的底物亦促进了硝化或反硝化细菌活动,增加了硝化微生物AOB-amoA基因及反硝化微生物nirS、nirK基因数,因而促进了N2O排放[26,36–37]。本研究中U、90U、90CRU处理NH4+-N、NO3–-N含量及硝化基因AOB-amoA及反硝化基因nirS和nirK数量显著高于CK处理,可以解释施氮显著提高了土壤N2O排放,减氮10% (90U)在一定程度上减低了土壤NH4+-N、NO3–-N含量,使其土壤N2O排放量低于U处理。 纳米聚氨酯控释氮肥,通过调控膜内尿素缓慢持续释放,使土壤中NH4+-N含量维持在相对较低水平,抑制土壤中NH4+-N和NO3–-N转化速率,调控作物氮素吸收速率,协同调节土壤中NH4+-N和NO3–-N的含量;同时较低水平的NH4+-N、NO3–-N含量,在一定程度上降低了参与土壤氮循环的硝化功能微生物(AOB)和反硝化功能微生物(nirS、nirK)功能基因的数量,进而减少了土壤N2O排放。在水稻、玉米等作物上在等量氮肥投入条件下,控释尿素相比普通尿素均可以实现N2O减排[19,21,23,31],这与本研究结果一致,90CRU处理较90U和U相比,实现了N2O减排。 本研究中追肥后U和90U处理大白菜土壤N2O排放峰值低于基肥期,而此阶段90CRU处理土壤N2O峰值显著低于90U和U处理。究其原因是大白菜生长初期(基肥期)高底物(NH4+-N、NO3–-N)浓度、低植物N利用率及高温高湿的土壤环境、干湿交替频繁、土壤通气性差,促进了硝化与反硝化发生,有利于土壤N2O的形成与排放[23–24,37]。追肥期处于大白菜(生长中后期)快速生长时期,作物吸氮能力强,减少了土壤NH4+-N、NO3–-N的滞留,同时温度和降雨降低,这些因素均在一定程度抑制了硝化与反硝化作用,导致追肥期土壤N2O排放峰值低于基肥期,且控释氮肥一次性基施此阶段无追肥,更导致其排放峰值显著降低。由此可见控释氮肥一次性基施显著降低了大白菜种植中土壤N2O排放通量,尤其是生长中后期的排放。 合理降低氮肥用量可以在不影响产量和保证氮源的有效供给前提下,提高作物氮素利用率,降低NH3和N2O排放,保持了农业经济效益[25,29,38],这与本研究结果一致。本研究也表明,相对于U、90U处理,90CRU处理更有利于大白菜增产和显著减少氮素的气态损失,实现经济价值和环境效益的协调统一。本研究使用的控释氮肥(释放周期60天)可以满足河北地区大白菜整个生育期对氮素的需求,从源头上调控土壤NH4+-N和NO3–-N的含量,防止过剩的无机氮转变为气态氮排放,提高了氮肥利用效率和大白菜产量。控释氮肥一次性基施虽增加了肥料成本,但由于无追肥劳动力成本,且田间管理方式与当地农民习惯完全一致,不存在操作困难的问题,可有效解决当前农村青壮年劳动力缺乏问题。从经济效益和实际操作两个角度看,控释氮肥一次性底施这种施肥方式易于被当地农民接受,适合华北地区秋季大白菜种植。 控释氮肥一次性基施,将大白菜基肥期NH3排放通量峰值出现时间从基施后3~6天推迟到9~11天,N2O 排放通量峰值出现时间从基施后7~9 天延迟到14~17 天,峰值也均低于施用常规量和减量10%的尿素,且由于降低了土壤NO3–-N含量和脲酶活性,其NH3排放总量也分别较施用常规量和减量10%氮素显著降低了27.6%和19.2%。此外,一次性基施控释氮肥还降低了AOB-amoA、nirK功能微生物数量,致使其N2O 排放通量较施用常规量和减施10%氮素分别显著降低了50.5%和44.3%,排放总量分别较常规量尿素处理显著降低了23.2%。与常规量尿素处理相比,白菜的氮素利用率提高了5.7个百分点,产量提高了7.8%,同时减少追肥劳动力投入,净经济效益增加了8.0%。
2.2 不同施氮处理土壤N2O排放的变化

2.3 不同施氮处理大白菜氮肥利用率的变化
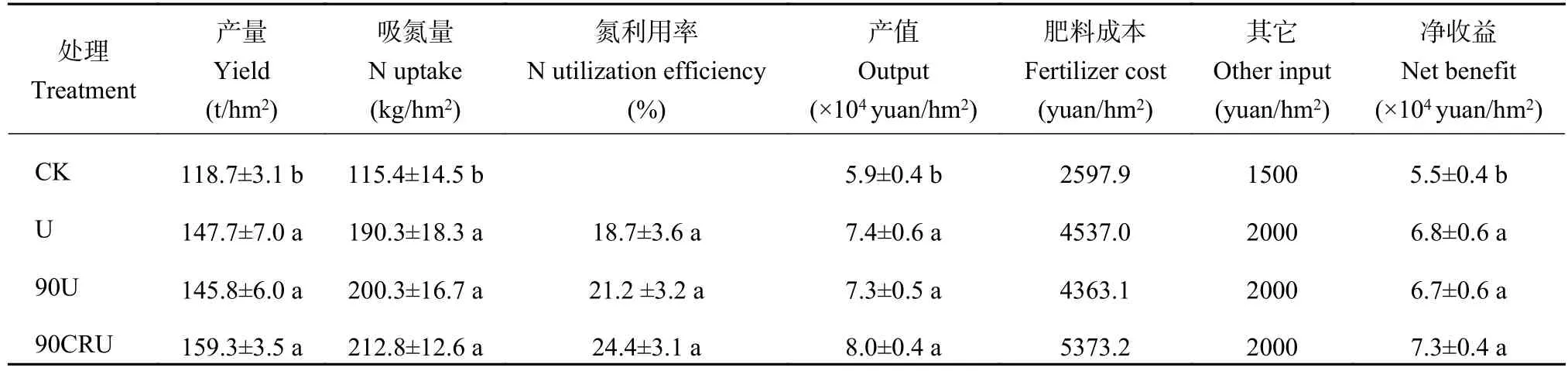
2.4 不同施氮处理土壤理化性质及功能微生物的变化
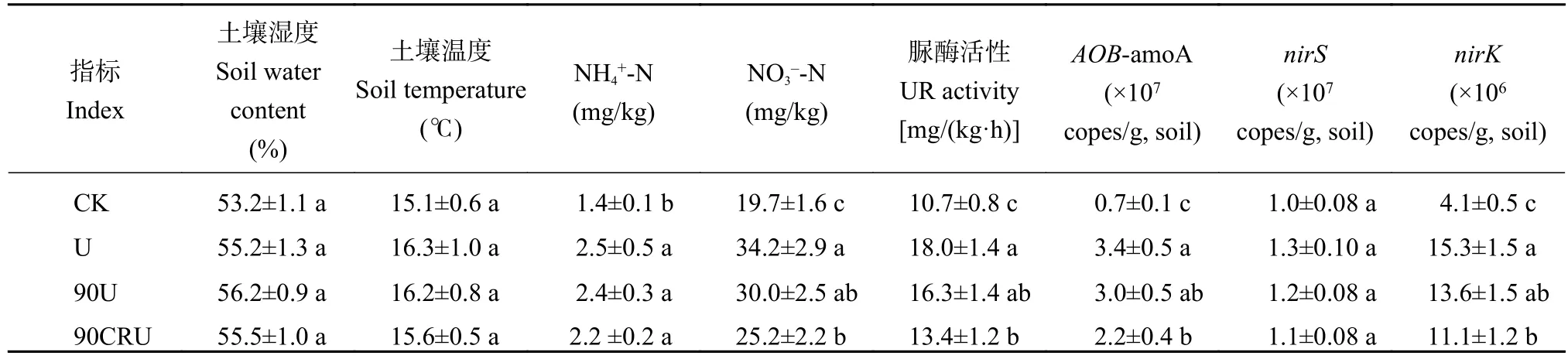
2.5 影响NH3和N2O排放的因素
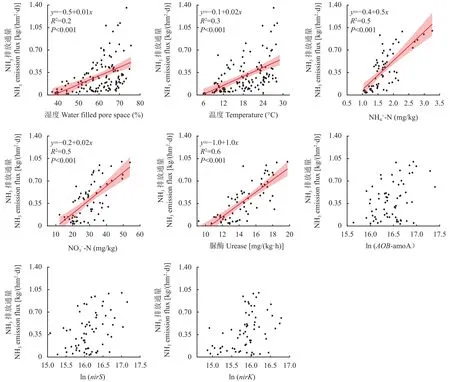
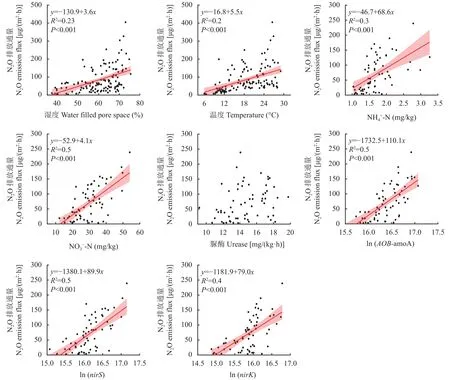
3 讨论
3.1 不同施氮处理对大白菜种植过程中土壤NH3排放特征的影响
3.2 不同施氮处理对大白菜土壤N2O排放特征的影响
3.3 不同施氮处理对大白菜产量和经济效益的影响
4 结论

