Cu2O-TiO2复合膜的制备及其光催化与产氢性能
王 熙, 蔡奕璇, 萧子君, 何 春, 李来胜
(1. 华南师范大学环境学院, 广州 510006; 2. 中山大学环境科学与工程学院/广东省环境污染控制与修复技术重点实验室, 广州 510006)
随着社会经济的持续发展以及人类日益增长的物质生活需要,化学能源出现紧缺,环境污染问题日益严峻,因此开发利用可替代的清洁能源和可再生能源就显得尤为必要[1]。氢能具有极高的能量密度和高燃烧值(约为汽油的3倍,仅次于核能),燃烧产物清洁,完全零排放,极具应用前景。然而,氢气是二次能源[2],主要通过其他途径[3]产生,譬如利用化石燃料(煤、石油和天然气)制氢[4]、利用生物质制氢[5]、用水制氢,而难以从自然环境中直接获取。作为可再生资源,生物质资源丰富,储备充足,相比化石燃料造成的污染小,但能量密度低、制备氢气的过程复杂,不适合推广[6-7]。若能利用自然可再生资源产氢,这将有助于缓解能源紧缺的现状,同时创造巨大的经济和环境效益。
太阳能作为世界上最清洁的可再生能源之一,辐射到地表的总功率巨大,相比其他能源更具持续性,可作为二次能源,且储量丰富,是制氢的理想能源[8]。因此,利用太阳能实现光催化制氢受到广泛关注。目前,光催化制氢技术已受广泛研究[9-11],如王熙等[9]将Cu2O和TiO2引入石墨烯制备出新型的光催化薄膜,在光催化产氢实验中该薄膜表现出很强的光催化产氢性能;廖添等[10]将Fe、Cr与TiO2共掺杂制备出纳米球用于光催化制氢,证明其具有良好的光催化稳定性。
光催化产氢主要利用半导体材料在合适的光源能量激发下,产生光生电子与光生空穴,并利用光生电子的还原性还原H+生成氢气的过程。现阶段,半导体光催化剂主要是n型半导体,材料多用金属氧化物和硫化物(如TiO2、Cu2O、ZnO、CdS等),其中TiO2因储量丰富、价格低廉、无毒无害、能带结构较为合理被广泛应用[12]。但是在一般情况下,TiO2只能被紫外光激发,且光生空穴和电子易复合,致使量子效率低下,导致TiO2的光催化活性较低[13],因此对TiO2进行改性提高其对可见光的利用是十分有意义的。
Cu2O通常为红色或黄色粉末,八面立方体,禁带宽度约2.0 eV[14],因其具有低毒、便宜、容易制备、吸收可见光、理论利用效率(9%~11%)较高以及能带隙可调等优点而成为颇具应用潜力的半导体材料[15],将其与TiO2进行复合可有效提高对可见光的利用率。在本研究中,利用Cu2O和TiO2进行复合制备了Cu2O-TiO2光催化剂薄膜,促使Cu2O导带上的部分光生电子迁移至TiO2的导带上,TiO2价带上的光生空穴迁移至Cu2O的价带上,增强了对可见光的吸收,抑制光生电子(e-)和空穴(h+)的分离,从而提高半导体光催化效果[16]。本研究还以甲醇溶液为模拟废水,研究Cu2O-TiO2催化甲醇的产氢性能以及影响产氢性能的相关因素。
1 实验部分
1.1 主要试剂与仪器
主要试剂:乙酸钠、乙酸铜、氢氧化钠、乳酸、甲醇、无水乙醇,均为分析纯,均由广州化学试剂厂生产。浓盐酸从广州光华化学厂有限公司购入,二氧化钛由广州和仟贸易有限公司提供。实验用水为去离子水(或自制超纯水)。
主要仪器:气相色谱仪(GC9560型,上海华爱)、300 W的氙灯(PLS-SXE300,北京畅拓)、UV-Vis漫反射光谱(U-3010,HITACHI)、X射线粉末衍射仪(D8 ADVANCE°,德国Bruker)、荧光分光光度计(RF-540,日本岛津)、扫描电子显微镜(Ultra 55,德国)、气氛保护箱式炉(QSXL-1008,杭州卓驰)。
1.2 Cu2O-TiO2复合光催化剂的制备
制备Cu2O薄膜光催化剂:称取4.10 g乙酸钠和1.99 g乙酸铜,用去离子水溶解,定容至500 mL;取120 mL溶液至反应器中,用3%(质量分数)盐酸调节pH至5.86;将已处理好的2.5 cm×3 cm铜片安装在光催化反应器中,在电压为1.85 eV、电流为0.30 A条件下电沉积90 min;最后将样品(Cu2O薄膜)置于马弗炉氮气保护和200 ℃下煅烧1 h。
制备Cu2O-TiO2复合薄膜:采用涂覆法将TiO2均匀的涂到Cu2O薄膜上。具体步骤:称量30 mg TiO2,溶于2 400 μL无水乙醇,置于超声中30~60 min使TiO2分散均匀;然后用移液枪吸取一定量的溶液均匀涂覆在已制备好的Cu2O薄膜上;将Cu2O-TiO2样品置于马弗炉氮气保护200 ℃下煅烧1 h,使TiO2和Cu2O紧密复合。
1.3 材料表征和性能测试
采用扫描电子显微镜(SEM)观察Cu2O的形态,并用X射线粉末衍射(XRD)分析Cu2O的晶型结构。采用紫外-可见漫反射光谱(UV-Vis DRS)和荧光光谱(PL)分析Cu2O-TiO2的光学性质。
1.4 Cu2O-TiO2产氢性能测试
1.4.1 探究光源对Cu2O-TiO2产氢性能的影响 光催化产氢实验的装置如图1所示,具体操作过程如下:先将光催化剂复合薄膜正确安装在光催化电解池中,以体积分数为20%甲醇水溶液或者葡萄糖溶液为牺牲剂,进行光催化反应实验。以功率为300 W的氙灯作为模拟太阳光的光源,实验过程中所使用的可见光由截止波长为420 nm的滤光片滤除紫外光得到,反应容器石英窗口距离光源约为10 cm。光催化反应前,整个体系用N2吹扫30 min,以便除去水中的溶解氧及光催化电解池中的氧气(O2)。采用循环冷却水系统恒定在室温(25 ℃),实验的光照总时间设定为1.5 h,每隔30 min从光催化反应器的气体取样口中采集气体样品,采用气相色谱(GC-TCD,TDX-01柱,载气Ar)进行H2产量的定量分析。

图1 实验装置示意图
采用单位面积的产氢速率RA衡量材料的光催化产氢活性:
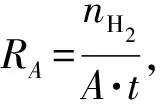
(1)
其中,RA为产氢速率(mmol/(h·m2)),nH2为氢气的产量(物质的量,mmol),A为复合薄膜的面积(m2),t为光催化反应时间(h)。
采用表观量子产率(Apparent Quantum Yield,AQY)评估空穴复合效率,采用草酸铁钾光量计[17]法测量总激发光子数。表观量子产率

(2)
其中,AQY为表观量子产率(%),nH2为氢气产量(物质的量,mmol),np为总激发光子数。
1.4.2 探究反应条件对产氢性能的影响 以功率为300 W的氙灯模拟太阳光为光催化产氢实验的光源,以甲醇水溶液作为模拟废水进行产氢反应实验。光催化反应器总体积150 mL,反应溶液100 mL,反应时间为120 min,采用TiO2质量分数分别为0%、10.4%、13.9%、34.7%、41.7%、55.6%、100%的Cu2O-TiO2为催化剂,最后用GC9560型气相色谱仪对H2进行定性、定量分析,计算氢气的反应速率。以功率为300 W的氙灯模拟太阳光为光源,配制不同体积分数(5%、10%、15%、20%、25%、50%)的甲醇溶液分别进行一系列的光催化产氢反应实验。采用功率为300 W的氙灯为照射光源,以体积分数为20%的甲醇水溶液为模拟废水,采用盐酸和NaOH调节模拟废水的pH(分别为3.88、5.24、8.97、11.01),开启光源(记录时间)进行光催化产氢实验,并于反应开始后的第30、60、90、120 min时取样进行相关测试。
2 结果与讨论
2.1 Cu2O的微观形貌
采用扫描电子显微镜拍摄Cu2O薄膜的微观形貌(图2),采用电化学沉积法制备所得的Cu2O晶体大小相近(图2A),均匀且紧密地沉积在基底表面。Cu2O微晶直径约1.5 μm,Cu2O是规则的多面体状晶体(图2A插图)。图2B为Cu2O-TiO2复合薄膜光催化剂的横截面图,在Cu2O膜上涂覆TiO2之后,Cu2O微晶几乎被TiO2完全覆盖,而Cu2O-TiO2表面相对均匀平整,Cu2O-TiO2的厚度约36.2 μm。

图2 Cu2O薄膜表面及Cu2O-TiO2/Cu横截面的SEM图
2.2 催化剂的晶相结构分析
图3为Cu2O和Cu2O-TiO2光催化剂薄膜的XRD图谱,2θ=29.57°、36.43°、42.31°、61.38°处的衍射峰分别为Cu2O的(110)、(111)、(200)、(220)晶面,与Cu2O的PDF卡片(JCPDS 78-2076)一致,说明已成功制备出了Cu2O。2θ=25.32°和48.06°处的衍射峰分别为TiO2(101)和(200)晶面,同时在2θ=29.57°、36.43°、42.31°、61.38°处均发现了Cu2O的衍射峰。此外,在复合薄膜的XRD图谱中并未发现CuO晶体的衍射峰,这说明在Cu2O-TiO2的制备过程中,Cu2O(Cu+)未被氧化成CuO(Cu2+),说明已制备出Cu2O-TiO2复合薄膜。

图3 Cu2O和Cu2O-TiO2薄膜的XRD图谱
2.3 紫外-可见漫反射光谱及光致荧光光谱分析
图4为Cu2O、TiO2和Cu2O-TiO2复合薄膜的UV-Vis DRS谱,反映了不同物质对光的吸收性质。TiO2只吸收紫外光(λ<400 nm),在可见光区域(λ=400~800 nm)基本无吸收;而Cu2O在波长400~600 nm范围出现最大的吸收峰,说明Cu2O对可见光有响应;Cu2O-TiO2复合薄膜在波长400~800 nm吸收可见光的能力逐渐增强。相比Cu2O和TiO2,Cu2O-TiO2复合薄膜对太阳光有较强的响应能力,这是因为Cu2O能够响应可见光,Cu2O和TiO2形成异质结后能够有效提高Cu2O-TiO2对光的吸收性能,使其对太阳光的利用范围扩展至可见光区[18]。

图4 Cu2O、TiO2和Cu2O-TiO2的UV-Vis DRS谱
当半导体受在光的激发下,电子从价带跃迁至导带并在价带留下空穴,当电子和空穴再通过复合发光,形成不同波长光的强度或能量分布的光谱图(图5)。Cu2O、TiO2和Cu2O-TiO2的最强荧光峰均位于波长400~500 nm,TiO2、Cu2O和Cu2O-TiO2显示出相似的光谱曲线。TiO2的荧光强度最高,TiO2、Cu2O和Cu2O-TiO2表观量子产率系数分别为9.33%、5.95%和64.4%。由此表明,相比TiO2和Cu2O薄膜,Cu2O-TiO2复合薄膜的光生电子和空穴复合效率最小,这说明在Cu2O-TiO2内部存在快速的光生载流子的迁移和分离。

图5 Cu2O、TiO2和Cu2O-TiO2的光致荧光光谱
2.4 TiO2质量分数对光催化活性的影响
为了获取更高的产氢效率,对Cu2O-TiO2复合光催化剂的组成进行优化,寻找光催化活性最好的TiO2质量分数。Cu2O-TiO2中TiO2的质量分数分别为0%、10.4%、13.9%、34.7%、41.7%、55.6%、100%,光催化时间为150 min,通过氢气的反应速率来确定最佳的TiO2质量分数。
由图6明显看出:当TiO2质量分数为0%(纯Cu2O)时,产氢活性最低,产氢速率仅为8.6 mmol/(h·m2)。然而随着TiO2质量分数的增加,产氢速率会不断上升。当TiO2质量分数为34.7%时,产氢速率最高(93.12 mmol/(h·m2)),是Cu2O的10.8倍。但是当TiO2质量分数进一步增加时,Cu2O-TiO2产氢速率会不断下降。当TiO2质量分数为100%(TiO2)时,产氢速率降至13.5 mmol/(h·m2)。通过PL光谱分析可知,Cu2O-TiO2薄膜产氢性能的提高是由于TiO2和Cu2O之间构成的异质结使Cu2O-TiO2薄膜能拓展材料对光的吸收波长范围,并且具有更强的光吸收能力,同时e-与h+得到有效分离,Cu2O与TiO2构成异质结,e-迁移至TiO2较低的导带上,而h+主要聚集在Cu2O较低价带上,从而促进光生电子-空穴对的分离,提高了Cu2O-TiO2薄膜的产氢活性。然而当TiO2质量分数进一步增加(大于34.7%)时,产氢速率开始下降,可能是由于TiO2质量分数过高降低了光的渗透率,使传播至Cu2O表面的光减少,导致内层的Cu2O未得到充分激发,从而减弱了Cu2O和TiO2的协同作用。这也说明TiO2和Cu2O之间形成的异质结能更有效地降低e-与h+的复合率,从而提高光催化的产氢速率。

图6 TiO2质量分数对产氢性能的影响
2.5 Cu2O-TiO2不同光源对产氢性能的影响
表1为Cu2O-TiO2在不同光源(紫外光、可见光、模拟太阳光)下的产氢速率,Cu2O-TiO2复合薄膜在紫外光和太阳光的照射下均能产生氢气,其中在太阳光下产氢速率最高,但可见光的照射下几乎不产生氢气。由UV-Vis漫反射光谱(图4)可知,Cu2O-TiO2复合催化剂既可以吸收紫外光,又可吸收可见光。而在太阳光下的产氢速率是紫外光下产氢速率的2.45倍,这说明Cu2O-TiO2不仅利用了紫外光,还利用了太阳光中的可见光,使Cu2O导带上的部分光生电子能迁移至较高电位的TiO2导带上,TiO2价带上的光生空穴会迁移至较低电位的Cu2O价带上,有利于促进光生电子的分离。然而在可见光条件下,Cu2O-TiO2薄膜不能产生氢气,这可能是因为可见光只能使Cu2O激发,其能量达不到还原水(H2O)或者氢离子(H+)产生氢气所需能量;此外,外层的TiO2覆盖在Cu2O表面,在可见光下TiO2没有被激发,Cu2O-TiO2异质结没有发挥作用,导致e-和h+的数量减少,因此无氢气产生。

表1 Cu2O-TiO2在不同光源下的产氢速率
2.6 Cu2O-TiO2光催化产氢的影响因素
以甲醇溶液为模拟废水,分别在不同甲醇浓度和不同pH条件下进行产氢实验。随着甲醇体积分数的逐渐增加,产氢速率不断增加(图7)。当甲醇体积分数为50%时,产氢速率达到了最大值,这是因为甲醇作为牺牲剂可以产生羟基自由基(·OH)消耗了光催化剂的h+,促进了光生载流子的分离,有利于H+得电子被还原生成氢气(H2),因此甲醇体积分数越大,能够消耗大量电子空穴,从而使产氢速率越高。在反应前期和中期(30~90 min),体积分数为5%~20%的甲醇产氢速率基本在同一水平上,直到在反应的后期(90~120 min)才开始明显分化。同一时间点,甲醇体积分数越高,产氢速率越高。
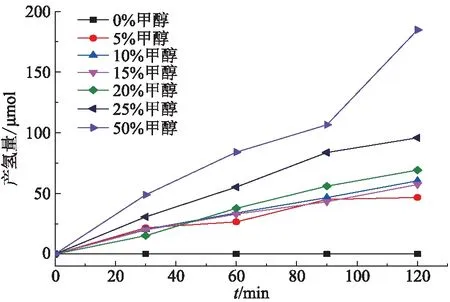
图7 甲醇质量分数对产氢量的影响
pH对产氢量的影响如图8所示,在pH 3.88条件下,产氢量最大。这是因为:一方面,在空穴还原H+产氢的过程中,pH越低溶液中H+浓度越高,越有利于电子还原产氢;另一方面,产氢速率并不是随pH的升高而降低,pH 8.97下的产氢量明显比pH 5.24下的产氢量大,这主要是因为OH-可与空穴反应生成羟基自由基,进而降解甲醇,在弱碱性条件下,溶液中OH-浓度较高,有利于空穴的消耗,从而促进光生电子与空穴的分离,最终提高了产氢效率。

图8 pH对产氢量的影响
3 结论
通过电化学沉积法和涂覆法制备出致密而均匀的Cu2O-TiO2复合薄膜光催化剂,证明了其具有较高的光催化活性。相比单一的Cu2O和TiO2,所制得的Cu2O-TiO2复合薄膜对太阳光有较宽的光谱响应能力,能够降低电子和空穴的复合率,提高对太阳能的利用率,从而提高氢气的产量。单一Cu2O或TiO2光催化剂的产氢效率不及Cu2O-TiO2复合光催化剂的产氢效率高:当TiO2质量分数为34.7%时,光催化产氢速率最大,且随着甲醇体积分数的增加而增大;当甲醇体积分数为50%时,产氢速率最大。产氢量容易受到溶液中的H+和OH-浓度的影响:pH越小,越能提供更多的H+和电子结合,生成H2;而在弱碱性条件下OH-与空穴结合,有利于空穴的消耗,从而促进光生电子与空穴的分离,提高产氢效率。

