梯度营养稀释法筛选贫营养净水微生物的研究
邱锦鸣,吴佳佳,刘 哲,薛陈杰,刘雪梅
(淮阴工学院化学工程学院,江苏 淮安 223003)
贫营养微生物又称寡营养微生物,大部分生长在有机质匮乏的环境中,如土壤、湖泊河水、地下水、沙表土等地。将贫营养微生物从环境中分离提取出来,用于自来水工艺中低浓度溶解性污染物的去除,这是近年来在给水处理领域形成的一个新思路。目前,在贫营养净水微生物筛选方面已经取得了一定的进展。从不同介质中筛选的高效贫营养细菌在碳、氮营养元素去除方面均展现了良好的性能[1-3]。由于贫营养细菌增殖速度较慢,扩大化培养成为贫营养微生物净水技术应用的重要制约因素。部分国内外学者开展了贫营养微生物富集培养方法的相关研究,已见报道的技术方法包括灭绝稀释培养法、扩散箱培养法以及各种不可培养细菌的富集方法[4-6]。然而,现有成果大多局限于实验室内,距离规模化生产、使用还有一定差距。
兼性营养细菌既能在贫营养基上培养,也能在富营养环境下生长,易于扩大化培养。本研究采用梯度营养稀释法进行贫营养微生物的筛选,从而获得兼性贫营养净水菌株,有效克服贫营养净水微生物难以富集培养的难题。
1 材料与方法
1.1 样品采集
采集淮安市二河水源地水样和表层底泥。水样用脱脂棉过滤,除去水中的悬浮物,得到有机质均一的水作为试验用水;底泥溶于灭菌蒸馏水,摇匀后静置,取上层清液,同样经脱脂棉过滤后得到试验用水。
1.2 培养基的制备
牛肉膏0.5 g、蛋白胨1 g和氯化钠0.5 g溶解于100 mL无菌水中,得到富营养培养基,依次稀释10倍、100倍、1 000倍和10 000倍,得到不同浓度水平的贫营养液态培养基。将琼脂按1∶50加入液态培养基,制备固体培养基。
1.3 菌株的分离
利用平板划线法在富营养培养基上划线分离菌株,28℃培养。待长出群落后,不同形态菌落划线分离,直到纯化至单菌落为止。将纯化后的菌株依次接种于10倍、100倍、1 000倍和10 000倍稀释培养基中培养,留取在1 000倍和10 000倍的培养基中能够生长的菌落,转入斜面保存。
1.4 高效净水兼性贫营养细菌的筛选
将经分离纯化的兼性贫营养菌株接种到液态富营养培养基中,28℃200 r/min过夜培养,获得含大量菌体的菌液。将菌液在5 000 r/min离心2 min,用灭菌蒸馏水洗涤3次,得到只含有菌体而无培养基的菌液。将富集培养的纯化菌液接种到微污染水体以及无菌水中,投菌量保持在105~106cfu/mL,在28℃下静置培养7 d。通过投菌前后总有机碳(TOC)的变化筛选高效净水菌株。其中TOC采用红外吸收法测定。
1.5 菌株鉴定
采用革兰氏染色进行菌株形态和类别的识别。采用16SrDNA基因法对菌株进行分子鉴定。按照细菌DNA基因组提取试剂盒说明书提取分离菌的DNA作为PCR模板。PCR体系为上、下游引物和模板各1μL,ddH2O 22μL,2×Taq MasterMix 25μL,总体积为50μL。PCR扩增反应程序为94℃预变性4 min;94℃变性45 s,55℃退火45 s,72℃延伸60 s,共30个循环;72℃修复延伸10 min。琼脂糖凝胶电泳纯化扩增,送上海生工生物工程公司测序。测序结果在NCBI的BLAST分区检索并比对分析,鉴定菌株类别。
1.6 菌株生长曲线的测定
采用光密度法测定菌株的生长曲线。将筛选出的高效贫营养细菌分别接种在富营养以及稀释1 000倍和10 000倍的液态培养基中,28℃200 r/min摇床培养,测量不同时间菌液的光密度(OD),绘出各菌株在不同营养条件下的生长曲线。
1.7 菌株理化特性分析
对筛选出的菌株进行碳、氮营养元素利用特性、耐盐性分析以及双氧水和乙醇的抗性分析。碳源4 g、氮源1.2 g、磷源0.24 g以及200 mL无菌水配置液态培养基,按照“1.5”方法进行菌株接种,初始浓度保持106cfu/mL左右。调整碳源及氮源类别,比较培养基的浑浊程度来观察菌体的生长情况。在液态培养基中添加不同浓度的氯化钠、双氧水以及乙醇,根据培养基的浑浊程度判断菌株的耐盐性、双氧水抗性及乙醇抗性。
2 结果与分析
2.1 兼性净水贫营养微生物的分离和筛选
2.1.1 兼性贫营养细菌的分离 本研究共分离出36种细菌,其中从水样中分离出15种细菌,编号分别为A1~A15,从底泥中分离出21种细菌,编号分别为B1~B21。将分离出的菌株依次接种到贫营养培养基上培养,得到8株兼性贫营养细菌,分别为A3、A5、A6、A9、A10、B2、B4、B6。
2.1.2 高效贫营养细菌的筛选 选取水源地微污染水体,初始TOC浓度为25.06 mg/L。分别向水体中投放8种兼性贫营养细菌,同时设置2份未投加菌株的水样作为空白对照。每日测定TOC浓度。TOC浓度变化曲线和7日降解率分别见图1和图2。
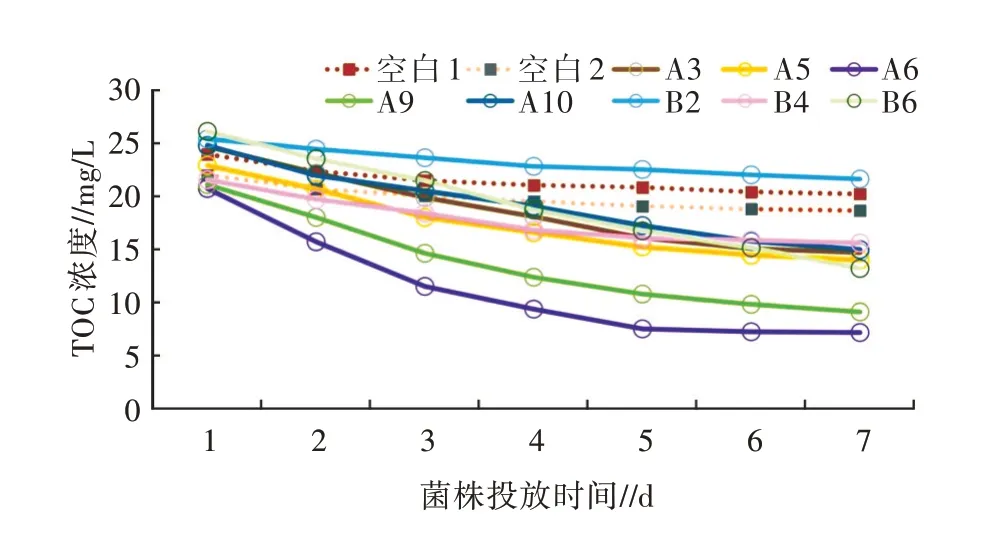
图1 投放净水菌株后微污染水体TOC浓度变化曲线
由图1、图2可知,菌株投加后,均可不同程度地降低水体中TOC的浓度,且浓度下降趋势逐步趋缓。未加入菌株的空白对照组TOC也有一定程度的下降,分别为19.52%、25.81%,推测是水体本身含有的微生物发挥的净水效应。在8组菌株投加的水样中,除B2组,其他7个组别第7日TOC浓度均低于空白组。处理效果相对较好的是A6和A9,降解率分别达71.52%和63.80%。该降解率与顾祖宜[7]及田兴华[8]筛选的高效营养净水微生物对有机碳的降解率大体相当。

图2 不同菌株所在微污染水体中TOC的7日降解率
2.2 菌株鉴定
2.2.1 菌株的形态特征 菌株经革兰氏染色后,在油镜下观测各菌株形态如图3所示。从图3可以看出,A6和A9均为革兰氏阳性菌。就外观形态而言,A6近似球状,A9为杆状。
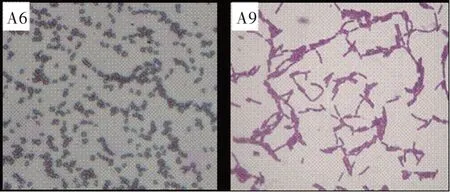
图3 高效兼性净水贫营养细菌的油镜观测
2.2.2 菌株分子鉴定 用16SrDNA基因法对该菌株进行鉴定。本试验提取了A6和A9的基因组DNA,通过PCR扩增后DNA的1.2%琼脂糖凝胶电泳检测如图4所示,2个菌株的DNA抽提效果较好,条带单一,清晰明亮,A6大小位于Marker 1 kb和3 kb条带之间,A9位于Marker 0.5 kb和1 kb条带之间。
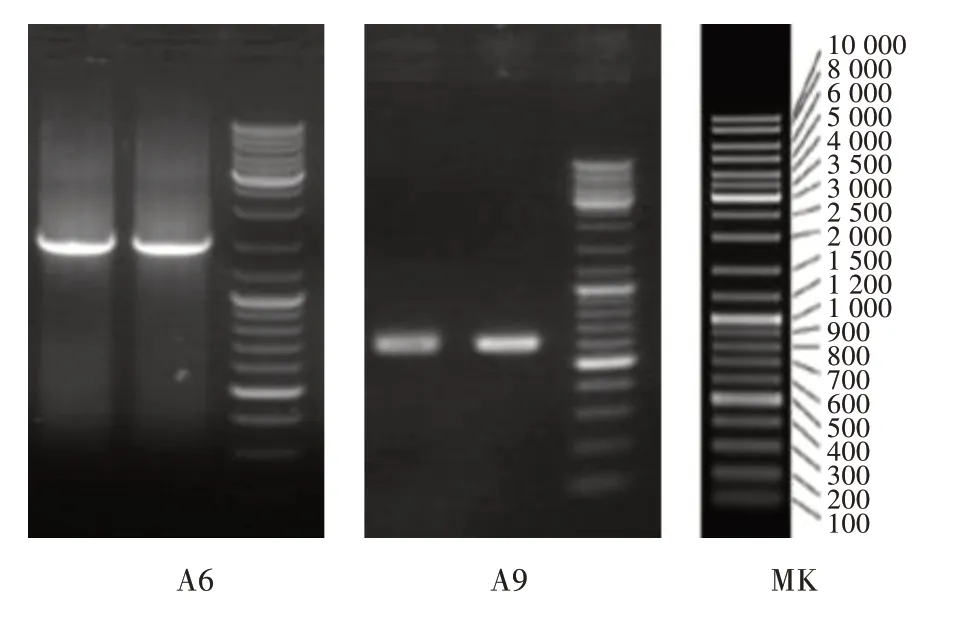
图4 菌株DNA凝胶电泳
筛选出的高效净水细菌分别为短小芽孢杆菌(Bacilluspumlus)和蜡状芽孢杆菌(Bacilluscereus)。由于芽孢杆菌具有极强的生命力,能在恶劣的环境中利用有机质,其作为微生物净水剂已经在污染处理、养殖水体净化中得到应用[9,10]。本研究净水试验表明,短小芽孢杆菌和蜡样芽孢杆菌TOC的降解率也高于其他菌株。
2.3 菌株生长特性曲线
由生长曲线(图5)可以看出,无论是短小芽孢杆菌还是蜡状芽孢杆菌,其对数期启动均随着培养基浓度的降低而呈滞后趋势,光密度最大值随着培养基浓度的降低而依次减小。其中,短小芽孢杆菌在富营养、稀释1 000倍和稀释10 000倍培养基中光密度最大值分别为4.51、2.71和1.39;而蜡状芽孢杆菌在富营养、稀释1 000倍和稀释10 000倍培养基中的光密度最大值分别为3.86、1.45和1.11。由此可见,通过提高培养基的浓度水平,可以显著提高兼性贫营养净水微生物的富集效率。
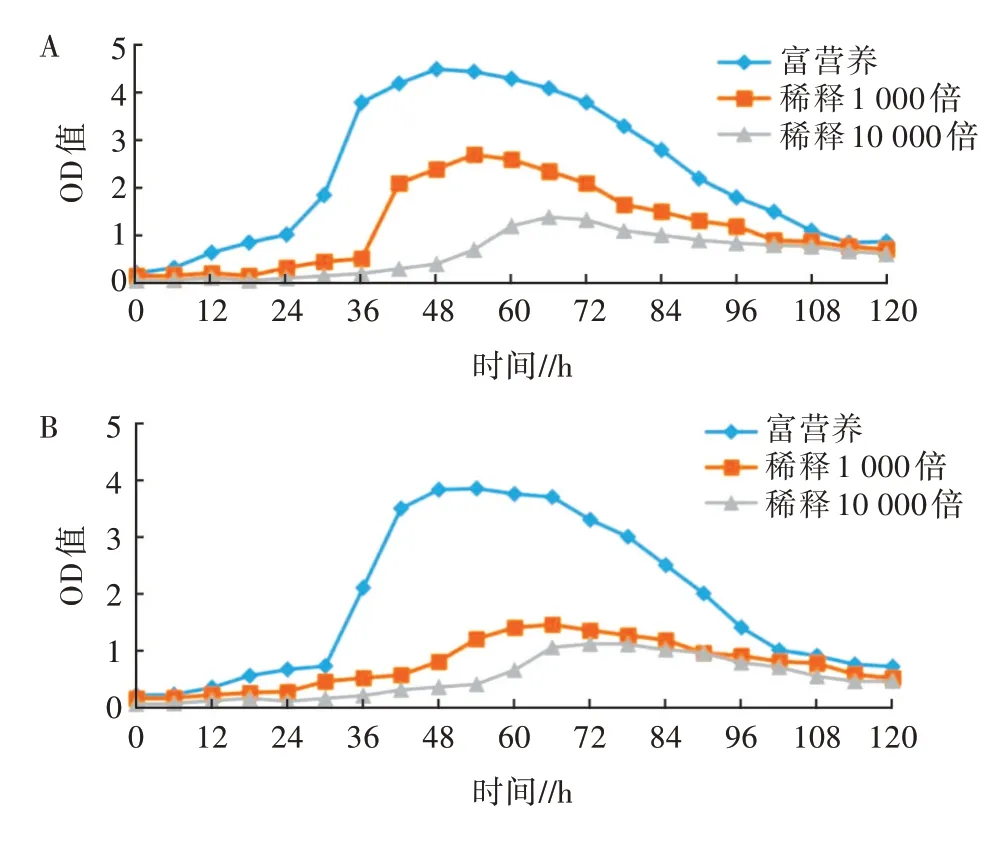
图5 短小芽孢杆菌(A)和蜡状芽孢杆菌(B)在不同浓度培养基下的生长曲线
2.4 菌株理化特性分析
2.4.1 碳源利用特性分析 不同种类的微生物利用碳源的能力存在差别,微生物利用的碳源物质主要有糖类、有机酸、醇、脂类、烃及碳酸盐等。选用净水能力较好的A6和A9菌株进行多种碳源利用能力试验,空白组中无碳源添加。恒温摇床上过夜培养后出现浑浊,说明菌株有生长,能对相应碳源物质加以利用,未出现浑浊的,说明菌株无生长。从表1可以看出,A6和A9菌株无法在无碳源和碳酸钠作为碳源的情况下生存,可在葡萄糖和乙醇的环境下生存。A9无法利用甲醇作为碳源生长,而A6则可以利用甲醇生长。

表1 菌株对碳源物质的利用
2.4.2 氮源利用特性分析 试验选取作为氮源的物质有NH4Cl、(NH4)2SO4、KNO3和肌苷。从表2可以看出,A6和A9株菌无法在无氮源的情况下生存,可在NH4Cl、(NH4)2SO4、KNO3等作为氮源的培养基中生长,说明2种菌株都可以利用自然界中的硝态氮和铵态氮等无机氮。此外,A6也可以利用肌苷作为氮源,而A9则不能利用肌苷作为氮源。

表2 菌株对氮源物质的利用
2.4.3 菌株耐盐性试验 对营养液中无机盐的有无进行生长分析。从表3可以看出,当NaCl的浓度为0.5%时,2个菌株均生长良好。随着NaCl浓度的升高,菌株生长状况逐渐变差。当NaCl的浓度达3%时,A9菌株停止生长;当NaCl的浓度达5%时,A6菌株培养72 h仍未见生长。

表3 菌株对无机盐的利用
2.4.4 菌株对双氧水的抗性试验 H2O2作为强氧化剂,可以产生能破坏细胞核酸、蛋白和磷脂的羟基自由基,从而达到杀菌的目的。用双氧水对A6和A9菌株进行抗性试验(表4),当双氧水浓度为0.03%和0.3%时,A6和A9菌株均可以生长,当双氧水浓度达3%时,2种菌株均难以生长。由此可见,浓度为3%的双氧水可以破坏上述细菌的细胞核酸、蛋白质和磷脂等,从而达到杀菌的目的。

表4 H 2O2浓度对菌株生长情况的影响
2.4.5 菌株对乙醇的抗性试验 75%乙醇是常用的皮肤消毒剂,它能溶解细胞脂类物质,同时也可以使蛋白质变性。本试验采用不同体积分数的乙醇对菌株进行抗性试验。从表5可知,较低体积分数的乙醇可以成为菌株的碳源。但是当体积分数达10%时,乙醇就会对菌株产生毒害作用,这可能与乙醇达到一定的体积分数会破坏细菌的蛋白质结构有关,导致菌株难以生长,从而起到杀菌的目的。

表5 乙醇体积分数对菌株生长情况的影响
3 结论
本研究采用梯度营养稀释法从水源地水体及底泥中筛选兼性贫营养微生物。通过培养基接种试验以及净水试验,筛选出2株高效的净水贫营养微生物,分别为短小芽孢杆菌和蜡样芽孢杆菌,两者对TOC的7日去除率分别达71.52%、63.80%。生长曲线试验表明,提高培养基的浓度可以显著提高细菌的富集效率。理化特性分析表明,2种兼性贫营养细菌生长均利用多种碳源和氮源,但在具体种类上存在一定差别,表明使用多种净水微生物复配可能优于单一微生物菌株的使用。耐盐及抗性试验表明,高盐环境对微生物生长具有一定抑制作用,浓度为3%的双氧水和体积分数为10%的乙醇均能将A6和A9杀死,因此2种菌株能安全地用于自来水净水工艺中。

