颞浅动脉-大脑中动脉分流术在颅内复杂动脉瘤手术中的应用
黄 河 刘志文 刘彬彬 王 翼 刘 宁 潘 力 杨 铭 宋 健 姚国杰 马廉亭
颅内复杂动脉瘤一般是指介入或开颅手术处理都有较大难度和风险的动脉瘤,包括巨大动脉瘤、夹层动脉瘤、蛇形动脉瘤、假性动脉瘤、瘤颈钙化粘连严重和涉及分支血管的动脉瘤。随着介入技术和材料的进步,大部分颅内动脉瘤可以通过介入的方式得到有效的处理,但仍有些颅内复杂动脉瘤需要开颅手术治疗。由于颅内复杂动脉瘤可能存在瘤颈粘连严重,导致术中分离困难,还可能需要反复调整瘤夹,因此需要长时间的临时阻断载瘤动脉。这样会导致动脉瘤远端血管供血区低灌注,甚至引起脑缺血性事件。如何缩短脑组织低灌注时间,是颅内复杂动脉瘤开颅手术面临的重要问题。为了解决这一问题,有学者尝试在处理动脉瘤前,先行颞浅动脉(superior temporal artery,STA)与 大 脑 中 动 脉(middle cerebral artery,MCA)M2~M3段分流术,在维持远端脑组织血流灌注的情况下,再进行动脉瘤的处理[1]。我们应用这一技术处理2例颅内复杂动脉瘤,获得良好的效果,现结合文献复习,总结如下。
1 病例资料
病例1:64岁女性,因突发剧烈头痛6 h入院。头部CT示蛛网膜下腔出血,右侧床突旁类圆形稍高密度影(图1A)。DSA示右侧颈内动脉后交通段巨大动脉瘤,大小约2.5 cm×2.1 cm×1.9 cm;左侧颈内动脉后交通段镜像动脉瘤,大小约1.0 cm×0.8 cm×0.9 cm;双侧大脑后动脉均为胚胎型(图1B、1C)。由于双侧大脑后动脉P1段均显影,均为胚胎型,存在倒灌血流,无法实施有效的球囊闭塞试验(balloon occlusion test,BOT)。右侧压颈试验发现,前交通动脉未开放。头部CT显示右侧侧裂池和鞍上池出血量较多,考虑右侧颈内动脉后交通段巨大动脉瘤为责任动脉瘤。若采用介入治疗,可采用常规支架辅助弹簧圈栓塞,但对于巨大动脉瘤来说,复发率较高,且治疗费用高;而采用血流导向装置,虽可以提高治愈率,但术后需要较强的抗血小板治疗,对于此例破裂动脉瘤是不合适的。在和家属充分沟通后,选择开颅手术。手术方案为STA-MCA分流+动脉瘤塑形夹闭术,若动脉瘤无法夹闭,则采用颈外动脉-桡动脉-MCA高流量分流术后,行动脉瘤孤立术。全麻成功后,取仰卧位,头向左侧偏转30°,额颞部弧形切口,翻开皮瓣后从颞浅筋膜内分离STA的顶支和(或)额支,游离出STA,长度6~7 cm,并将游离段穿过颞肌。STA近端临时阻断后,用肝素盐水反复冲洗管腔,远端约1 cm长度的血管剔除外膜,修剪成鱼口样待下一步吻合用。按常规翼点入路铣开骨瓣,形成4 cm×6 cm大小骨窗。解剖侧裂,显露MCA M2段,选择分支血管较少处作为吻合口,远近端及分支血管临时阻断,用显微剪剪开约1.5 mm长度缺口,用肝素盐水反复冲洗,美兰染色,用10-0显微缝合线间断缝合,进行STA-MCA M2段端侧吻合。吻合完成后,用超声探头探测确认吻合口通畅后行动脉瘤的分离和夹闭。反复多次调整动脉瘤夹,因瘤内血栓和大脑后动脉回返血流持续充盈瘤体,导致无法对载瘤颈内动脉进行有效塑形,在确认电生理监测无异常改变和双支STA吻合口均通畅后,对动脉瘤进行孤立处理,切开动脉瘤壁,切除瘤内血栓。术后无明显神经功能障碍,复查CTA及CTP示巨大动脉瘤不显影,右侧STA双支吻合口通畅,右侧大脑半球脑灌注无明显异常,右侧MCA供血区血流重建满意(图1D~F)。术后6个月电话随访,改良Rankin量表(modified Rankin scale,mRS)评分1分。
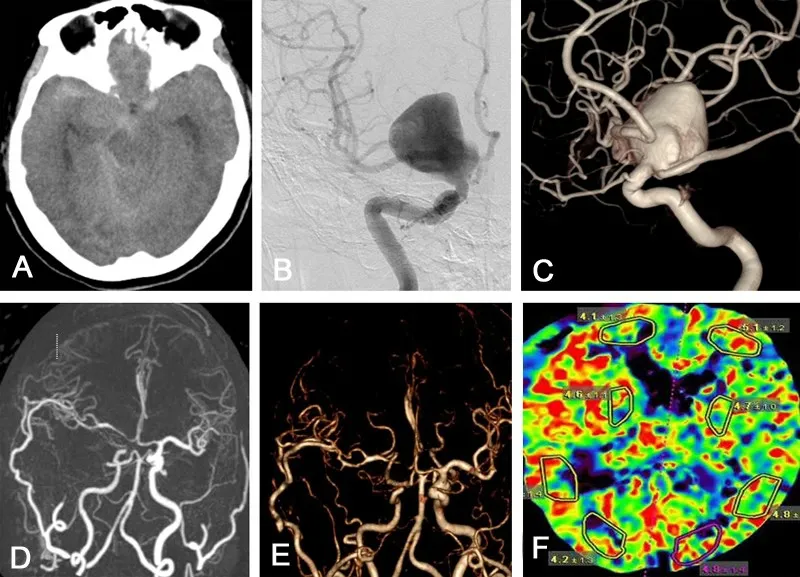
图1 右侧颈内动脉后交通段巨大动脉瘤颞浅动脉-大脑中动脉分流术辅助动脉瘤孤立术前后影像
病例2:50岁男性,因头晕检查发现右侧MCA分叉部动脉瘤。入院DSA示MCA分叉部动脉瘤,大小约1.3 cm×1.5 cm×0.8 cm,MCA M2段下干粗大,上干纤细,上干起始部为瘤颈的一部分(图2A)。若采用介入治疗,需要使用Y形支架技术,且上干纤细,支架内容易形成血栓造成血管闭塞;若开颅手术夹闭瘤体,瘤颈有塑形可能,但同样存在上干闭塞的风险。手术方案为STA-MCA分流+动脉瘤夹闭术。分流术的意义在于如果MCA上干能保留,术中可以起到预防缺血性事件的作用;如果MCA上干闭塞,可以起到重建上干供血区血流的作用。手术步骤同病例1,术中动脉瘤瘤体顺利夹闭,瘤颈塑形满意,MCA上干予以保留,分流血管通畅,MCA供血区灌注无异常(图2B、2C),术后无神经功能障碍。术后6个月电话随访,mRS评分0分。
2 讨论
颅内复杂动脉瘤往往包含以下特征:①体积巨大,直径≥2.5 cm;②瘤颈较宽;③瘤腔内血栓形成;④瘤颈钙化或含有动脉粥样硬化性斑块;⑤分支或穿支血管从瘤体或瘤颈发出;⑥夹闭或介入治疗后的复发;⑦缺少侧支代偿;⑧梭形动脉瘤、夹层动脉瘤、假性动脉瘤等特殊形态和类型[2]。对于大部分颅内复杂动脉瘤,常规的夹闭或弹簧圈栓塞都很难达到满意的治疗效果,且伴随较大的治疗风险。
尽管随着介入材料和技术的进步,介入技术在治疗颅内复杂动脉瘤方面取得了一些进展,例如支架辅助技术治疗宽颈动脉瘤、利用微导丝或微导管进行分支血管保护、利用交叉支架辅助栓塞分叉部动脉瘤、利用血流导向装置治疗巨大动脉瘤、套叠支架技术用于治疗夹层动脉瘤、覆膜支架技术治疗夹层动脉瘤或假性动脉瘤等,但由于部分存在抗血小板禁忌或经济条件限制,介入治疗本身也存在支架内血栓形成和复发率高等问题,仍有一部分复杂动脉瘤还是需要进行开颅手术处理。
颅内复杂动脉瘤的开颅手术方式主要包括三种情况:①动脉瘤塑形夹闭+载瘤动脉管腔塑形重建术,主要针对宽颈动脉瘤和部分巨大动脉瘤,不适用于夹层动脉瘤或梭形动脉瘤等非囊性动脉瘤;②动脉瘤孤立术,主要针对侧支代偿好,能够耐受BOT的情况;③动脉瘤孤立+颅内外血管分流术进行血流重建,主要针对不能耐受BOT的情况。STA-MCA分流术主要适用于后两种情况,第一种情况下若预估临时阻断时间过长,也可先应用该技术。
首先,STA-MCA分流术可以延长临时阻断时间,降低缺血性事件的发生率。临时阻断可有效降低瘤体压力,缩小动脉瘤体积,减少对正常血管的遮挡;当术中动脉瘤破裂时,可有效减少出血,以保持手术视野清晰,有助于动脉瘤的安全分离和夹闭。但临时阻断时间的延长会增高脑梗塞的发生率。动物模型研究表明,临时阻断10~20 min可导致核心区散在神经元死亡,临时阻断1 h可以导致核心区全部神经元死亡,临时阻断2~3 h可以导致缺血半暗带全部神经元死亡[3]。临床研究显示,临时阻断<14 min的脑梗塞发生率为0%,14~21 min的脑梗塞发生率为19%,22~30 min的脑梗塞率为33%,>30 min的脑梗塞发生率为100%[4],因此,一般认为临时阻断20 min以内是安全的。对于颅内复杂动脉瘤手术,无论是夹闭术,还是孤立+高流量分流术,临时阻断往往超过20 min,尽管可采用间断性恢复血流的方式,但是操作时间的延长仍会带来脑梗塞的风险。分流术的主要意义在于提前将STA血流引入MCA供血区,延长动脉瘤安全操作的时间,降低因临时阻断时间过长引起的脑梗塞和缺血再灌注损伤的风险。
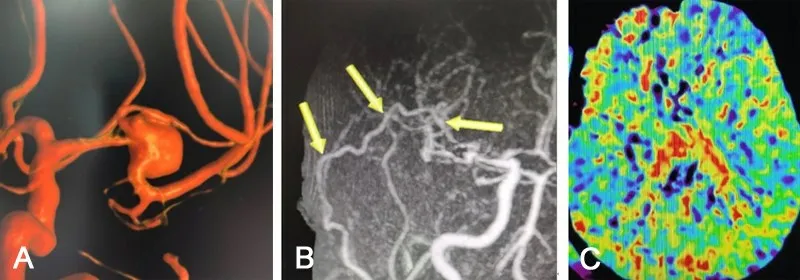
图2 右侧大脑中动脉分叉部动脉瘤颞浅动脉-大脑中动脉分流术辅助动脉瘤夹闭术前后影像
其次,STA-MCA分流术可在动脉瘤孤立术时提供保护性血流。在进行动脉瘤孤立、载瘤动脉闭塞之前,必须行BOT试验来验证是否对载瘤动脉闭塞具备代偿能力。但也有研究表明,即使通过BOT试验,术后仍有一定概率发生迟发性脑缺血[5]。也有学者提出,对于年轻病人,即使通过BOT试验,也推荐行分流术,理由是这部分病人的载瘤动脉闭塞后会引起其它血管内的血流动力学改变,这种改变的长期存在会促进局部动脉瘤生长,例如前交通动脉动脉瘤[6]。因此,对能够耐受载瘤动脉闭塞的病人,行STA-MCA分流术,能够缓冲血管闭塞后引起的血流动力学改变,也能减少迟发性脑缺血事件。
最后,双支STA-MCA分流术可提供高流量血流。STA-MCA分流术是最常用的颅内外血管分流方式。一般情况下,单支STA分流术可以提供20~30 ml/min血流量,被认为是一种低流量分流。因此,对本文病例2及类似病人,MCA M2上干比较纤细的血管进行血流重建时,可以直接考虑行STA单支分流术。而当需要对整个大脑半球进行血流重建时,STA单支能提供的血流量肯定是不足的,而需要进行桡动脉或大隐静脉作为分流血管的高流量分流术。尽管高流量分流术可以提供80~120 ml/min的血流量,但其操作过程复杂,存在术后分流血管闭塞率较高的缺点。有研究显示,STA双支分流术可以提供最高达120 ml/min的血流量,理想状态下可以替代成为高流量分流术[7]。本文病例1术后CTA和CTP显示,STA双支提供给了右侧大脑半球足够的血流灌注。而且,从血流动力学分配的角度来看,STA双支分流更符合MCA供血区的生理特点。从技术操作角度来看,STA的分离和吻合也更简单,操作可行性更高。另外,有研究表明,高流量分流术后较高的闭塞率与作为分流血管的游离桡动脉或大隐静脉缺乏滋养血管有关[8]。与之相比,STA为带蒂分流血管,术后闭塞率更低。当然,要让STA分流替代成为高流量分流,必须结合术中的电生理监测和TCD监测情况,而且在STA分离阶段,应尽可能剔除干净血管壁上的富含交感神经纤维成分的筋膜组织,以便血管充分扩张,提供更多的血流[9]。
总之,STA-MCA分流术能延长安全临时阻断的时间,在动脉瘤孤立和载瘤动脉闭塞后提供保护性血流,降低BOT试验通过的情况下仍发生迟发性脑梗塞的概率,有利于提高颅内复杂动脉瘤的治愈率,降低手术并发症的发生率。相比于桡动脉或大隐静脉分流术,STA分流术的技术操作更简单,在理想情况下双支分流甚至可以替代高流量分流,前提条件是需要经过严格的神经电生理和血流动力学评估。

