一例鸭大肠杆菌病的诊治
车晓囡
(聊城市畜牧兽医事业发展中心,山东 聊城 252000)
0 引言
近年来,我国的养鸭业迅速发展,正处于分散零星放养和规模集约化并存阶段。鸭大肠杆菌病因其抗原性复杂,血清型种类繁多,发病的表现形式不同[1],已经成为鸭的主要疾病之一,给我国养鸭业带来巨大的经济损失[2]。它的临床表现及病理特点不一,剖检时病理变化多样。若混有其他病原体感染,情况将更为严重[3]。目前,抗生素的使用能很好遏制其发生,但长期使用会产生耐药性。同时抗生素的滥用和广泛持续使用加剧了畜禽产品中的药物残留,引发食品安全事件。为了合理使用抗生素,建议临床用药不能单凭经验,最好通过药敏试验筛选敏感药物用于治疗,并遵循用药原则,减少耐药性的产生,这样也可以大大降低药物残留对人类健康的危害。
1 病例情况
聊城某养鸭场26日龄肉鸭出现大批死亡,病鸭出现精神萎顿、头颈缩起、食欲减退、不愿走动、呼吸困难、腹部肿大、排灰绿色或灰白色稀粪的临床症状,少数出现关节肿大现象;剖检可见心包膜浑浊增厚,有的与心肌粘连,气囊浑浊增厚,肝脏明显肿大,肝脏外面附着一层奶酪样纤维蛋白膜,易于剥离。针对该病例采用细菌的分离培养和鉴定,以此来确定治疗方案。
2 材料与方法
2.1 材料
2.1.1 病料来源
供试病料来自山东聊城市某养鸭场。
2.1.2 实验动物
健康昆明系小鼠7只,是聊城大学兽医微生物学实验室自繁自养。
2.1.3 培养基和试剂
该微生物实验室常用的各种培养基,自配的兔全血琼脂培养基,各种生化反应管及生化试剂购自杭州天和微生物试剂有限公司。大肠杆菌标准抗“O”单因子血清为中国动物卫生与流行病学中心郭玉广老师惠赠。
2.1.4 药敏纸片
微生物实验室按胡桂学的含药滤纸片的制备方法制备。一共20种药,包括:头孢菌素类有头孢他啶、头孢克肟、头孢噻肟钠、头孢曲松钠;氨基糖苷类有硫酸阿米卡星、硫酸链霉素、单硫卡、安普霉素、庆大霉素;喹诺酮类有乳酸环丙沙星、盐酸环丙沙星、甲磺酸培氟沙星;四环素类有盐酸多西环素;喹恶啉类有乙酰甲喹;酰胺醇类有氟苯尼考;林可胺类有盐酸林可、克林霉素;截断侧耳素类有延胡索酸泰妙菌素;多肽类有粘菌素;增效剂有乳酸TMP。
2.1.5 主要仪器设备
1)中国龙口市先进仪器公司的600型电热恒温培养箱。
2)青岛海尔股份有限公司的BCD-290W型冰箱。
3)龙口市先进仪器公司的六联电子调温万用电炉。
4)上海博迅实业有限公司的自动高压灭菌器。
5)深圳天南海北有限公司的SHA-3型恒温振荡器。
6)苏州净化设备有限公司的SW-CJ-2F型双人双面净化工作台。
7)重庆实验设备厂的CS101-1A型电热鼓风干燥箱。
2.2 试验方法及结果
2.2.1 细菌的分离纯化
在无菌条件下对送检的鸭头进行如下处理:先用酒精浸泡去污杀菌,接着用剪刀将其头顶皮肤剪开并外翻暴露颅骨,拿灭菌剪刀剪开一侧颅骨,再用灭菌后的接种环刺破脑膜取样,在普通平板上划线分离,置于37℃恒温箱培养24 h,观察细菌生长情况[3]。挑取上述平板长出的单个菌落接种到麦康凯培养基、伊红美蓝培养基和全血琼脂培养基中,37℃培养24 h,观察分离菌在各种培养基上的生长特性,结果见表1。

表1 分离菌在各种培养基上的生长特性
2.2.2 生化试验及结果
对分离菌按照胡桂学[3]主编的兽医微生物学实验教程中的方法进行细菌的乳糖发酵实验、吲哚试验、M.R试验、V-P试验、枸橼酸盐利用试验(即IMViC实验)和三糖铁培养基接种,37℃培养24h,观察结果(见表2)。
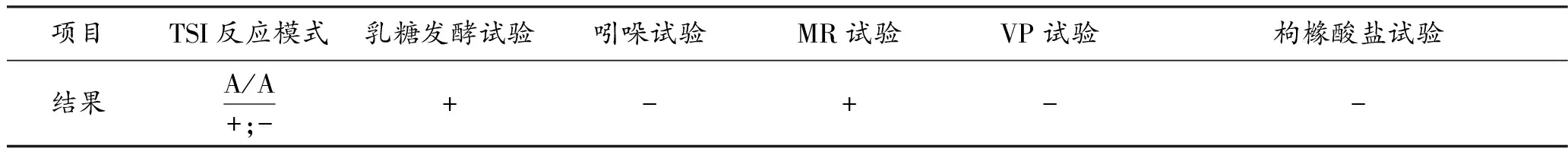
表2 生化试验结果
2.2.3 血清型鉴定
将纯化后的分离菌接种于营养琼脂斜面培养基上,用0.5%石碳酸生理盐水制成浓菌液。然后高压灭菌2 h破坏其“K”抗原,制成检测用抗原。用大肠杆菌标准抗“O”单因子血清进行玻片凝集反应,同时设置检测抗原与0.5%石碳酸生理盐水混合液作为对照,观察有无凝集反应,若2 min内出现明显的凝集则判为阳性。对分离菌进行O抗原鉴定后确定该菌血清型为O92。
2.2.4 动物试验及结果
将分离菌的12 h肉汤培养物稀释至含菌量为108/mL,昆明系小鼠分为实验组和对照组。实验组用细菌原液、稀释菌液,对照组用灭菌肉汤液作为实验组的空白对照,分别向实验组及对照组的昆明系小鼠按1 mL/只的剂量进行腹腔注射。不同攻毒组小鼠进行隔离饲养并连续观察7 d。
结果显示:实验组中注射原液的昆明系小鼠发病率100%、死亡率为100%;注射稀释菌液的小鼠发病率100%,死亡率为66.7 %。其中注射细菌原液的3只小鼠在接种6 h后全都死亡,且未表现出明显的临床症状;而注射稀释菌液的小鼠在10 h后开始出现食欲不振、精神沉郁、步态不稳等症状,在1周的观察期内死亡2只,存活的1只也曾表现明显的病态。对全部小鼠剖检观察:注射原液的小鼠无明显病理变化;注射稀释液菌液的小鼠出现肝淤血、脾肿大(见图1)病理变化。之后分别取实验小鼠肝、心、脾、肺、肾进行细菌分离和生化试验鉴定,取得跟上述试验一致的结果,证实小白鼠体内分离的细菌和从鸭体内分离的细菌是同一种菌。
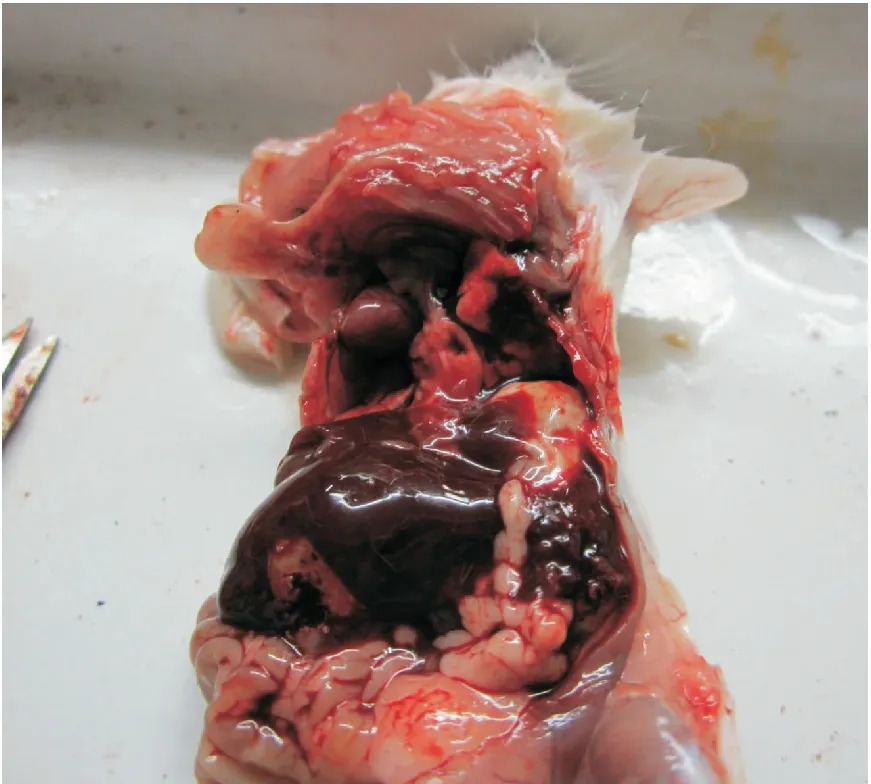
图1 实验小鼠的解剖图
对照组注射灭菌肉汤液的3只昆明系小鼠连续观察1周,没有出现异常表现,剖检后对其内脏划线接种也未分离到细菌,证实实验用的小鼠自身不含该致病菌。
通过实验组、对照组实验小鼠的解剖分析及实验组实验小鼠组织的细菌分离和生化试验鉴定,可以判定是由此大肠杆菌致使实验小鼠发病。结合病鸭的临床表现、病理变化以及上述实验室检测结果,最后确诊为鸭大肠杆菌病。
2.2.5 药敏试验及结果
采用纸片扩散法进行大肠杆菌药物敏感性测定[4]。挑取纯培养的单个菌落,接种于LB肉汤中,在恒温振荡器内培养12 h,制备成细菌悬液并稀释至含菌量为108/mL,取100 μL稀释菌液均匀涂布于普通培养基表面,盖好平皿,待平板表面稍干时,用镊子取出药敏片贴于涂有细菌的培养基表面,37℃温箱培养18 h。观察所有药敏纸片抑菌环的大小。
参照NCCLS公布药敏试验判定标准,得出该大肠杆菌对头孢他啶、盐酸环丙沙星、硫酸阿米卡星、安普霉素、乳酸TMP高度敏感,耐药药物占被测药物总数的65%。
3 临床治疗效果
根据药敏试验结果,可使用头孢他啶、盐酸环丙沙星、硫酸阿米卡星、安普、乳酸TMP等高度敏感药物来控制该病。但单独使用一种药物疗效缓慢,还易产生抗生素耐药现象,为了使治疗效果达到最好,根据药物配伍原则,为该养鸭场推荐了头孢他啶、硫酸阿米卡星和乳酸TMP这三种高敏药物联合使用来治疗该病,用药3 d就控制住了发病鸭群的死亡,连续用药1周基本上控制了疫情,发病鸭明显好转。
4 讨论
4.1 大肠杆菌血清型
大肠杆菌O血清型是对大肠杆菌进行分类的主要依据之一,该例大肠杆菌是从送检的鸭脑中分离到的,血清型为O92,将分离菌接种到全血琼脂培养基上呈现明显的β溶血,可初步推测该大肠杆菌具有致病性,从动物安全试验结果中可知,此大肠杆菌不仅对鸭具有致病性,对小鼠也有很强的致病力。
4.2 动物试验攻毒剂量
在进行动物试验时,在一定时间内,注射不同菌液量会对实验动物产生不同的致病作用。采用培养12 h肉汤液和含菌量为108/mL的稀释菌液进行实验,用稀释菌液进行攻毒试验可以观察到实验小鼠表现出精神沉郁、步态不稳等明显的临床症状,剖检后也能看到明显的病理变化,而注射细菌原液的临床症状表现不明显,死亡时间短,并且解剖后观察不到明显的病理变化。因此,在进行动物试验时要注意选用适当的攻毒剂量,以求试验结果更精确。
4.3 注意事项
在制作培养基时,要严格按照规章制度操作,尤其注意掌握好高压灭菌时的温度和时间。在制备全血琼脂培养基时严格无菌操作,并在使用前要任取一平板放在恒温培养箱中培养24 h,在无菌生长的情况下才可使用。在整个试验过程中,要严格无菌操作,对所用各种试剂、培养基、实验动物和病料等均做好明确标记,并保存好分离到的菌种,另外对不用的培养基经高压灭菌后才可清洗。
药敏试验时,在培养基上涂布菌液一定要均匀,待平板表面稍干时,用镊子取出药敏片贴于涂有细菌的培养基表面,贴纸片时要轻轻按压,以保证与培养基密切接触,最后置于最适温度下培养。在进行动物安全试验时要设置对照组,除注射的菌液不同外,其他条件都要保持一致,并且要随时观察小鼠的变化。一般疾病的潜伏期为7 d,可以持续观察7 d,通过动物安全试验结果推测此菌的致病力。
5 防治措施
控制大肠杆菌病重在预防,主要从加强饲养管理着手。首先要做好环境卫生和消毒工作。引进鸭前提前对饲养场舍、饮食器械等进行彻底的清扫、冲刷和消毒,平时做好通风换气和定期消毒工作,在经常走动和出入的道路和门口设消毒池,供给营养全面的饲料,做到科学管理,规范饲养,及时淘汰病鸭、弱鸭,不断改善饲养条件。当出现集体发病症状时,及时救治。
在防治大肠杆菌病时,正确使用抗生素对改善我国养鸭业至关重要。通过做药敏实验筛选高敏药物是行之有效的方法之一,在此基础上遵照药物的配伍原则,选择适当的药物联合使用,将会取得更好的疗效。该养殖场病例就联合使用了头孢他啶、硫酸阿米卡星和乳酸TMP三种药物,不仅提高了药物疗效,达到了良好的治疗效果,还降低了药物的用量,减少了用药后的不良反应和毒副作用,另外也延缓了该大肠杆菌对这些药物产生的耐药性。
6 结语
该病例通过生化鉴定、血清型检测、动物安全试验,确定此分离菌为大肠杆菌,诊断为大肠杆菌性疾病。通过药敏试验筛选高敏药物,并在药物配伍原则指导下选用药物进行临床治疗,取得理想的治疗效果。养鸭户在日常养殖过程中,应注意采用科学的预防措施,才能避免该病带来的损失。

