基于PRRSV ORF5基因TaqMan qPCR检测方法的建立及遗传变异分析
张 帅,赵云环,刘 莹,翟 刚,郭 禹,刘 涛,左玉柱,2*,范京惠,2* (.河北农业大学 动物医学院,河北 保定 0700;2.河北省兽医生物技术创新中心,河北 保定 0700)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种烈性传染病,临床上多表现为不同年龄段猪只的发热、出血、呼吸道症状以及母猪流产、死胎、产弱胎等为特征的繁殖障碍,该病可产生免疫抑制继发其他细菌和病毒感染[1]。PRRSV是一种易于发生变异和重组的单股正链RNA病毒,呈二十面体结构,其基因组全长约为15 kb,至少包含10个开放阅读框(ORF)。其中GP5蛋白是病毒的囊膜糖蛋白,也是病毒最易变异的结构蛋白之一[2],由ORF5基因编码,在病毒复制、感染机体、诱导机体产生抗体中发挥重要作用[3]。ORF5基因能反映PRRSV的遗传变异情况,也是PRRSV基因组分型的主要依据。近年来,高致病性毒株(HP-PRRSV)、NADC30-like PRRSV以及重组毒株的出现,使得PRRSV流行毒株呈现多样性和复杂性,使之防控的难度也大大增加,严重影响了中国养猪业的发展[4]。中央一号文件多次强调,要加快构建现代养殖体系,保护生猪基础产能,健全生猪产业平稳有序发展长效机制,由此可见国家对我国生猪养殖业的重视程度。目前已有多个检测方法:纪爱英等[5]建立了普通PCR检测方法,张杰等[6]建立了SYBR GreenⅠqPCR检测方法,但均存在灵敏度低、耗时长等问题。由于PRRSV分型较多、容易变异、发病率高、防制尚无特效药和高效疫苗[7],且直接对疑似样品ORF5基因进行普通PCR扩增操作复杂,因此,在PRRS的防控方面,建立一种操作简单、特异性强、灵敏度高、耗时短的通用型TaqMan qPCR检测方法,优先对猪场进行PRRSV的快速全面筛查,再对阳性样品进行ORF5基因扩增分析,可以实现对猪场不同流行毒株的全面筛查和满足猪场不同检测目的的需求,在病原诊断和分析方面具有更广阔的应用前景。
综上,本研究根据PRRSV经典、高致病性和NADC30代表毒株的ORF5基因保守序列设计1对荧光引物和探针,建立了一种特异性强、灵敏度高、操作简单的通用型TaqMan qPCR检测方法,并对检测为阳性的样品进行ORF5基因扩增,不仅可以实现对不同毒株的检测和病毒拷贝数准确定量,还可以为猪场日常检测和基因遗传变异分析提供依据。
1 材料与方法
1.1 病毒及样品PRRSV、猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2)、猪流行性腹泻病毒(PEDV)、猪瘟病毒(CSFV)、猪传染性胃肠炎病毒(TGEV)、猪轮状病毒(RV)均由河北农业大学动物医学院传染病实验室保存。34份临床疑似样品采集自出现发热、咳喘、流产和死亡的规模化养猪场中发病猪的血液和脾脏、肺脏、淋巴结等组织脏器。
1.2 主要试剂DH5α感受态细胞由本实验室制备;反转录试剂盒(生产批号:21FB0705)购自北京聚合美生物科技有限公司;DNA纯化试剂盒(生产批号:351102201008)、质粒小提试剂盒(生产批号:121102191017)购自杭州倍沃医学科技有限公司;Fast TaqMan Mixture(生产批号:21FB1035)购自北京康为世纪生物科技有限公司;pMD19-T载体(生产批号:AL12052A)、DL2000 DNA Marker(生产批号:21DB0215)购自宝生物工程(大连)有限公司。
1.3 引物设计与合成根据NCBI GenBank中PRRSV经典毒株CH-1a(登录号:AY032626)、高致病性毒株JXA1(登录号:EF112445)和NADC30毒株(登录号:JN654459)的ORF5基因保守序列,应用Primer Premier 6.0软件设计通用型特异性荧光引物PRRSV-F/R与探针PRRSV-P和ORF5全基因扩增引物ORF5-F/R(表1),由生工生物工程(上海)股份有限公司合成。
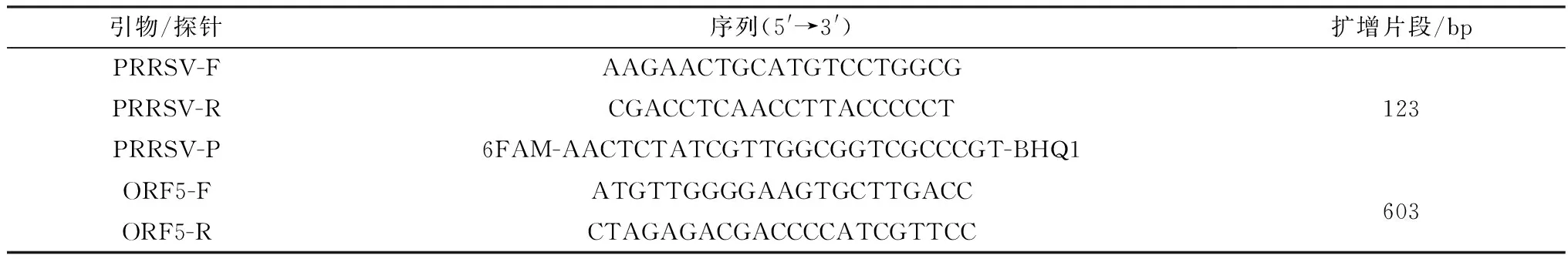
表1 qPCR探针及引物
1.4 qPCR标准品的制备提取PRRSV阳性样品中的RNA并反转录成cDNA,用引物PRRSV-F/R进行普通PCR扩增,PCR产物纯化回收后连接至pMD19-T载体上并转化到DH5α感受态细胞中,构建重组质粒pMD19T-PRRSV,PCR鉴定为阳性后由生工生物工程(上海)股份有限公司测序,作为qPCR标准品,通过Nanodrop 2000测定质粒浓度,换算为质粒拷贝数[8]。
1.5 qPCR反应条件的优化和标准曲线的建立通过设置不同变量(质粒浓度、退火温度)对反应条件进行优化;将标准品10倍倍比稀释后,选取7个浓度(2.19×108~2.19×102拷贝/μL)作为模板,在最优反应条件下进行TaqMan qPCR扩增,并设立阴、阳性对照,以标准品浓度的对数为横坐标,Ct值为纵坐标建立标准曲线[9]。对扩增结果利用LightCycler 96软件分析后建立标准曲线。
1.6 特异性试验用DNA/RNA提取试剂盒提取PRV、PCV2阳性样品的DNA;PRRSV(高致病性毒株、经典毒株、NADC30类毒株 )、PEDV、CSFV、TGEV、RV阳性样品的RNA反转录成cDNA作为模板,在最优反应条件下进行qPCR扩增,验证该方法的特异性[10]。
1.7 敏感性试验将倍比稀释好的重组质粒pMD19T-PRRSV作为模板在最优反应条件下进行TaqMan qPCR扩增,同时用普通PCR方法扩增,对2种检测方法得到的结果进行对比来验证本方法的敏感性。
中国特色社会主义道路,展开来说,是由一系列具体道路共同构成的道路体系。从目前党的文献来看,涉及的具体道路主要包括:中国特色社会主义政治发展道路;中国特色社会主义文化发展道路;中国特色社会主义新型工业化、信息化、城镇化、农业现代化道路;中国特色社会主义自主创新道路;中国特色反腐倡廉道路;和平发展道路;等等。这些具体道路,进一步丰富了党对中国特色社会主义道路的认识。
1.8 重复性试验组内重复试验:将倍比稀释好的重组质粒pMD19T-PRRSV(2.19×108,2.19×105,2.19×102拷贝/μL)作为模板在最优反应条件下进行qPCR扩增,每个浓度设立3个重复,根据每个浓度的Ct值计算组内变异系数(CV)。
组间重复试验:将倍比稀释好的重组质粒pMD19T-PRRSV(2.19×108,2.19×105,2.19×102拷贝/μL)作为模板在最优反应条件下进行3次qPCR扩增,根据每个浓度的Ct值计算组间变异系数(CV)[11]。
1.9 临床样品的检测对采集的34份疑似样品提取RNA反转录成cDNA作为模板,用本研究建立的TaqMan qPCR检测方法进行检测,同时用本实验室建立的普通PCR方法进行样品检测,比较2种方法检测结果。
1.10 ORF5全基因的扩增对检出的PRRSV阳性样品用ORF5-F/R进行普通PCR扩增,PCR产物纯化回收后由生工生物工程(上海)股份有限公司测序。
1.11 ORF5基因进化树的构建和氨基酸序列分析从NCBI GenBank上选取具代表性的毒株39条,用MEGA 7.0软件进行遗传进化树构建,用DNAStar 7.0软件进行氨基酸序列同源性的比较和分析[12]。
2 结果
2.1 PRRSV重组质粒pMD19T-PRRSV标准品的鉴定将构建的重组质粒pMD19T-PRRSV作为模板,用合成的PRRSV-F/R进行普通PCR扩增,得到目的条带大小为123 bp(图1),胶回收送生工生物工程(上海)股份有限公司测序,结果均与预期相符,表明正确构建了重组质粒pMD19T-PRRSV标准品。经测重组质粒pMD19T-PRRSV浓度,换算成拷贝数为2.19×1010拷贝/μL。

M.DL2000 DNA Marker;1.阴性对照;2.重组质粒pMD19T-PRRSV图1 重组质粒pMD19T-PRRSV的PCR鉴定
2.2 qPCR反应条件的优化结果及标准曲线的建立经优化后确定了最佳反应体系和反应条件,TaqMan qPCR反应体系为15.0 μL:2×Fast Probe Mixture 7.5 μL;PRRSV-F/PRRSV-R/PRRSV-P(10 μmol/L)各0.3 μL;RNase-Free ddH2O 5.1 μL;模板1.5 μL。最佳反应条件:95℃预变性1 min;95℃变性10 s,56℃退火20 s,72℃延伸10 s,反应40个循环,每个循环结束收集荧光信号。
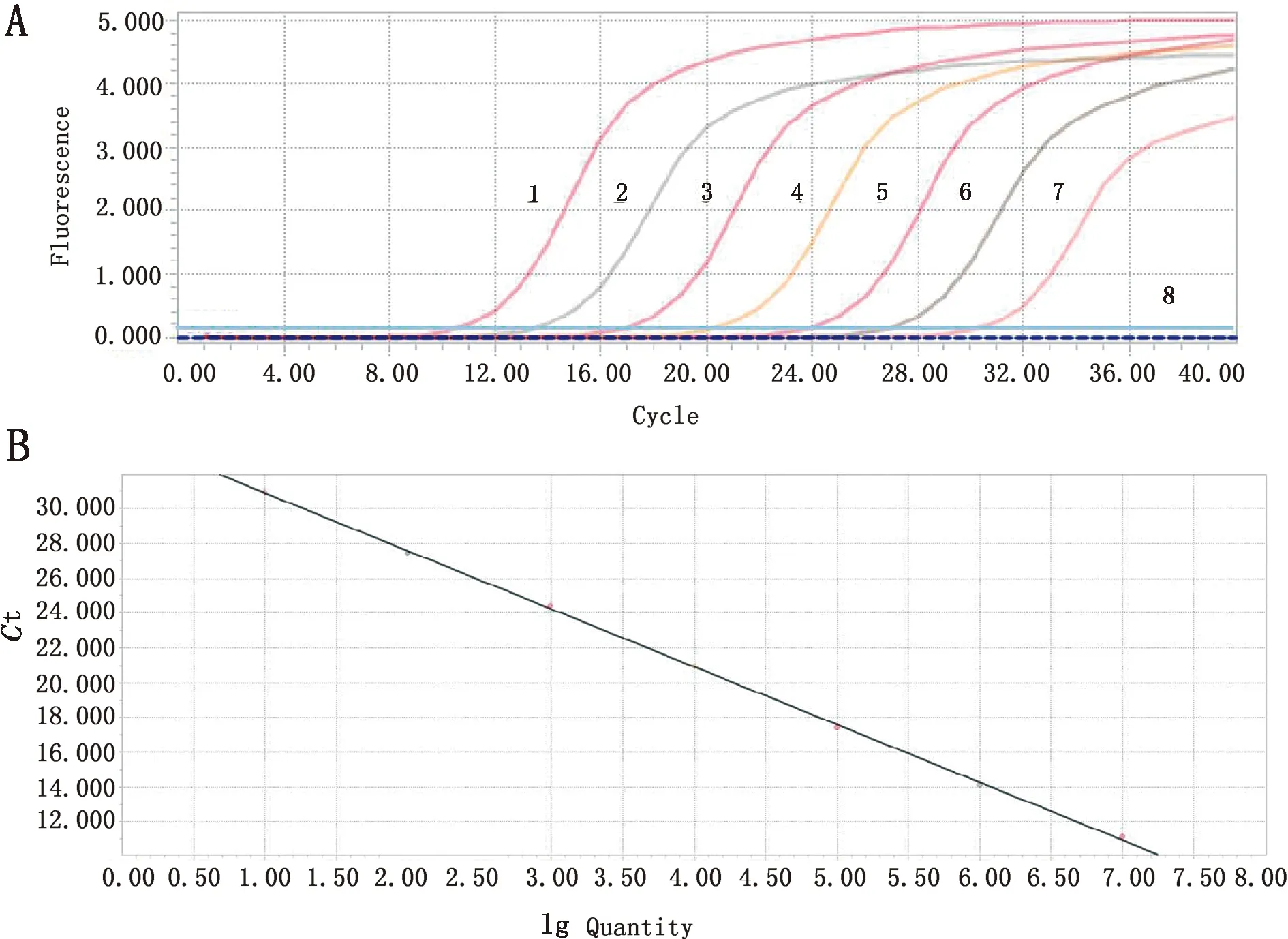
1~7.不同稀释度的重组质粒pMD19T-PRRSV(2.19×108~2.19×102 拷贝/μL);8.阴性对照图2 不同稀释梯度标准品扩增曲线(A)、qPCR标准曲线(B)
2.3 特异性试验结果用1.6中提取的核酸作为模板,设立阴性对照,用本研究建立的TaqMan qPCR在最优反应条件下检测,结果(图3)显示,只有PRRSV检测为阳性,其他核酸和阴性对照均为阴性;表明本研究建立的方法具有较高的特异性。

1.HP-PRRSV;2.CLASSIC-PRRSV;3.NADC30 PRRSV;4~9.PRV、PCV2、PEDV、CSFV、TGEV、RV;10.阴性对照图3 qPCR的特异性试验
2.4 敏感性试验结果将重组质粒pMD19T-PRR-SV 10倍倍比稀释后作为模板,进行TaqMan qPCR和普通PCR方法扩增检验其敏感性。结果显示,TaqMan qPCR检测重组质粒pMD19T-PRRSV最低检测下限为2.19×101拷贝/μL(图4A),普通PCR方法检测重组质粒pMD19T-PRRSV最低检测下限为2.19×103拷贝/μL(图4B);表明本研究建立的TaqMan qPCR检测方法具有较高的敏感性。

A.qPCR的敏感性试验(1~8.不同稀释度的pMD19T-PRRSV;9.阴性对照);B.普通PCR的敏感性试验(M.DL2000 DNA Marker;a.阴性对照;b~i.不同稀释度的pMD19T-PRRSV)图4 qPCR的敏感性试验和普通PCR的敏感性试验
2.5 重复性试验结果将倍比稀释好的重组质粒pMD19T-PRRSV(2.19×108,2.19×105,2.19×102拷贝/μL)作为模板在最优反应条件下用本研究建立的TaqMan qPCR进行组内和组间重复性试验,并与本实验室建立的普通PCR检测方法进行比较,结果(表2)显示:组内和组间的变异系数均小于1%,也均低于本实验室建立的普通PCR检测方法的组内和组间的变异系数,表明该方法具有良好的重复性。

表2 TaqMan qPCR的重复性试验结果
2.6 临床样品检测结果用本研究建立的TaqMan qPCR对来自河北省不同地区的34份疑似PRRS样品进行检测,结果显示阳性率为14.3%(5/34),普通PCR检测阳性率为8.9%(3/34),TaqMan qPCR方法比普通PCR方法多检测出2份阳性,经胶回收测序鉴定均为PRRSV毒株,表明TaqMan qPCR检测方法优于普通PCR检测方法,可应用于临床检测。
2.7 ORF5全基因扩增结果对检出的阳性样品利用ORF5-F/R进行扩增,结果显示5份阳性,得到目的条带大小为603 bp(图5),对PCR产物纯化回收后由生工生物工程(上海)股份有限公司测序。
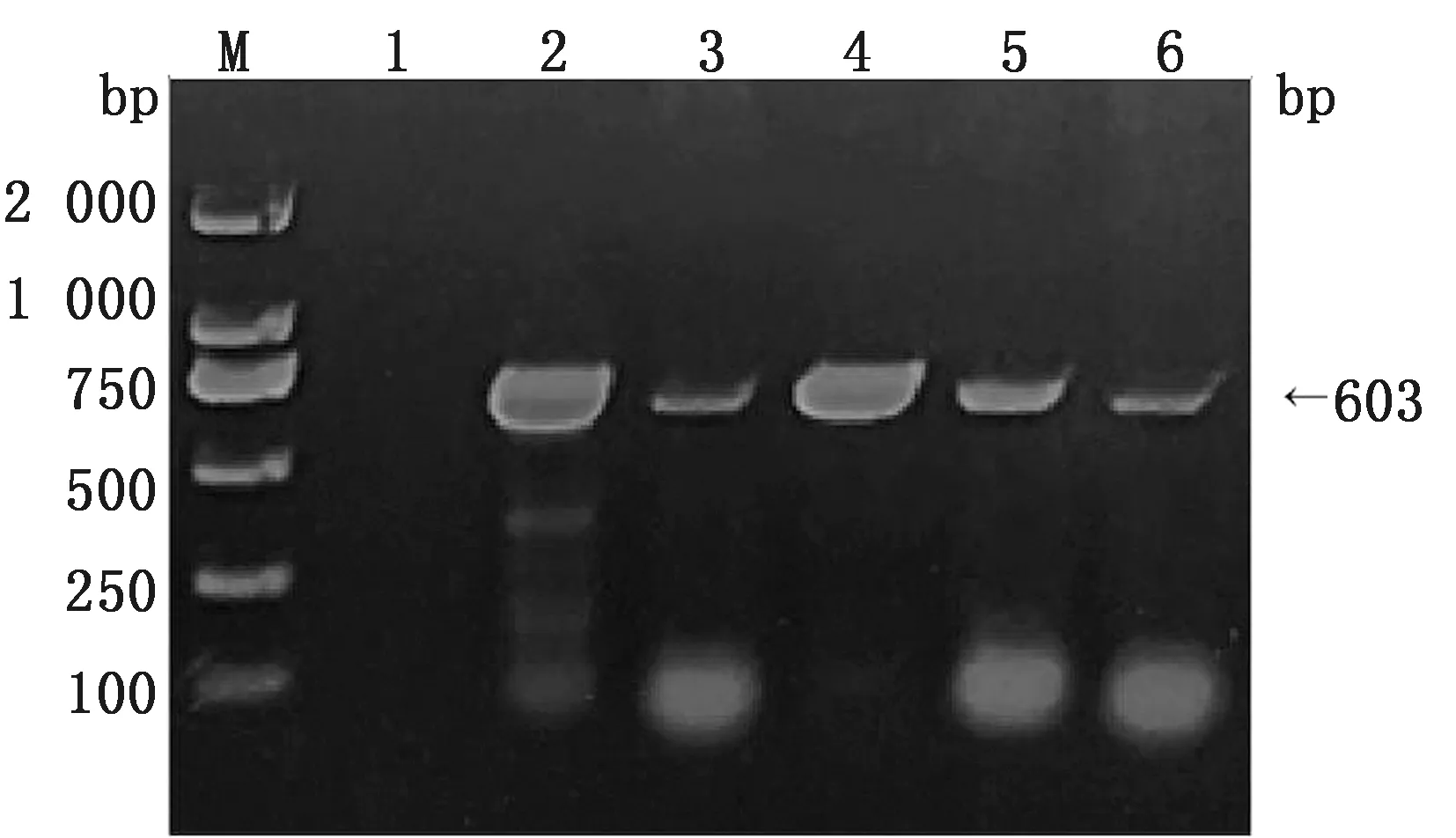
M.DL2000 DNA Marker;1.阴性对照;2~6.CH/HB/BD01、CH/HB/BD02、CH/HB/BD03、CH/HB/BD04、CH/HB/CZ01图5 阳性样品ORF5基因扩增结果
2.8 PRRSV ORF5基因遗传进化分析为了解本研究得到的5株PRRSV的遗传特性,利用MEGA 7.0软件对测序获得的ORF5基因核苷酸序列与国内外上传到NCBI上的参考ORF5基因序列构建分子遗传进化树,结果(图6)显示:整个进化树分为2支,1支为以VR-2332为代表的美洲型分支,另1支为以Lelystad为代表的欧洲型分支。美洲型又分为4个谱系,分别为以CH-1a、JXA1、HUN4为代表的谱系8;以VR-2332、BJ-4为代表的谱系5;以GM2、QYYZ为代表的谱系3;以NADC30为代表的谱系1[13]。本研究获得的5株ORF5基因序列分布于3个谱系,其中3株CH/HB/BD01、CH/HB/BD02、CH/HB/BD03属于谱系8(HP-PRRSV类);1株CH/HB/BD04属于谱系5(VR-2332类);1株CH/HB/CZ01属于谱系1(NADC30类)。
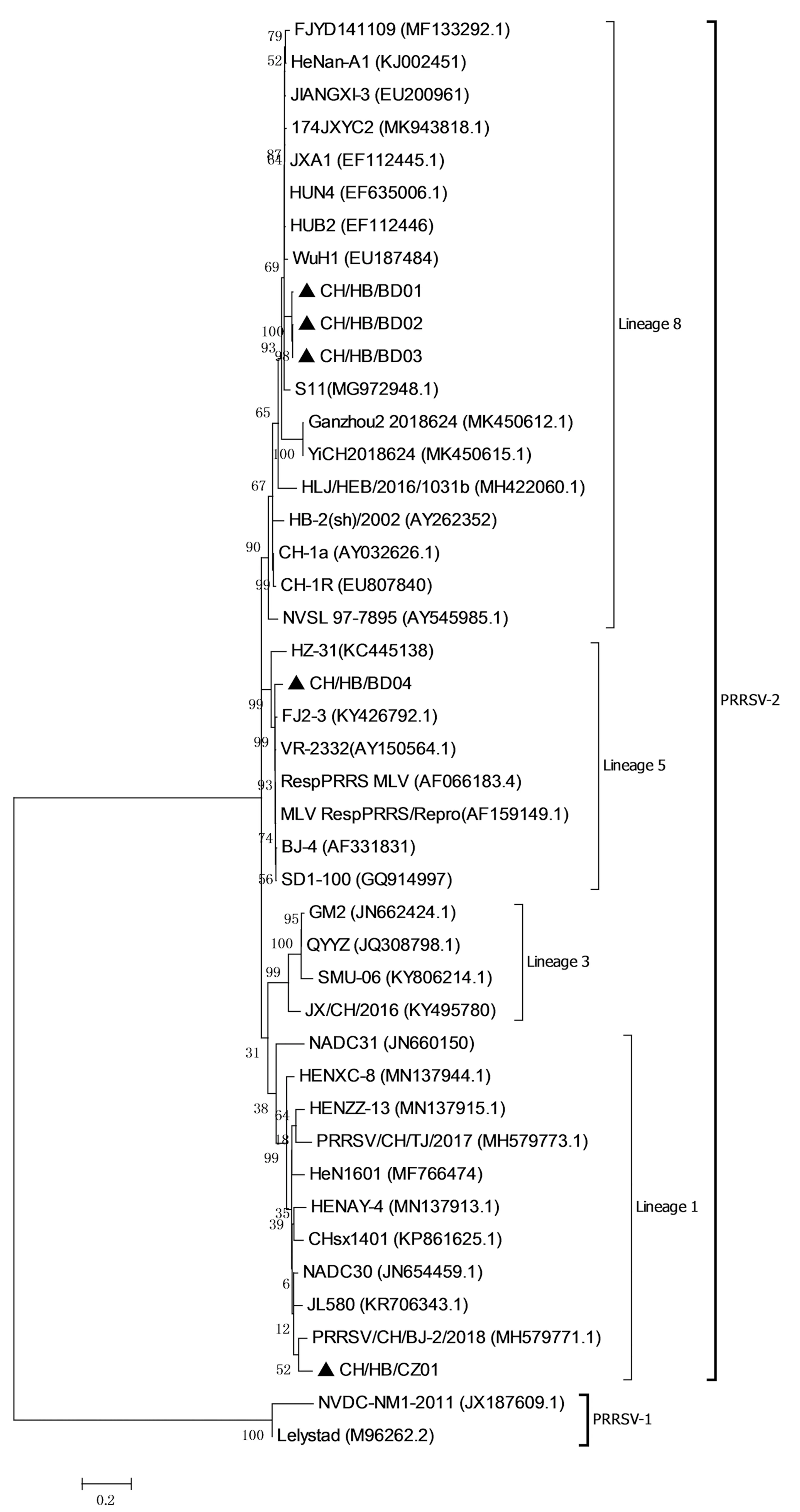
▲表示本研究毒株图6 PRRSV阳性样品ORF5基因的进化树分析
利用MegAlign软件进行核苷酸和氨基酸序列同源性的比较和分析,结果显示:5株阳性样品ORF5基因之间相比核苷酸序列同源性在82.9%~99.8%之间,氨基酸序列同源性在82.1%~99.0%之间;与CH-1a等经典毒株相比氨基酸同源性在84.6%~91.0%之间;与JXA1、HuN4、HUB2等高致病性毒株相比氨基酸同源性在84.6%~96.0%之间;与NADC30毒株相比氨基酸同源性在84.1%~94.5%之间;其中,CH/HB/BD01、CH/HB/BD02、CH/HB/BD03与JXA1和HuN4同源性最高,高达96.0%;CH/HB/BD04与VR-2332同源性最高,高达96.1%;CH/HB/CZ01与NADC30同源性最高,高达94.5%[14]。
2.9 PRRSV GP5蛋白氨基酸分析利用MegAli-gn 软件进行氨基酸序列比较和分析,结果(图7)显示:ORF5基因编码200个氨基酸,没有氨基酸的插入与缺失,突变主要集中于信号肽区(1~31 aa)和高变区(HVR),在60~90、129~150 aa相对保守。在谱系8中,信号肽区(1~31 aa)存在4个氨基酸突变,高变区(HVR2)存在2个氨基酸突变,B细胞表位(37~45 aa)的第39位突变为异亮氨酸;在谱系5中,信号肽区(1~31 aa)存在5个氨基酸突变,高变区(HVR1、HVR2)存在2个氨基酸突变,抗原表位a(27~30 aa)存在1个氨基酸突变,其他抗原表位出现3个氨基酸突变;在谱系1中,信号肽区(1~31 aa)存在2个氨基酸突变,高变区(HVR2)存在3个氨基酸突变,3个抗原表位存在5个氨基酸突变,可见,谱系8中的3株变异程度最高,特别是在信号肽区和2个高变区,导致病毒免疫逃逸从而发病[15]。

图7 ORF5基因推导氨基酸序列分析
3 讨论
PRRSV至今仍是全球养猪生产中最重要的病原体之一,给养猪业造成了巨大的经济损失。PRRSV的遗传多样性和复杂性进一步增加,其在本质上是高度动态化的:一方面,由于PRRSV在不断快速进化,产生新的变异,扩大其多样性,导致新发毒株和多株PRRSV在田间的流行迅速增加。此外,在全球范围内,除HP-PRRSV外,已有多项研究报道出现了新的2型PRRSV毒株成为主要毒株,如美国的PRRSV MN184和NADC30毒株、中国的NADC30类毒株,多个PRRSV毒株在养殖场的循环增加可能会降低疫苗的效力;另一方面,现代食品生产系统是超级传播者,将病毒分布在全国甚至全世界,导致PRRS在全球范围内的流行,因此,应加强对PRRSV各个流行毒株的预防和控制[16]。本研究建立了一种特异性强、灵敏度高、耗时短的通用型TaqMan qPCR检测方法,可实现对猪场不同流行毒株的全面筛查,并对筛查出的阳性样品PRRSV ORF5基因进行了遗传进化分析,以进一步掌握猪场毒株流行情况和当前地区遗传变异规律,为PRRSV的科学防控提供参考。
当前,用于PRRSV的检测方法主要有普通PCR(RT-PCR)、环介导等温核酸扩增(LAMP)、酶联免疫吸附试验(ELISA)、核酸探针杂交法(NHA)等,但常规PCR耗时长、特异性相对较低、早期诊断容易漏检[17];LAMP因其对环境要求严格,假阳性率较高[18];ELISA相较于TaqMan qPCR则具有灵敏度较低、耗时长、成本高等缺点[19];而NHA要求更高的技术含量,仅局限于实验室检测无法用于大面积临床诊断和现场应用[20]。TaqMan qPCR的检测结果更佳。TaqMan qPCR具有耗时短、操作简易、灵敏性高、特异性强等优点,对样品检测的同时还可以对其定量分析,因此可广泛应用于国内外的临床检测。
GP5是最易变异的糖基化结构蛋白,其功能域包括N端信号肽、外膜区、跨膜区和内域[21]。在本研究中,GP5蛋白的共同遗传特征是核苷酸相似度较低,核苷酸取代度较高,中和表位A覆盖第27~30位氨基酸,部分序列第27位由V突变为A,这可能导致了中和表位A的改变,有研究表明,该区域的突变有助于机体对病毒诱导的免疫应答产生抗性[22];中和表位B在诱导病毒中和抗体中起关键作用,该序列在不同基团间具有较少的氨基酸取代,其中CH/HB/BD01、CH/HB/BD02、CH/HB/BD03在第38位由L突变为I[2]。在这些病毒的GP5蛋白中,2个表位内的氨基酸,特别是中和表位A,已经偏移,可能导致引起的免疫应答不能完全保护猪[23]。此外,高变区发生了大量的突变,可能导致GP5蛋白免疫原性丧失或改变,致使疫苗免疫效果减低或无效;2个T细胞表位存在不同数量的氨基酸的替换和取代,可能与疫苗诱导的保护性免疫耐受有关,导致PRRSV控制无效[24]。本研究得到的5株PRRSV毒株分属于3个不同的谱系,其中3株CH/HB/BD01、CH/HB/BD02、CH/HB/BD03与CH-1a、JXA1、HUN4同支,属于谱系8;CH/HB/BD04与VR-2332同源性最高,同属于谱系5;CH/HB/CZ01为NADC30类毒株,同属于谱系1。由此可见,河北部分地区毒株流行的复杂性,不仅有高致病性毒株,还有NADC30类毒株以及变异毒株的出现,可能是复杂的饲养环境,频繁的生猪运输和不当的引种等原因造成的,使毒株变异频发,给PRRS的防控带来了极大的挑战[25],提示持续监测PRRSV流行毒株的变异动态的必要性。
PRRS作为危害养猪业的重要疫病之一,毒株多样化导致患病猪临床表现多变和疫苗保护效力不佳,都给猪场的防控造成极大的困难[26],本研究建立的通用型TaqMan qPCR检测方法可以快速、高效、准确地对猪场进行PRRSV的临床诊断和监测,也可为引种等提供支持;同时结合全面筛查后的阳性样品ORF5基因遗传进化分析对河北部分地区当前的流行现状情况和遗传变异规律提供了补充,也为一种安全、高效、对不同PRRSV谱系具有广谱保护的疫苗的开发提供新的帮助和支持。可见,通用型TaqMan qPCR检测方法和遗传进化分析的结合,为猪场PRRS的全面防控和引种、免疫等计划的实施提供了借鉴。
——一道江苏高考题的奥秘解读和拓展

