茶多酚/壳聚糖复合保鲜剂对红提葡萄保鲜效果的研究
晏 晶,赵 君,周进康,马小云,管全玉
(贵州师范学院化学与材料学院,贵州 贵阳 550018)
红提葡萄也叫红地球,是一种国内外推崇的鲜食葡萄优良品种[1]。红提葡萄果皮中厚,果实呈深红色,果肉硬脆,风味独特,含有多种果酸和矿物质,可补气强筋,是人们非常喜欢的水果之一。葡萄属于季节性较强的水果,长期贮存较为困难,在贮藏过程中容易发生腐烂、干梗、失水皱缩现象, 经济损耗较大[2]。目前,葡萄的贮藏保鲜方法很多,物理贮藏技术有低温保鲜、辐照保鲜和热处理保鲜等;化学保鲜技术有化学保鲜剂、涂膜保鲜等;生物保鲜技术有微生物保鲜、天然提取物保鲜等[3]。目前,人们追求经济、绿色、环保的保鲜方法,天然提取物保鲜剂引起极大的关注。用作天然保鲜剂的材料主要有: 壳聚糖、壳寡糖、茶多酚、乳酸链球菌素、溶菌酶、天然香辛料提取物等。
茶多酚(Tea PoLyphenoLs,TP) 是天然多酚类物质,呈弱酸性,约占茶叶干基含量的15%~30%,是决定茶叶香气和味道的关键物质[4]。茶多酚具有较强的抗氧化作用,其还原性甚至可达L-异坏血酸的100倍,还可抑制病菌[5-6]。茶多酚可与多糖、蛋白进行相互作用,使其抗氧化性能增强[7],其结合有共价键和非共价键两种形式。非共价结合为物理结合,不伴随化学反应,以氢键、离子键、范德华力及疏水作用为主要结合方式;共价结合有酶促氧化和自由基诱导两种形式,酶促氧化是多酚在漆酶或酪氨酸酶作用下被氧化成相应的邻醒或半醒,自由基诱导是利用活性氧或轻自由基促使多酚氧化形成邻苯半醌类物质[8]。
壳聚糖(Chitosan,CS)化学名称为聚葡萄糖胺(1-4)-2-氨基-B-D葡萄糖,是一种天然高分子多糖,具有生物官能性和相容性、安全性、微生物降解性等优良性能,在医药、食品、化妆品、化工等诸多领域有广泛研究与应用[9-13]。
将茶多酚与壳聚糖进行有机复合[14],可能获得成膜性能优良的保鲜剂。因此本实验以茶多酚为抗氧化性原料,壳聚糖为增强剂,淀粉为成膜剂进行复配,建立非共价结合,制备出茶多酚/壳聚糖复合保鲜剂。通过紫外可见光谱、抗氧化性测定,考察了茶多酚/壳聚糖复合保鲜剂对红提葡萄的保鲜效果,优化了茶多酚、壳聚糖用量,拓展茶多酚的研究与应用。
1 材料与方法
1.1 材料与试剂
茶多酚,含量99%,山东省西亚化学工业有限公司生产;壳聚糖,含量≥95%,浙江银象生物工程有限公司生产;1,1-二苯基-2-苦基肼( DPPH),上海源叶生物科技有限公司生产;三羟甲基氨基甲烷(Tris),苏州亚科科技股份有限公司生产;甘油、甲醇、无水氯化钙,分析纯,天津市凯通化学试剂有限公司生产;淀粉、冰乙酸,国产分析纯试剂。
1.2 仪器与设备
UV-2450 型紫外可见分光光度计,日本岛津仪器有限公司生产;RCD-1A型实验室高速均质乳化机,常州市亿能实验仪器厂生产;HY-3 型多功能振荡器, 金坛岸头瑞实验仪器厂生产;pHS-3C型pH计,上海雷磁仪器有限公司生产;WZS-1型折光率仪,上海光学仪器厂生产;DZF型真空干燥箱,北京科伟永兴仪器有限公司生产。
1.3 实验方法
1.3.1 茶多酚-壳聚糖复合保鲜剂的制备
称取1 g淀粉、2.4 g甘油加入盛有200 mL去离子水的三口瓶中加热搅拌糊化1h,糊化完成后,将水浴锅温度降至 70 ℃,分别加入含有0.6 g壳聚糖的醋酸溶液和溶质质量分数为 0.0%、1.0%、1.2%、1.4%、1.6% TP,继续搅拌 30 min,保温静置 30 min,制备出茶多酚/壳聚糖复合保鲜剂。复合保鲜剂自然冷却后测定其抗氧化性,筛选茶多酚最佳用量,样品依次记作CS1.5、CS-TP1.0、CS-TP1.2、CS-TP1.4、CS-TP1.4和CS-TP1.6,不加CS,同法制备TP1.4作比较。
1.3.2 复合保鲜剂抗氧性能测定
DPPH自由基清除率测定:按文献[15]方法进行,分别取不同上述保鲜剂样品4 mL于容量瓶中,然后加入0.04 mg/mL DPPH的乙醇溶液4mL(现配),摇匀后室温避光静置30 min,用无水乙醇作参比,在517 nm的波长下测定其吸光度,平行测定吸光度3 次即可。计算公式:
(1)
式中A空白为4 mL蒸馏水+8 mL DPPH自由基溶液的吸光度;A样品为4 mL样品+8 mL DPPH自由基溶液的吸光度;A对照为4 mL样品+8 mL无水乙醇溶液的吸光度。
OH-自由基清除率测定:按文献[16]方法测定,取不同质量浓度的样品溶液1 mL,加入0.05 mol/L Tris-HCl缓冲液(pH= 8.2) 4.5 mL,在25 ℃水浴10 min后,加入3 mmol/L邻苯三酚溶液0.2 mL混匀,在25 ℃水浴5 min,最后加入 8 mmol/L HCl溶液终止反应,在299 nm波长处测定其吸光度,以蒸馏水调零,平行测定吸光度3 次。
OH-清除率(%)=[A0-(A1-A2)]/A0×100%
(2)
式中A0为 1 mL硫酸亚铁溶液+1 mL水杨酸+12 mL蒸馏水+1 mL过氧化氢溶液的吸光度;A1为 1mL硫酸亚铁溶液+1 mL水杨酸+适量样品+适量蒸馏水+1 mL过氧化氢溶液的吸光度;A2为 1mL硫酸亚铁溶液+1mL水杨酸+适量样品+适量蒸馏水的吸光度,反应溶液的总体积为15 mL。
1.3.3 红提葡萄保鲜实验设计
将经不同浓度茶多酚/壳聚糖复合保鲜剂浸涂处理的红提葡萄放在保鲜液浸泡0.5 min,分别称取500 g于12个小塑料篮子中,并设定其为测试组,未经涂膜处理红提葡萄为对照组。分别测定失量率、腐烂率、可溶性固形物、还原糖、有机酸(pH)以及维生素C(Vc)含量,常温避光贮藏处理18 d,每隔3 d 测定一次。
1.3.4 贮藏期间红提葡萄指标测定
失重率:采用称重法测定,按公式(3)计算其失重率。
失重率(%)=(M1-M2) /M1×100%
(3)
式中:M1为红提葡萄初始质量(g);M2为贮藏时间后的质量(g)。
腐烂率:采用计数法的测定,其腐烂率公式如下:
腐烂率(%)=A1/A2×100%
(4)
式中:A1为贮藏一定时间后腐烂的红提葡萄数;A2为试验的红提葡萄总数。
可溶性固形物含量测定:本实验采用折射仪法。根据每种溶液的折光率值与浓度之间呈比例的关系,用蒸馏水对折光率仪调零后,取红提葡萄果汁滴至折光率仪上,测定红提葡萄的可溶性固形物含量变化。
还原糖测定:采用蒽酮比色法。将红提葡萄去皮除籽,称取10 g果肉用研钵磨碎后,加入适量蒸馏水,过滤,将滤液转移至50 mL容量瓶,蒸馏水定容,量取0.1 mL所得溶液稀释至100 mL得样品液;称取质量比为0.2∶1的蒽酮和硫脲置于烧杯中,搅拌后缓慢加入100 mL浓硫酸,配制成黄色透明的蒽酮溶液,贮存于棕色瓶中备用;配置1 g/L葡萄糖溶液,将其稀释为10、20、40、60、80、100 mg/L的标准葡萄糖溶液;取样品液、系列标准葡萄糖溶液和蒸馏水各2 mL分别置于试管中,加入10 mL蒽酮溶液,混匀后盖上玻璃盖,于沸水浴中加热10 min后,取出在流水中冷却20 min,试剂空白为参比,在620 nm处测得葡萄糖标准溶液的吸光度值。作浓度-吸光度标准曲线方程为:y=0.0209x+ 0.00005,R2=0.9996,糖度由公式(5)换算:
还原糖含量(%)=x×100×10-3×50/0.2×100%
(5)
维生素C含量测定:称取0.5000 g抗坏血酸溶于质量分数为2%的草酸溶液中,并稀释定容至100 mL,4℃避光保存,用时再稀释配制成5.000 mg/mL的维生素C标准储备液;配制28.25 mg/mL的钼酸铵溶液、4.293 mg/mL的硅酸钠溶液、1mol/L的盐酸溶液、pH=10的NH3-NH4Cl缓冲溶液;在25 mL的比色管中准确加入28.25 mg/mL的钼酸铵溶液1.80 mL,蒸馏水15.00 mL,4.293 mg/mL硅酸钠0.70 mL,盐酸溶液0.35 mL,5.000 mg/mL维生素C溶液 0.00、0.50、1.00、1.50、2.00、2.50 mL,摇匀后置于55 ℃水浴锅中反应5 min,再加入pH=10的缓冲液1.00 mL,用水定容,摇匀,常温放置20 min后用1 cm玻璃比色皿,空白试剂为参比,在734.6 nm处测定吸光度A,绘制浓度-吸光度标准曲线,得曲线方程:y= 26.5650x+ 0.0029,R2=0.9992
样品测定:分别准确称取红提葡萄果肉20 g,加入100 mL浸取剂(质量分数为2%的草酸溶液)迅速捣成匀浆,转移至100 mL容量瓶中,用浸取剂定容、摇匀、过滤,弃去最初5 mL滤液,得维生素C样品液,待用。准确移取3.00 mL样液按照标液配置样品液,测定维生素C含量。
有机酸度的测定:红提葡萄榨汁后取其汁液,利用pH计测定汁液的pH值。
2 结果与分析
2.1 茶多酚、壳聚糖及复合保鲜剂的紫外光谱分析
图1中TP、CS为20 mg茶多酚、壳聚糖分别与50 mL稀醋酸摇匀后的紫外光谱曲线,TP-CS为各取20 mL TP、CS混合搅拌作用1 h后的紫外光谱曲线。
从图1中可知,在同浓度(20 mg /50 mL)条件下,壳聚糖(CS)的紫外吸附光谱是两个几乎平衡的双峰,两个吸附峰分别出现在334 nm和368 nm处;茶多酚(TP)是单峰,吸附峰在430.5 nm 处出现;而茶多酚-壳聚糖混合液只在428 nm处出现了一个吸附峰,与CS、TP相比吸附峰产生位移。可见,茶多酚与壳聚糖发生了相互作用,这与文献[17-18]关于酚类与多糖作用的研究相符。

图1 茶多酚、壳聚糖及其作用液的紫外可见光谱
2.2 茶多酚/壳聚糖复合保鲜剂的抗氧化性
图2是随着CS+TP保鲜剂中TP含量的递增,保鲜剂对DPPH·、OH-清除率的变化曲线。

图2 茶多酚含量对DDPH、OH-清除率的影响
从图2可知,CS+TP保鲜剂随着茶多酚含量的增加对DPPH·、OH-自由基清除能力均呈先上升后下降的趋势。当TP含量从0.6%增至1.2 %时,CS+TP保鲜剂对DPPH·自由基的清除能力达到最高为97.0%;而TP含量增至1.0 %时,其OH-自由基清除能力就达到顶峰为96.7%;在CS+TP保鲜剂中TP含量在1.2%之后对两种自由基的清除能力基本一致。这是TP浓度较大时,在复合液中的运动受限或是其酚羟基与CS等物质发生交联,使游离酚羟基数量或活性发生变化。
2.3 茶多酚-壳聚糖保鲜剂的保鲜效果
图3是在常温25~30℃下,茶多酚-壳聚糖保鲜剂浸涂红提葡萄上,经18 d处理后与对照组保鲜效果(葡萄的失重率、腐烂率,可溶性固形物、还原糖、有机酸(pH)、Vc含量)的对比图。
从图3(a)可知,该CS+TP复合保鲜剂对红提葡萄具有较好保鲜效果。特别是CS+TP(1.4%)的保鲜剂,其失重率较为稳定,在18 d内仍维持在5%以下,CS+TP(1.0%)、CS+TP(1.2%)、CS+TP(1.6%)的保鲜剂也显示出一定的保鲜效果,其失重率较为接近,也在5%左右。对照组CS1.5%和TP1.4%在6 d时失重均较多,均超过5%,随后失重率快速增加。可见,茶多酚和壳聚糖单独配制的保鲜剂效果较差,复合保鲜剂中茶多酚的引入对葡萄的失重率有较大改善,这是因为茶多酚与壳聚糖复合配制的保鲜剂覆盖在葡萄表面形成的保鲜膜具有保水的作用。
图3 (b)可知,CS和TP单独使用时,第6 d以后发生腐烂,CS在第9 d后腐烂率更快,而CS+TP复合保鲜剂对红提葡萄腐烂有抑制作用,特别是配方为CS+TP(1.4%)的复合保鲜剂在第15 d 时,其腐烂率仍然保持在10%左右。这是CS和TP相互作用的效果,使CS+TP复合保鲜能力出现了加和性,这和文献[17-18]的研究结果一致,说明在葡萄表面形成的保鲜膜可能具有抑菌和防止细菌侵入的作用。


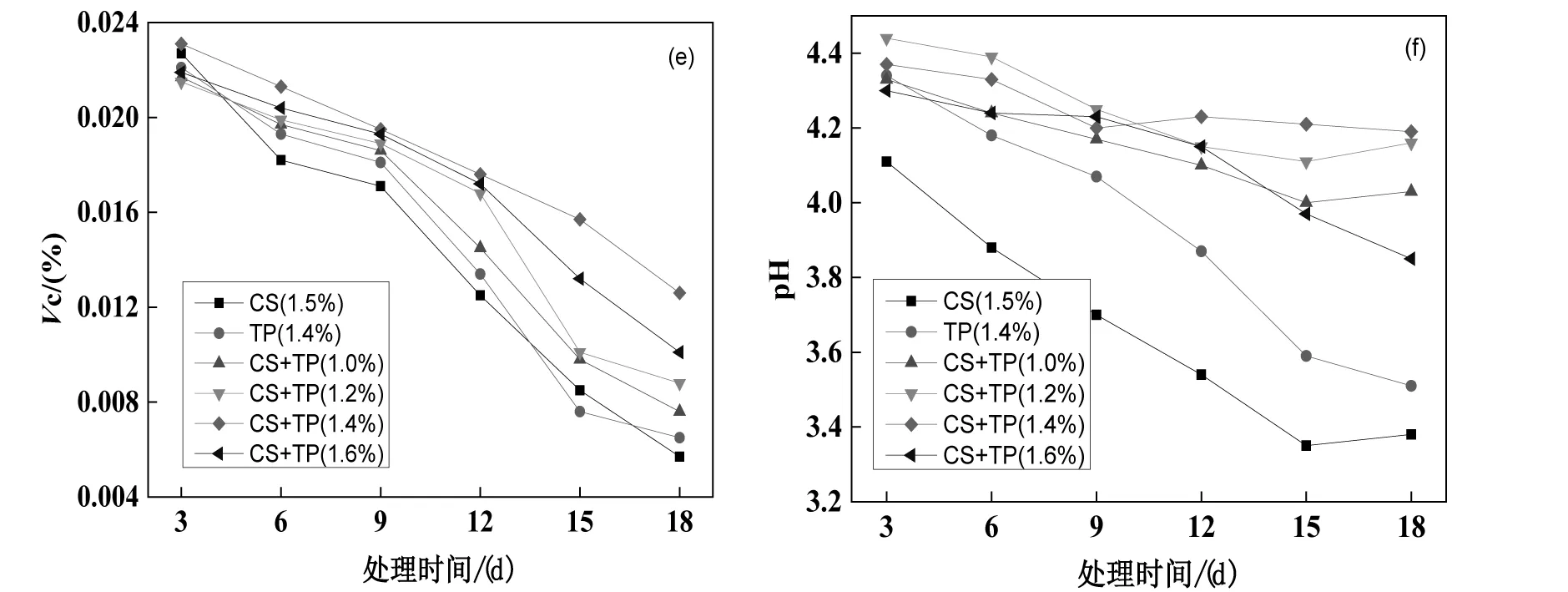
图3 茶多酚-壳聚糖复合保鲜剂的保鲜效果
从图3(c)可见,CS+TP复合保鲜剂对红提葡萄在18 d保鲜处理过程中可溶性固形物含量相对稳定,均维持在18%~21%之间,特别是CS+TP(1.6%)基本维持在20%左右。但用CS(1.5%)和TP(1.4%)作保鲜剂时,红提葡萄中可溶性固形物含量快速下降,这进一步显示出CS+TP有机结合复合保鲜剂的抗氧化性。因为可溶性固形物是纤维素、果胶、植物蛋白、还原糖等成分,在保鲜剂膜的作用下,部分阻止了其与氧的结合,使分解或损坏较少。
在图3(d)、(e)中,还原糖和Vc含量随着保鲜处理时间的延长,全都呈现出下降趋势,只是CS(1.5%)和TP(1.4%)下降较为快速,而CS+TP(1.4%)下降最为缓慢,对还原糖和Vc含量有一定保持作用,在第15 d时仍维持较高水平。通常情况下,还原糖和Vc在氧气、水和光的作用下溶解、水解较快,红提葡萄表面具有保鲜膜时,限制了氧气、水的进入和光的作用,因此,还原糖和Vc含量获得了一定程度的保持。
图3(f)中,在红提葡萄的保鲜处理过程中,CS(1.5%)和TP(1.4%)的pH下降速度特别快,第6 d的pH就降至3.5左右,在第6 d 后葡萄完全变酸,而CS+TP(1.4%)保持得较好,第18 d后pH仍然保持在4.2以上。同上,红提葡萄表面具有保鲜膜时,纤维素、果胶、植物蛋白、还原糖等成分含量得到保持,减少了溶解、水解,于是减少了有机酸的生成,因此pH的降低得到抑制。
通过对红提葡萄的保鲜试验,从失重率、腐烂率、可溶性固形物、还原糖、Vc、pH考察指标,发现茶多酚/壳聚糖复合保鲜剂比茶多酚、壳聚糖单独使用的保鲜效果有很大提高,对失重率、腐烂率、可溶性固形物和有机酸均较敏感,由此可以评价其保鲜效果。茶多酚用量在CS+TP(1.4%)时,只有还原糖指标稳定性稍差,可以确定此用量保鲜效果为最佳。在常温25~30 ℃下,可使葡萄贮藏期从茶多酚、壳聚糖单独使用时的6 d左右延长至15 d以上,这可能是茶多酚与壳聚糖有机结合,建立相互作用的结果。
3 结论
将茶多酚、壳聚糖制备了一种保鲜效果良好的复合保鲜剂,通过紫外光谱和保鲜性能分析,证明茶多酚、壳聚糖之间建立了一定相互作用,使其复合物保鲜性能提高。理化指标显示,不同茶多酚浓度的复合保鲜剂均对红提葡萄具有较好的保鲜效果,特别是CS+TP(1.4%)保鲜剂能使红提葡萄在常温25~30 ℃下,常规保藏期由9 d增加至15 d,延长保藏期6 d。

