酶法催化甘油解制备亚麻籽油甘油二酯及其氧化稳定性分析
孙晓雪,汪 勇,崔立明,张 震*
(1.暨南大学 理工学院,广东 广州 510632;2.脂代科技(北京)有限公司,北京 100083)
亚麻,是世界上十大油料作物之一,在全世界均有分布,主要包括美国、加拿大、阿根廷和中国。在我国,亚麻属于传统的油料作物,主要分布于西北、华北等地区[1]。亚麻籽是亚麻的种子,根据地区和品种的不同,亚麻籽含油率为20%~40%。亚麻籽油含有丰富的n-3不饱和脂肪酸,占总氨基酸质量的50%左右[2]。大量科学研究表明亚麻籽油对人体营养健康具有重要的作用,在抗炎、降血压、降血脂与降胆固醇、抑制癌症的产生和转移、改善糖尿病、提高记忆力、改善视力等方面具有积极作用[3]。当前我国居民n-3不饱和脂肪酸摄入较少,长期摄入不足会导致身体处于亚健康状态,因此开发富含n-3不饱和脂肪酸的亚麻籽油产品在未来具有广阔的应用前景。
甘油二酯是天然油脂中存在的微量成分,是油脂代谢的中间产物,由两分子脂肪酸与甘油骨架组合而成,包括1,3-DAG和1,2(2,3)-DAG两种异构体。其中1,3-DAG具有较高的营养价值,在体内的代谢途径不同于传统甘油三酯,摄入后难以再合成中性脂肪,最终以CO2和H2O的形式释放。对于控制体内脂肪积累、降低血脂和餐后血糖效果显著[4]。1,2(2,3)-DAG是体内合成磷脂和甘油三酯(triacylglycerol,TAG)的前体物质,还可以通过合成心肌蛋白质改善心肌功能紊乱。1992年,日本花王公司推出DAG油,被日本政府许可为保健食品。2000年,美国食品药品监督管理局将DAG批准为公认安全性食品,可用作食用油。2021年DAG被中华人民共和国国家卫生健康委员会列入“新食品原料终止审查目录”中,意味着中国对DAG安全性和功能性的认可。关于DAG早期的研究主要围绕其作为表面活性剂的特性,近年来随着研究深入,关于DAG营养价值的研究也越来越多,研究发现DAG在人体内可以增加脂肪酸的β氧化,影响脂代谢相关基因的表达,具有减肥、降血脂、抑制脂肪堆积、调节胰岛素水平等功能[5]。1,3-DAG和TAG在人体内的生物利用度和吸收率相似,在进入人体后都会被水解产生脂肪酸,从而被人体消化吸收,因此亚麻籽油DAG在进入人体后,其中的n-3不饱和脂肪酸仍能被人体吸收,发挥其功效。若能将DAG与亚麻籽油的优点相结合,生产出既具有DAG功能特性又具有亚麻籽油营养特性的功能性油脂,对中国未来健康油脂的发展具有重要意义。
目前,DAG的制备主要包括化学法和酶法,其中酶法制备DAG因为反应条件温和,不需要使用大量有机试剂,安全性高而受到广泛关注。酶法制备方法主要包括:直接酯化法、甘油解法、水解法和酯交换法[6-7]。其中甘油解反应过程简单、原料来源丰富。作者以亚麻籽油和甘油为原料,Lipozyme CALB酶为催化剂,采用甘油解反应制备DAG,探究适宜的制备工艺条件,通过分子蒸馏脱除游离脂肪酸(free fatty acids,FFA)和单甘酯(monoacylglycerol,MAG),得到精制DAG产品。同时,因为亚麻籽油DAG不饱和脂肪酸含量较多,容易发生氧化反应,导致油脂变质,利用差示扫描量热仪(differential scanning calorimetry,DSC)对添加抗氧化剂前后的亚麻籽油DAG的氧化稳定性进行研究,为产品货架期的预测提供参考。
1 材料与方法
1.1 材料与试剂
一级亚麻籽油:益海嘉里金龙鱼粮油食品股份有限公司产品;Lipozyme CALB:诺维信(中国)生物科技有限公司产品;甘油、正己烷(分析纯):天津市大茂化学试剂厂产品;TBHQ:广东广业清怡食品科技有限公司产品。
1.2 仪器与设备
GC-7820A气相色谱仪(gas chromatography,GC):美国Agilent公司产品;MD-80分子蒸馏:广州市汉维仪器设备有限公司产品;OS20-S数显型顶置式强力电子搅拌器:美国SCILOGEX公司产品;DSC-1型差示扫描量热仪:梅特勒-托利多公司产品;SHZ-D(Ⅲ)循环水式真空泵:巩义市予华仪器有限责任公司产品;KDC-220HR高速冷冻离心机:高教研(北京)科技有限公司产品;IKA HS-10磁力加热搅拌器:德国IKA设备有限公司产品。
1.3 研究方法
1.3.1 亚麻籽油DAG的制备称取亚麻籽油、甘油、Lipozyme CALB酶于250 mL锥形瓶中,在80℃、300 r/min条件下搅拌反应一段时间。反应结束后,将产物移入离心管,以10 000 r/min离心10 min。收集上清液加热10 min使残留的酶失活,得到亚麻籽油DAG。
1.3.2 单因素实验设计以亚麻籽油为原料,DAG质量分数为指标,分别对酶添加量、反应温度、反应时间、底物物质的量比、初始加水量5个单因素进行甘油解制备亚麻籽油DAG工艺探究,单因素实验设计见表1。
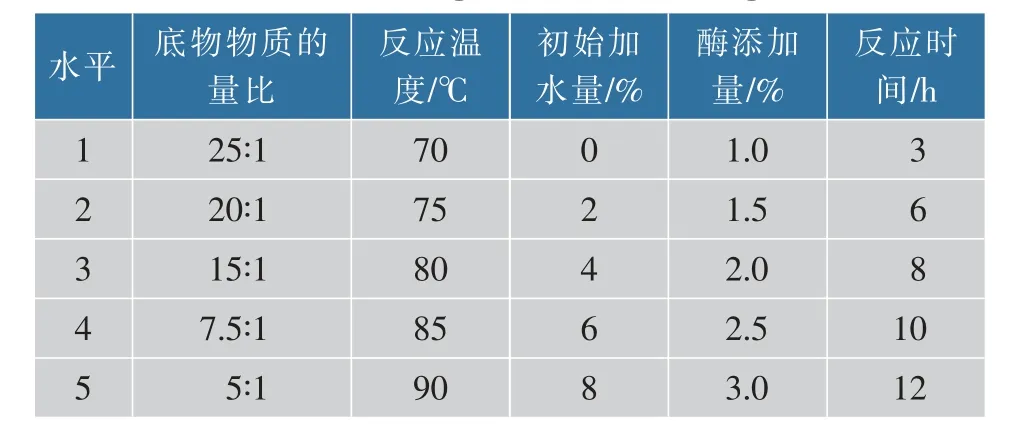
表1 单因素实验设计表Table 1 Single factor test design
1.3.3 反应产物中甘油酯组成分析参考文献[8]的方法对甘油解制备样品的甘油酯组成进行分析。取50 mg甘油酯样品,用5.0 mL正己烷将其完全溶解,将溶液通过滤膜过滤于样品瓶中。样品制备完毕后置于GC检测。GC条件:DB-1ht毛细管柱(15 m×0.25 mm×0.1μm),进样量1μL,分流比40∶1;柱箱温度50℃,离子火焰检测器温度380℃;载气为N2,流量4.17 mL/min。阶段性程序升温检测:初始温度50℃,保持1 min,然后以50℃/min升至100℃,80℃/min升至220℃,30℃/min升至290℃,50℃/min升至330℃,保持2 min,最后以50℃/min升至380℃并保持3 min。采用面积归一化法分别对FFA、MAG、DAG和TAG进行定量分析。
1.3.4 分子蒸馏技术应用分子蒸馏是一种有效的分离纯化技术,与大多数纯化方法相比,分子蒸馏温度低、真空度高、物料受热时间短,可以保持原有物质的功能特性,可在不显著改变油脂品质的情况下,提高甘油酯混合物中DAG含量[9]。在该实验中,经离心后的上层反应液含有未反应的TAG以及生成的FFA、MAG、DAG。通过分子蒸馏从制备的甘油酯混合物中纯化DAG。利用分子蒸馏能够通过轻相去除绝大部分FFA和MAG,但因为自由程相近,较难分离DAG和TAG,因此重相组分中DAG占比更为重要。所以,重相组分中DAG与TAG的比值越大,分子蒸馏后,DAG的纯度越高。参考Zhang等的方法采用分子蒸馏对甘油酯进行纯化[10],参数设定见表2。

表2 分子蒸馏仪器参数表Table 2 Molecular distillation parameters
1.3.5 脂肪酸组成分析参考Zhou等方法采用GC对样品的脂肪酸组成进行分析[11]。使用氢氧化钾-甲醇溶液和正己烷溶液对油样进行甲酯化,使脂肪酸转化为脂肪酸甲酯,进行GC分析确定脂肪酸组成。GC条件:CP-sil88毛细管柱(100 m×0.25 mm×0.2μm),进样量1μL,分流比40∶1;柱箱温度80℃,离子火焰检测器温度240℃;载气为N2,流量4.17 mL/min。阶段性程序升温检测:初始温度120℃,保持3 min,以8℃/min升至175℃,保持18 min。通过标准样品法和面积归一化法分别对脂肪酸进行定性和定量分析。
1.3.6 氧化稳定性测定通过控制DSC的程序温度和空气流量,可以测定油脂样品在特定条件下氧化时的放热趋势,从而得到样品热功率与温度和时间的关系,根据放热峰初始处的最大斜率切线与外推基线的交点,能够获得样品的起始氧化温度和诱导时间[12]。
起始氧化温度测定:参考Rudnik等的方法[13]。设定升温速率为10℃/min,温度从120℃升至300℃,空气流量30 mL/min。起始氧化温度在DSC曲线图上表现为氧化反应前外推基线与反应时放热峰初始最大斜率切线相交点对应的温度。
氧化诱导时间测定:称取(10±2)mg样品置于铝坩埚内密封,为便于空气进入,盖顶扎孔,设置空铝坩埚为对照。设置等温氧化温度为90、100、110、120℃,先将样品在30 mL/min的N2环境下升温到设定温度,保持5 min,然后通入相同流量的空气。氧化诱导时间为氧化反应前外推基线与氧化反应过程最大斜率的切线相交时的对应时间。
动力学数据分析采用Kaseke等的方法[14]。温度与油脂氧化反应速率的关系由Arrhenius方程表示。
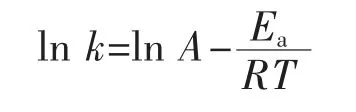
式中:k为氧化反应速率常数(氧化诱导时间倒数);A为指前因子;Ea为活化能,kJ/mol;R为摩尔气体常数,8.314 J/(mol·K)。对ln k和1/T拟合生成线性方程,活化能和频率因子可通过方程的斜率和截距计算得到。
1.3.7 实验数据处理与统计分析各组实验重复3次,采用均值±标准差表示实验结果。使用SPSS 26.0软件对结果进行差异性分析(P<0.05)。
2 结果与分析
2.1 单因素实验
2.1.1 底物物质的量比对DAG得率影响在反应温度80℃、初始加水量(质量分数)8%、反应时间3 h、加酶量(质量分数)1.0%条件下,考察甘油与亚麻籽油物质的量比(25∶1、20∶1、15∶1、7.5∶1、5∶1)对甘油解反应生成DAG的影响,结果见图1。随着甘油添加量的减少,DAG呈先增加后降低的趋势,TAG先减少再增加。当底物物质的量比为20∶1时,DAG质量分数达到最大,为24.61%,TAG质量分数最少,为73.74%,DAG与TAG比值为0.33。再减少甘油添加量,DAG反而减少。这可能是因为甘油解反应为可逆反应,在甘油添加量较低时,甘油含量的增加可以使底物增加,促进反应向正方向进行[15]。但是甘油含量过高时,体系黏度过大,影响搅拌效果,导致各物质接触不够充分,反而降低了反应速率。因此,选择甘油和亚麻籽油的物质的量比为20∶1。
2.1.2 反应温度对DAG得率影响在底物物质的量比20∶1、初始加水量(质量分数)8%、反应时间3 h、加酶量(质量分数)1.0%条件下,考察反应温度(70、75、80、85、90℃)对甘油解反应生成DAG的影响,结果见图2。反应温度在70~80℃时,DAG随反应温度升高而增加,TAG不断减少,这是因为当反应温度升高时,混合体系黏度降低,酶与底物分子之间的碰撞加剧,反应速率增加,反应向正方向进行[16];在80℃时,DAG质量分数达到最大24.61%,即为Lipozyme CALB的最适催化温度;超过80℃后,DAG随反应温度升高而减少,TAG增加,酶的催化效果降低。因为当反应温度高于最适温度时,酶被钝化,导致酶催化活力下降,不利于甘油解反应进行[17]。因此,选择反应温度为80℃。

图1 甘油与亚麻籽油物质的量比对反应产物中各组分的影响Fig.1 Effect of molar ratio of glycerol to flaxseed oil on the components of reaction products
2.1.3 初始加水量对DAG得率影响在底物物质的量比20∶1、反应温度80℃、反应时间3 h、加酶量(质量分数)1.0%条件下,考察初始加水量(质量分数为0、2%、4%、6%、8%、10%)对甘油解反应生成DAG的影响,结果见图3。随着初始加水量的增加,DAG生成量逐渐降低,并在加水量达到6%后趋于平缓。初始加水量对酶解反应有一定影响,反应初始阶段加入一定量的水分,能够帮助酶分子维持其构象,发挥催化活性[18]。但是在实验中,初始加水量从0增加至10%,产物DAG质量分数从29.06%降至20.43%,而TAG含量依旧保持较高水平。这可能是因为微量的游离水分即可满足催化甘油解反应的条件,对于Lipozyme CALB酶来说,其本身含水量较高,不需要额外添加水分即可达到较好的催化效果,过多的水分反而影响酶的活性[19]。因此,选择初始加水量为0。
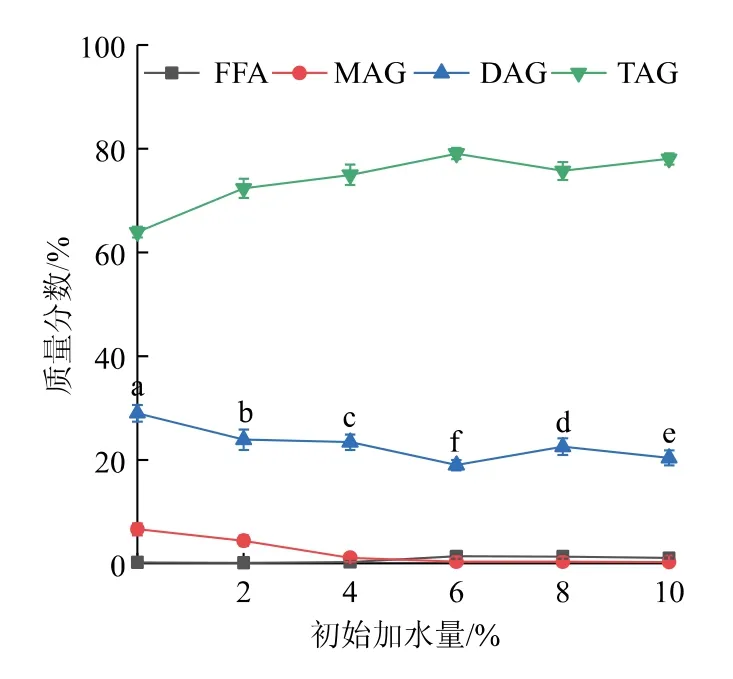
图3 初始加水量对反应产物中各组分的影响Fig.3 Effect of initial water content on the components of reaction products
2.1.4 酶添加量对DAG得率影响在底物物质的量比20∶1、反应温度80℃、反应时间3 h、初始加水量为0的条件下,考察酶添加量(质量分数为1.0%、1.5%、2.0%、2.5%、3.0%)对甘油解反应生成DAG的影响,结果见图4。当加酶量从1.0%提高到2.0%时,TAG降低,促进了TAG进行甘油解反应,生成DAG。由此可见,在酶质量浓度比较低时,随着酶添加量的增加,甘油解速率也在不断增加。当加酶量为2.0%时,DAG质量分数达到最大,为36.29%,此时DAG与TAG比值为0.70。当加酶量从2.0%增加到3.0%时,DAG质量分数处于稳定状态,并略有降低,这可能是因为当反应中酶质量浓度较高时会发生酶分子聚结[20],进而导致反应速率降低。因此,选择酶添加量为2.0%。
2.1.5 反应时间对DAG得率影响在底物物质的量比20∶1、反应温度80℃、初始加水量为0、加酶量(质量分数)2.0%条件下,考察反应时间(3、6、8、10、12 h)对甘油解反应生成DAG的影响,结果见图5。随着反应时间的延长,DAG呈现先增加后减少的趋势,TAG先减少后增加,MAG逐渐上升。在反应前10 h内,反应向有利于DAG生成的方向进行;反应时间为10 h时,DAG质量分数达到最大47.13%,此时TAG质量分数为33.98%,DAG与TAG比值为1.39;之后随着反应时间的延长,DAG开始下降,生成越来越多的TAG。但是在整个过程中,MAG质量分数呈上升趋势,从11.37%上升至18.63%,FFA质量分数始终较低。这说明,在反应初始阶段脂肪酸不断从TAG上被分解下来,并与甘油相结合,从而生成MAG和DAG。继续延长反应时间至12 h,DAG开始下降。这可能是因为反应时间超过10 h后,DAG的形成速率低于分解速率,导致质量分数降低[21],同时随着反应时间的延长,酶蛋白质结构也会发生改变,导致酶活力降低[22]。因此,选择反应时间为10 h。
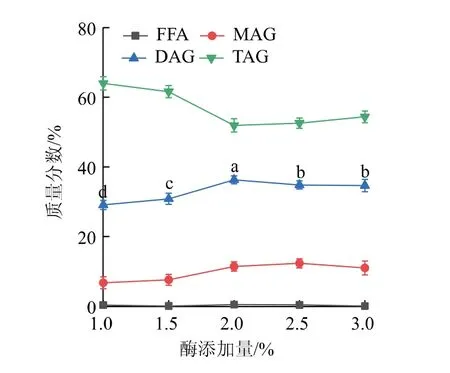
图4 酶添加量对反应产物中各组分的影响Fig.4 Effect of enzyme dosage on the components of reaction products

图5 反应时间对反应产物中各组分的影响Fig.5 Effect of reaction time on the components of reaction products
2.2 氧化稳定性测定
2.2.1 DAG的纯化采用GC对分子蒸馏前后样品的甘油酯组成与质量分数变化进行分析,结果见表3。经分子蒸馏纯化后,样品中的甘油酯组分发生了明显变化。分子蒸馏前样品中FFA质量分数为0.61%,MAG质量分数为18.28%,DAG质量分数为47.13%,TAG质量分数为33.98%。经过分子蒸馏后,产物中只剩DAG和TAG,DAG质量分数上升为57.18%。说明经分子蒸馏后,可除去FFA和MAG,达到纯化DAG的目的。

表3 分子蒸馏前后甘油酯组成及质量分数Table 3 Composition and mass fraction of acylglycerols before and after molecular distillation
2.2.2 脂肪酸组成分析油脂的氧化稳定性与脂肪酸组成有关,不饱和脂肪酸含量越高,油脂越容易氧化。采用GC对样品脂肪酸组成进行分析,结果见表4。对比原料亚麻籽油和分子蒸馏前后亚麻籽油DAG脂肪酸组成可知,脂肪酸种类没有发生变化,质量分数略有变化。其中亚麻酸(n-3脂肪酸)在经过甘油解反应得到的DAG中略有降低,由54.58%降低至53.27%。经过分子蒸馏纯化后脂肪酸组成没有明显变化,亚麻籽油DAG的脂肪酸仍以亚麻酸为主。
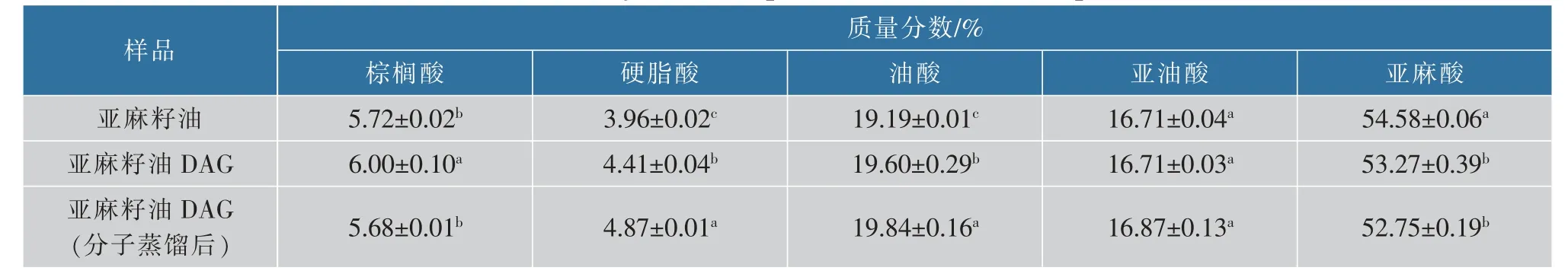
表4 不同样品脂肪酸组成Table 4 Fatty acids compositions of different samples
2.2.3 油脂样品起始氧化温度和氧化诱导时间由DSC曲线(见图6)得到样品的起始氧化温度为139.8℃。因此,选择低于起始氧化温度20~50℃的温度,即90~120℃作为测定氧化诱导时间的等温温度[12],进行氧化稳定性分析。

图6 产品亚麻籽油DAG的氧化曲线Fig.6 Oxidation curve of DAG prepared from flaxseed oil
通过测定油脂样品氧化诱导时间的长短,可以了解油脂的氧化稳定性,诱导时间越长表明油脂的氧化稳定性越好,诱导时间越短,油脂氧化稳定性越差。以TBHQ(0.20 g/L)作为抗氧化剂,通过DSC法测定添加前后的亚麻籽油DAG氧化诱导时间结果见表5。根据氧化诱导时间的倒数确定样品的氧化反应速率常数k,见表6。
从表5和表6可以看出,随着氧化温度的升高,样品的氧化诱导时间减少,反应速率常数k增加,说明氧化反应随着温度的升高而加剧。
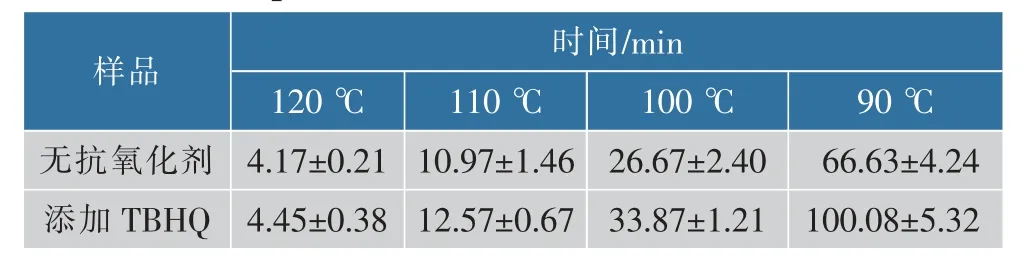
表5 不同等温温度下氧化诱导时间Table 5 Oxidation induction time at different isothermal temperatures

表6 不同等温温度下的氧化反应速率常数kTable 6 Reaction rate constants k at different isothermal temperatures
2.2.4 货架期的预测将lg k与反应温度T最小二乘法回归可得到回归方程,对ln k和1/T拟合生成线性方程,根据斜率计算得到Ea,见表7。
由表可知,lg k与反应温度T呈线性相关,根据回归方程可以预测特定温度下的反应速率常数k或氧化诱导时间。因此,将25℃代入回归方程,通过计算可以得到在室温条件下,不添加抗氧化剂的亚麻籽油DAG理论货架期仅为2.63×104min,约37 d,添加抗氧化剂TBHQ的亚麻籽油DAG理论货架期可延长至7.81×104min,约109 d,说明TBHQ对DAG的氧化稳定性具有显著提升效果。因为温度等外部因素对氧化的影响能够量化,所以通过加速氧化实验可以预测室温下油脂的氧化稳定时间[23],获得理论货架期。
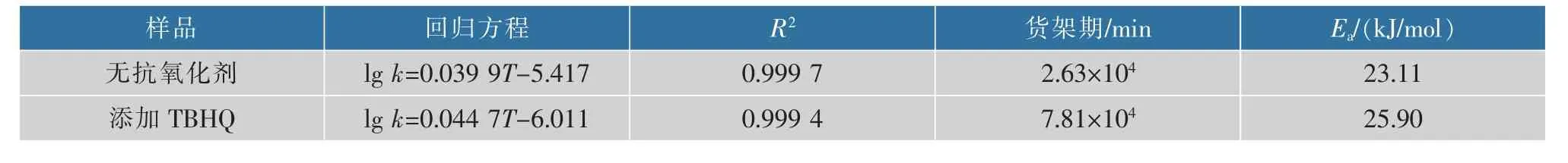
表7 lg k与T回归方程、25℃下理论货架期及E aTable 7 Regression equation of lg k and T,the theoretical shelf life and E a at 25℃
由此可知,DSC可以快速准确地测定油脂的理论货架期,其样品用量少、测试时间短、不需要消耗化学试剂、自动化程度高、操作简便,有利于油脂产品的质量监控和预测油脂样品的氧化稳定时间[24]。
3 结语
作者对亚麻籽油DAG的甘油解制备条件和制得DAG的氧化稳定性进行了研究。通过单因素实验得到了制备较高纯度DAG的适宜条件,在反应时间10 h,反应温度80℃,甘油与亚麻籽油物质的量比20∶1,加酶量(质量分数)2.0%的条件下反应,利用分子蒸馏精制得到了质量分数为57.18%的亚麻籽油DAG,产物中亚麻酸质量分数为52.75%。利用DSC法对亚麻籽油DAG的氧化稳定性进行了研究,通过添加TBHQ作为抗氧化剂,显著增强了亚麻籽油DAG的氧化稳定性,理论货架期能够延长至109 d。

