线粒体去乙酰化蛋白SIRT3在噪声诱导隐匿性听力损失中的作用
杨紫荆 赵春丽梁文琦陈钟壡 柳 柯 龚树生*
(1.首都医科大学附属北京友谊医院耳鼻咽喉头颈外科,北京 100050;2.首都医科大学耳聋疾病临床诊疗与研究中心,北京 100050)
噪声性听力损失(noise-induced hearing loss, NIHL)是最为常见的感音神经性聋之一[1]。现代社会日益成为一种充满噪声源的环境,因此NIHL也得到了广泛关注。听力损害的程度与接触噪声的种类、强度和时间等因素密切相关,研究[2-3]表明,短时中等强度的噪声暴露仅造成暂时性听力阈移 (temporary threshold shift, TTS), 这种听阈变化可在噪声后一段时间内恢复的现象被Liberman等[2]命名为隐性听力损失 (hidden hearing loss, HHL)。研究[3-4]表明噪声性隐性听力损失(noise-induced hidden hearing loss, NIHHL)虽不会引起永久性听力下降,但会造成耳蜗内结构的损伤,具体表现为内毛细胞 (inner hair cell, IHCs)与螺旋神经节神经元之间带状突触(ribbon synapses, RS)的损害,从而影响声音的处理,是NIHHL的重要致病机制。
线粒体是哺乳动物细胞有氧呼吸的主要场所,其代谢产物活性氧(reactive oxygen species, ROS)的累积近年来被认为是NIHL的主要发病机制之一[5-6]。因此,线粒体功能正常是内耳细胞进行多种生理活动的必要条件。线粒体主要的去乙酰化蛋白(sirtuin-3, SIRT3)是Sirtuins家族中的一员,在维持细胞氧化还原稳态和能量调节中起着重要的作用[7]。研究[8-10]表明,SIRT3可抵抗耳蜗内氧化应激从而保护听力,然而其在NIHHL中是否也发挥同样的作用还不明确。因此,本研究建立了NIHHL小鼠模型,通过抑制SIRT3来探讨其在NIHHL中的具体作用,为噪声性聋的发生和防治提供理论依据。
1 材料与方法
1.1 主要试剂
SIRT3抑制剂[3-(1H-1,2,3-triazol-4-yl) pyridine, 3-TYP] (美国MCE公司);5%(体积分数)山羊血清(北京中杉金桥生物技术公司);0.3%(体积分数)Triton X-100(美国Sigma公司);4-羟基壬烯醛 (4-hydroxynonenal, 4-HNE)抗体(英国Abcam公司);CtBP2抗体、Myosin-VIIa抗体 (美国BD Biosciences公司);山羊抗鼠IgG1 Alexa Fluor 568抗体、山羊抗兔IgG (H+L) Alexa Fluor 647抗体(美国Invitrogen公司)。
1.2 实验动物与分组
C57BL/6J雄性小鼠购自北京斯贝福生物技术有限公司,实验动物许可证号:SCXK(京)2019-0010,实验动物的使用遵循医学实验动物管理实施细则以及首都医科大学实验动物管理细则。对小鼠听力初筛排除异常小鼠后,将其采用数字表法随机分为对照组 (Control组,n=8)、噪声组 (NE 组,n=8) 和3-TYP组(n=8)。其中3-TYP组在噪声前1周对小鼠进行腹腔注射3-TYP,50 mg·kg-1·d-1,连续7 d,而噪声组只接受噪声暴露,未做其余处理。两组小鼠均在6周龄接受噪声,并于噪声后24 h及2周进行ABR测听(图1)。以上所有组别小鼠均于12 h暗环境中饲养,每笼最多5只,可自由进食和饮水。所有涉及实验动物的实验流程和操作都经过首都医科大学伦理审查委员会批准,伦理审批号:AEEI-2018-011。
图1 小鼠噪声暴露模式图 Fig.1 Schematic diagram of noise exposure in mice
1.3 噪声暴露
将噪声组及3-TYP组小鼠置于隔音室内相对的两个扬声器中间,暴露于100 dB声压级(sound pressure level, SPL)的宽带白噪声2 h。功率放大器与调音台相连接,Cool Edit Pro软件 (Adobe Systems, San Jose, CA)对声音进行编辑合成。
1.4 听力测试
为了评估噪声后小鼠的听力情况,对其进行了听觉脑干反应 (auditory brainstem response, ABR) 测试。小鼠腹腔注射100 mg/kg氯胺酮麻醉后,置于隔音室内,分别将参考电极插入待测耳乳突后,记录电极插入颅顶正中皮下,地极插入对侧耳乳突后。特定频率click、4 kHz、8 kHz、16 kHz、32 kHz声音刺激以5 dB为间隔从90 dB依次衰减至0 dB,通过耳道内的塑料管传递给小鼠,并记录可重复波形处最小声音强度为听力阈值和90 dB处 ABR I波的幅值。以上所有测试及听力评估均由同一人完成。
1.5 带状突触计数
脊椎脱臼法处死小鼠,取双侧耳蜗浸泡于4% (质量分数) 多聚甲醛中4 ℃固定过夜。10% (体积分数) EDTA脱钙后,于镜下剥离外壳、外侧壁、盖膜等结构,将剩余基底膜分为顶中底三转,置于含有5% (体积分数) 山羊血清和0.3% (体积分数) Triton X-100的破膜液中,室温破膜2 h,4 ℃条件下,一抗(1∶500)孵育过夜,待PBS磷酸盐缓冲液洗涤3次后,加入二抗(1∶300)室温孵育2 h。样本在共聚焦显微镜下(Hessen公司, 德国)扫描成像,从顶回至底回,分别选取3个区域,对每个区域内大约10个内毛细胞下的突触进行计数。
1.6 冰冻切片染色
取材固定后的剩余耳蜗于10% (体积分数) EDTA脱钙12 h,再置于30% (质量分数) 蔗糖溶液中脱水2 h,OCT (Tissue-Tek)包埋过夜。将制备完成的耳蜗标本以10 μm厚度进行平行于蜗轴的冰冻切片,并在孵育相应的一抗及二抗后,于共聚焦显微镜下扫描成像。最后用Image J 软件对荧光强度进行分析。
1.7 统计学方法

2 结果
2.1 抑制SIRT3对小鼠听力的影响
为了研究噪声对不同组别小鼠的影响,通过ABR测听检测了不同频率处小鼠的听力阈值。与对照组相比,噪声组小鼠在噪声后一天4 kHz、8 kHz、16 kHz、32 kHz频率处听力阈值明显升高,差异有统计学意义(P<0.01),且以高频听力损失严重,差异有统计学意义(P<0.001)。这种听力变化在第14天基本恢复正常(P>0.05,图2A、B)。3-TYP组小鼠在噪声后一天各频率处听力阈值均显著升高,差异有统计学意义(P<0.001),在第14天听力阈值虽有恢复趋势,却未能达到正常水平 (P<0.05,图2A、C)。同时,记录噪声后第14天4 kHz、8 kHz、16 kHz、32 kHz 4个频率下90 dB SPL的I波幅值。噪声后的小鼠I 波幅值显著降低,差异有统计学意义(P<0.05),且在3-TYP组更为明显,差异有统计学意义(P<0.001,图2D)。
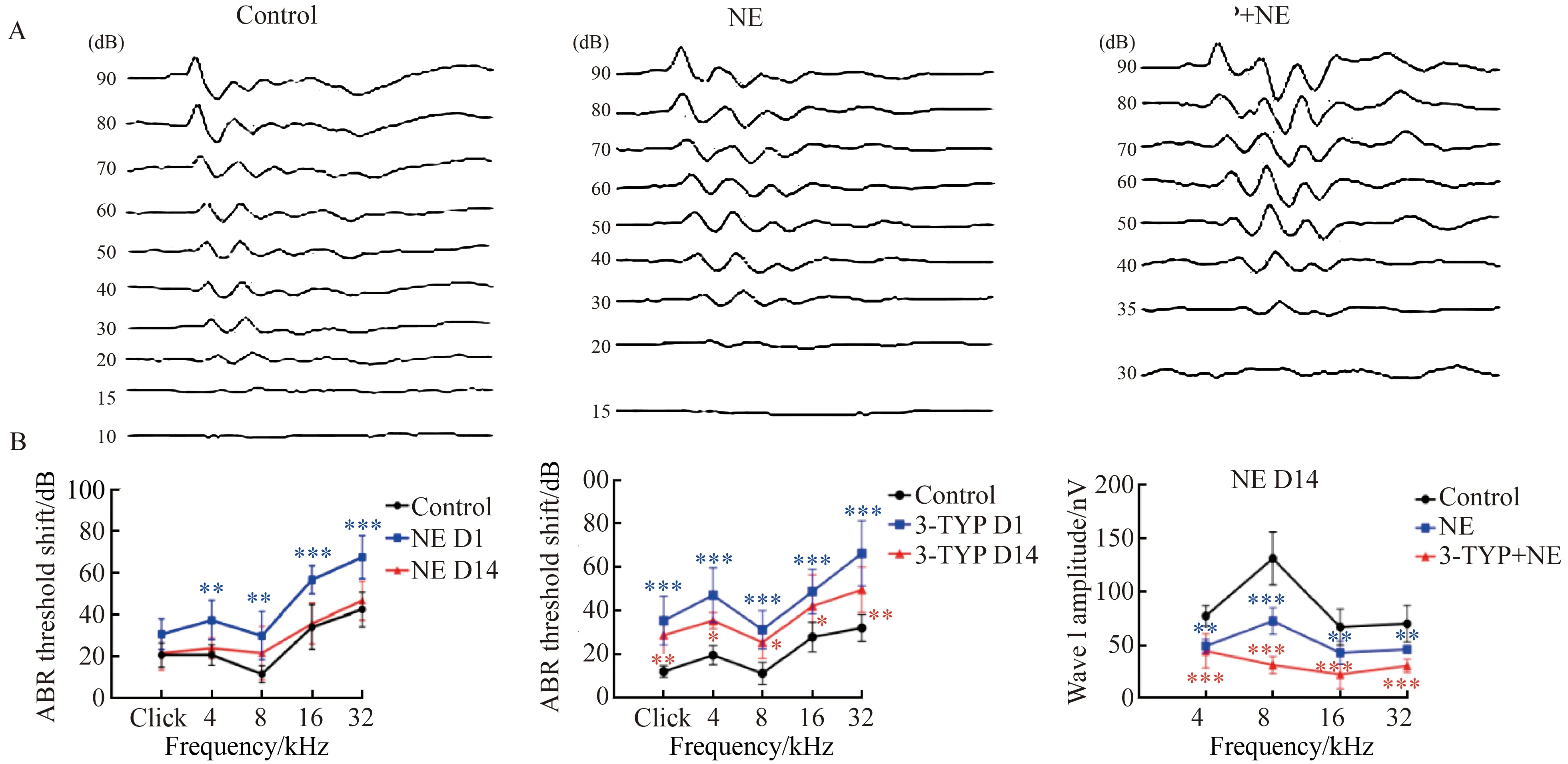
图2 噪声后1 d和14 d NE组及3-TYP组ABR听力阈值的变化Fig.2 Changes of ABR threshold in the NE group and 3-TYP group one day and fourteen days after NE
2.2 抑制SIRT3可加重耳蜗带状突触损害
为了研究噪声是否引起了内耳结构的损害,取耳蜗基底膜进行了免疫荧光染色。与对照组相比,各组别间内外毛细胞数量及形态未见明显变化,然而在噪声后第14天NE组小鼠中转带状突触的丢失,差异有统计学意义(P<0.01),且3-TYP组小鼠带状突触的丢失比NE组更为明显,差异有统计学意义(P<0.001, 图3)。

图3 噪声后第14天不同组别耳蜗中转耳蜗带状突触计数 Fig.3 Quantification of ribbon synapses in IHCs of the middle turn of cochlea in the different groups after fourteen days of NE
2.3 抑制SIRT3可使耳蜗组织氧化应激水平升高
为了检测耳蜗内的ROS水平,采用冰冻切片进行4HNE染色。与对照组相比,在噪声组与3-TYP组小鼠IHCs中4HNE表达均有升高,且3-TYP组升高更为明显,差异有统计学意义(P<0.001, 图4)。
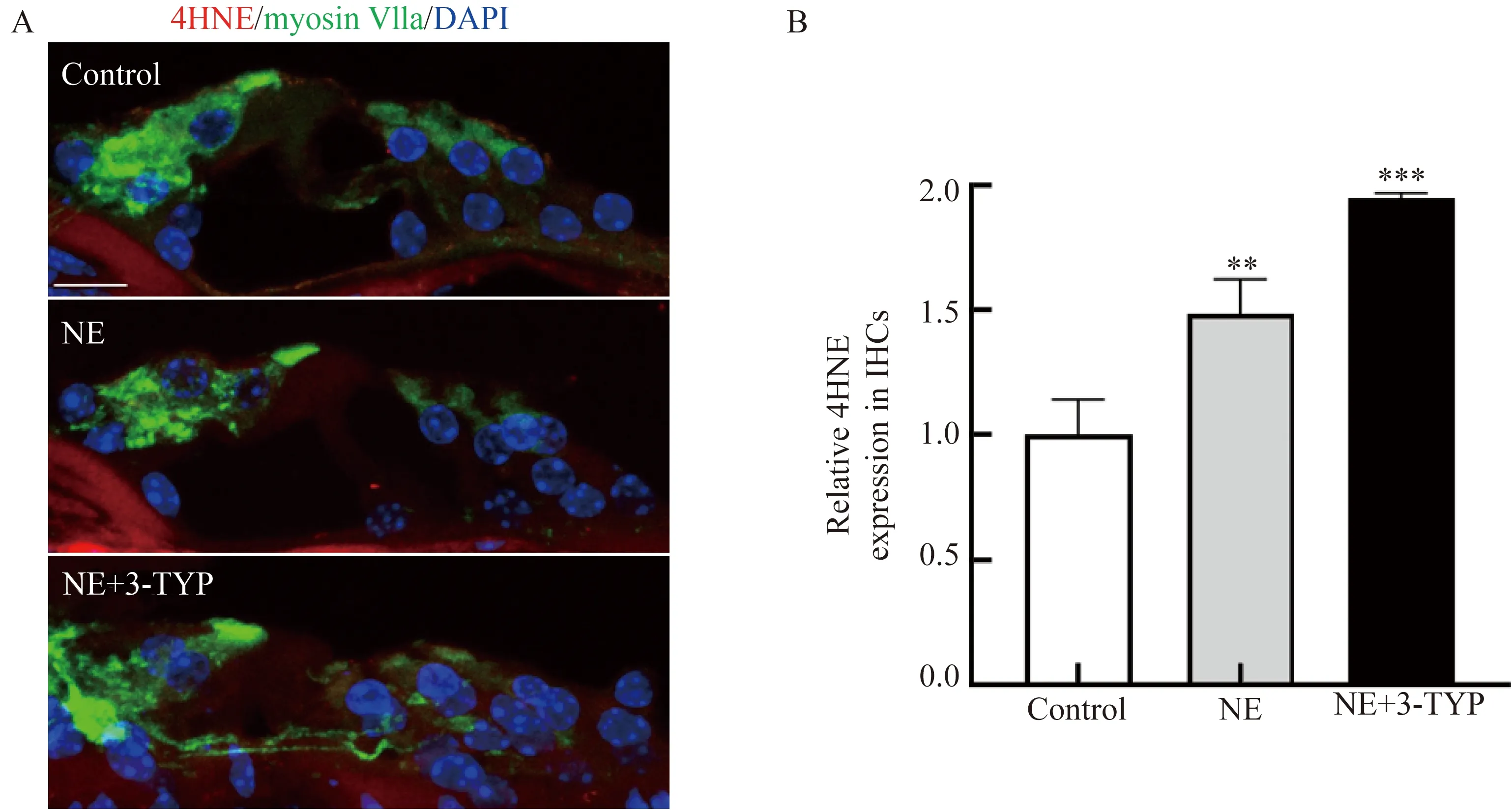
图4 抑制 SIRT3后内毛细胞ROS的累积情况Fig.4 ROS accumulation in IHCs after inhibition of SIRT3
3 讨论
NIHL按病理状态可分为两种:暂时性听力损失和永久性听力损失。其中,仅在噪声暴露后出现暂时性听力阈移的听觉功能障碍被称为NIHHL[11-13]。噪声后内耳的氧化应激可能与这种改变有关。SIRT3是定位于线粒体的一种去乙酰化蛋白,在过去的实验中,被证实参与维持各系统氧化还原的稳态,也可在热量限制下介导抗氧化系统的激活,预防年龄相关性听力损失[8, 14-15]。在体外实验[16]中证实了ROS 诱导的线粒体氧化损伤会驱使毛细胞凋亡,而SIRT3 对于保护线粒体功能和保护耳蜗免受氧化损伤至关重要。为进一步研究SIRT3在耳蜗中的作用以及NIHHL的发病机制,对小鼠进行了中低强度的NE,与之前的报道[17-18]一致,小鼠在噪声后听力阈值明显升高,并在两周后恢复正常,表现为TTS。3-TYP是一种SIRT3特异性抑制剂,在其他研究[19-20]中被证实通过腹腔注射,能有效降低SIRT3浓度。本研究结果显示,在使用3-TYP抑制SIRT3后,经过噪声暴露的小鼠2周后听力虽有恢复趋势,但未能达到正常水平,因而笔者推测SIRT3在NIHHL中可能抵抗噪声所带来的影响。
声音的感受与处理很大程度上取决于耳蜗内感觉毛细胞的功能状态。已有研究[21]证实,表现为TTS的动物,虽未有听力受损,但IHCs与螺旋神经节细胞 (spiral ganglion cells, SGCs)之间的突触连接中断,形成了内耳早期损伤。既往研究[22]也表明,耳蜗内有害性ROS的累积可造成DNA等生物大分子的损伤,影响线粒体功能,从而影响听力。为了阐明SIRT3保护内耳的具体机制,取小鼠耳蜗基底膜进行了形态学研究。结果显示,噪声后两周的小鼠虽未见有毛细胞损伤,但其RS在中高频听力所在区域发生丢失,且抑制SIRT3后,这种丢失更为明显。这与ABR测试中I波幅值的降低相应,表明了RS功能的异常。本研究还发现,与对照组相比,噪声后小鼠IHCs内4HNE表达增加,且在3-TYP组更为明显,这些结果表明噪声可引起耳蜗内ROS累积,并造成带状突触的损伤,而SIRT3的抑制使其对抗氧化应激的能力下降。
NIHHL是一种噪声引起的仅表现为带状突触损伤的听觉功能障碍。尽管已有研究[16, 23]证明了SIRT3对耳蜗细胞的保护作用,但针对其在噪声后内耳中作用的体内研究还比较少。本研究中,短时间中等强度的噪声暴露虽未给听力带来直接影响,但已然在内耳中形成了早期氧化损伤,而SIRT3的下调使耳蜗细胞中ROS累积增加,从而加重了带状突触的丢失,影响噪声后听力的恢复,阐明了其对听觉系统的保护作用,可能是通过抵抗氧化应激以保护带状突触来实现的。然而SIRT3的抗氧化作用是多种通路共同参与的结果,今后将在此基础上,将目光聚焦于其上下游分子,进一步完善NIHL的研究,从而为临床相关疾病的防治提供可能的药物靶点和理论依据。
利益冲突所有作者声明无利益冲突。
作者贡献声明杨紫荆:实验、数据收集和论文撰写; 赵春丽:数据收集; 梁文琦、陈钟壡:数据分析; 柳柯、龚树生:研究设计和论文指导。

