大蒜素对糖尿病肾病大鼠肾组织细胞焦亡的影响
沈金峰, 朱慧萍, 胡芳, 晏子友, 李云生, 钟森
(1.温岭市第一人民医院,浙江温岭 317500;2.龙岩市中医院,福建龙岩 364000;3.江西中医药大学,江西南昌 330006)
糖尿病肾病(diabetic nephropathy)是导致慢性肾脏病及终末期肾病的首要原因[1]。细胞程序性死亡在糖尿病肾病发生发展中起重要作用[2]。细胞焦亡是一种新型的程序性细胞死亡方式,与细胞凋亡、坏死不同,当细胞发生焦亡时,细胞内释放大量物质,诱发强烈的炎症反应,因此又称细胞炎性坏死[3]。已有研究表明,细胞焦亡是造成糖尿病肾病潜在的炎性发病机制之一[4]。近年来,以细胞焦亡为切入点,探讨糖尿病肾病的潜在治疗药物及其疗效机制成为研究热点。大蒜素(diallyl trisulfide)是从大蒜鳞茎中获得的挥发性油状物,化学名为二烯丙基三硫化物[5],研究发现,其具有抗心肌纤维化、降脂、抗肿瘤、抗老年痴呆、抗炎、抗菌、抗氧化、抗感染、保护心血管、保护肾脏等广泛药理学作用,其中,在抗炎方面的研究最为深入[6]。既往有研究表明,大蒜素具有减少糖尿病肾病大鼠蛋白尿和保护肾功能的作用[7],但其具体干预机制尚不清楚。基于此,本研究观察大蒜素对糖尿病肾病大鼠肾组织细胞焦亡的影响,探讨大蒜素对糖尿病肾病的干预机制,以期为大蒜素临床治疗糖尿病肾病提供可靠依据,现将研究结果报道如下。
1 材料与方法
1.1 动物50只SPF级成年雌性大鼠,体质量180~200 g,由浙江省医学科学院实验动物中心提供,动物质量合格证号:SCXK(浙)20180003。动物适应1 周,尿蛋白阴性者方可使用。饲养环境:温度(22± 3)℃、相对湿度(55±10)%。本实验方案已通过温岭市第一人民医院实验动物伦理委员会审查。
1.2 药物、试剂与仪器大蒜素(分子式:C6H9S3),购自上海禾丰制药有限公司,生产批号:8239402。链脲佐菌素(STZ),美国Sigma 公司生产,批号:040M1412;白细胞介素(IL)-1β、IL-18等抗体(美国R&D Systems 公司);凋亡相关斑点样蛋白(ASC)抗体、含pyrin结构域NOD样受体家族3(NLRP3)抗体(美国CST公司);Caspase-1抗体(英国Abcam 公司);GAPDH 抗体(美国Bioworld 公司)。荧光显微镜,日本Olympus 公司生产。
1.3 动物分组、造模与给药将50只大鼠按体质量随机分为假手术组,模型组,大蒜素低、中、高剂量组,每组10只。假手术组大鼠给予普通饲料喂养,其他组别大鼠给予高糖高脂饲料喂养。4周后,除假手术组外,其他组别大鼠给予一次性腹腔注射链脲佐菌素35 mg·kg-1,假手术组大鼠给予一次性腹腔注射等体积枸橼酸缓冲液。72 h后大鼠尾静脉取血,若随机血糖≥16.7 mmo·L-1则提示糖尿病造模成功。定期检测大鼠血糖和24 h 尿蛋白定量水平,24 h 尿蛋白定量>30 mg 为糖尿病肾病模型成功标准[8]。造模成功后开始灌胃。按照沈映君主编的《中药药理学》[9]中药实验用药选择换算大鼠用药剂量,10 倍于临床用药剂量折算为等效剂量给药。大蒜素高、中、低剂量组分别给予10、20、40 mg·kg-1·d-1大蒜素灌胃,假手术组与模型组给予等体积生理盐水灌胃,每日1次,连续8周。
1.4 观察指标与方法
1.4.1 大鼠一般情况 每日观察记录大鼠的毛发、摄食量、活动、精神状态及体质量变化,每周测量尿量、24 h尿蛋白。
1.4.2 肾脏组织病理学观察 沿肾蒂剪下残余肾脏,10%甲醛固定后,流水冲洗,常规脱水,透明,浸蜡,包埋,切片,脱蜡,再分别进行HE、Massion 染色,脱水、封片,光镜下观察肾脏组织的改变。
1.4.3 二氢乙啶(DHE)荧光探针检测肾组织活性氧簇(ROS)含量 取肾组织冰冻切片,复温至室温,PBS 洗涤3 次,每次5 min。擦干玻片水渍,将含有DHE的PBS滴加于玻片上,37 ℃孵育30 min,PBS洗涤3次,抗荧光猝灭剂封片。荧光显微镜观察肾组织中荧光强度,以荧光强度代表ROS水平。
1.4.4 蛋白免疫印迹(Western Blot)法检测肾组织NLRP3、ASC、Caspase-1、IL-1β、IL-18 蛋白表达 取40 mg大鼠肾组织,加裂解液,研磨,二喹啉甲酸(BCA)蛋白定量法测定蛋白浓度,加热使蛋白变性;十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白,将蛋白转至聚偏氟乙烯(PVDF)膜,50 g/L 脱脂奶粉封闭2 h;分别加入1∶2000 稀 释 的NLRP3、ASC、Caspase-1、IL-1β、IL-18 等一抗,4 ℃孵育过夜;TBST 洗膜3 次,每次10 min,加入辣根过氧化物酶(HRP)标记的免疫球蛋白(IgG)二抗(1∶5000稀释),室温孵育1 h;TBST 洗膜3次,每次10 min,滴加电化学发光液(ECL)(A 液、B 液按1∶1 混匀),化学发光成像系统曝光。以GAPDH 为内参,计算目的蛋白的相对表达量。
1.4.5 免疫组织化学检测肾组织IL-1β、IL-18表达 取肾组织石蜡切片,脱蜡,乙醇梯度水化,柠檬酸钠抗原修复,去除内源性过氧化物酶。10%牛血清白蛋白(BSA)室温封闭1 h;滴加IL-1β、IL-18(1∶1000 稀释)等一抗,4 ℃孵育过夜;二抗(1∶500稀释)室温孵育1 h。加入3,3’-二氨基联苯胺(DAB)显色,染色30 s,冲洗5 min,乙醇脱水,然后透明,封片。使用ImageJ 软件分析IL-1β、IL-18阳性表达强弱。
1.5 统计方法采用SPSS 22.0统计软件进行数据分析。计量数据以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠24 h尿蛋白定量水平比较与假手术组比较,模型组大鼠24 h 尿蛋白定量水平升高(P<0.05);与模型组比较,大蒜素低、中、高剂量组大鼠24 h 尿蛋白定量水平下降(P<0.05);各剂量组组间比较,大蒜素高剂量组的24 h 尿蛋白定量水平下降最显著(P<0.05)。结果如图1所示。

图1 各组大鼠24 h尿蛋白定量比较Figure 1 Comparison of 24-hour urinary protein amount among various groups of rats
2.2 各组大鼠肾组织病理变化比较假手术组大鼠肾脏肾小球、肾小管结构正常,系膜细胞和基质无增生,肾间质无炎性细胞浸润及纤维化。模型组大鼠肾脏肾小球体积增大,系膜细胞和基质增生,肾小管上皮细胞空泡样变,基底膜增厚、肾间质大量炎性细胞浸润及纤维化。大蒜素低、中、高剂量组大鼠肾小球损伤减轻,系膜细胞及基质增生减轻,肾小管上皮细胞空泡变性减轻,肾间质炎性细胞减少、纤维化减轻,其中,大蒜素高剂量组的肾组织病理损伤最轻。结果如图2所示。
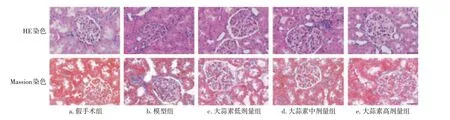
图2 各组大鼠肾组织病理变化比较(×200)Figure 2 Comparison of histopathological changes in the kidney tissue among various groups of rats(×200)
2.3 各组大鼠肾组织ROS水平比较与假手术组比较,模型组大鼠肾组织ROS 水平明显升高(P<0.05);与模型组比较,大蒜素低、中、高剂量组肾组织ROS 水平明显降低(P<0.05);各剂量组组间比较,大蒜素高剂量组的ROS 水平最低(P<0.05)。结果如图3、图4所示。
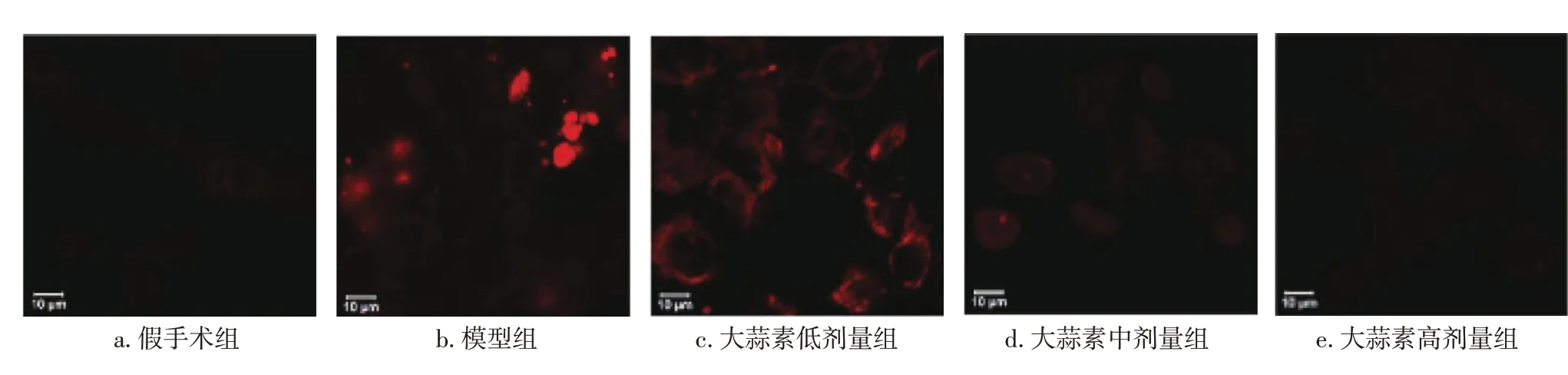
图3 超氧化物阴离子荧光探针(DHE)法检测各组活性氧簇ROS结果(×200)Figure 3 Results of ROS in various groups detected by fluorogenic probe dihydroethidium(DHE)(×200)
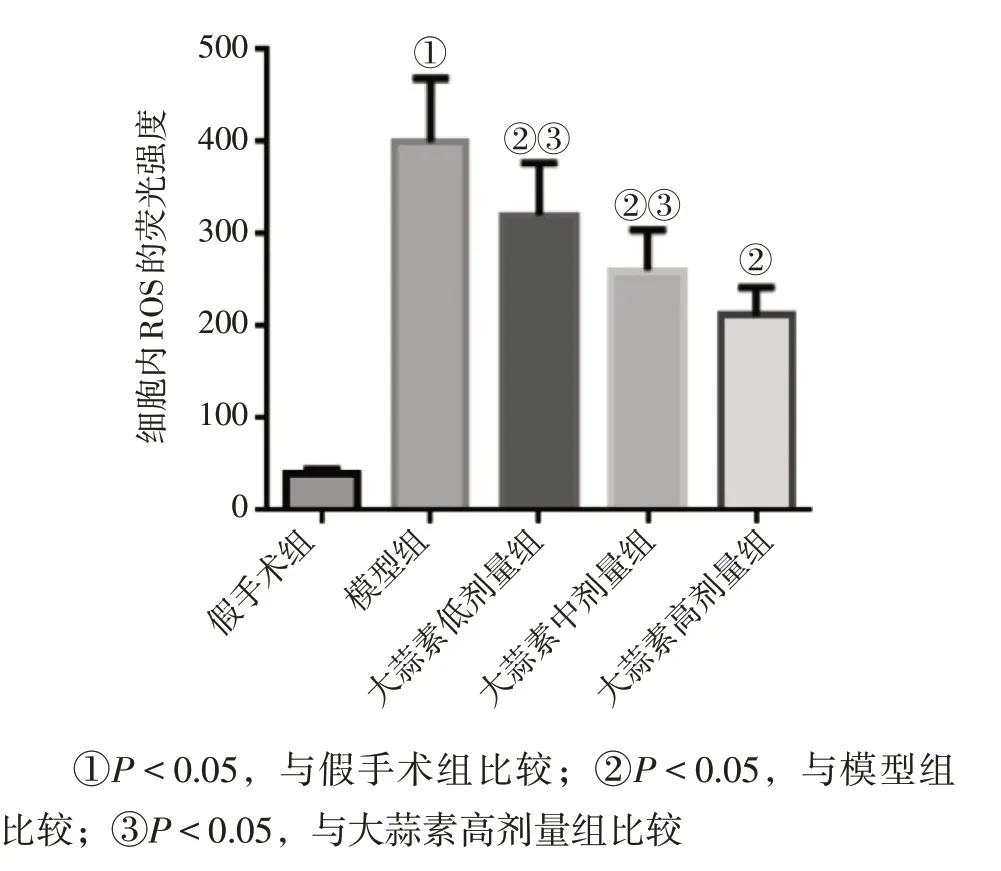
图4 各组大鼠肾组织活性氧簇(ROS)水平比较Figure 4 Comparison of ROS level in kidney tissues among various groups of rats
2.4 各组大鼠肾组织NLRP3、ASC、Caspase-1、IL-18、IL-1β 蛋白表达比较与假手术组比较,模型组大鼠肾组织NLRP3、ASC、Caspase-1、IL-18、IL-1β 蛋白表达水平显著升高(均P<0.05);与模型组比较,大蒜素低、中、高剂量组大鼠肾组织NLRP3、ASC、Caspase-1、IL-18、IL-1β蛋白表达水平降低(均P<0.05);各剂量组组间比较,大蒜素高剂量组NLRP3、ASC、Caspase-1、IL-18、IL-1β蛋白表达水平最低(均P<0.05)。结果如图5、图6所示。
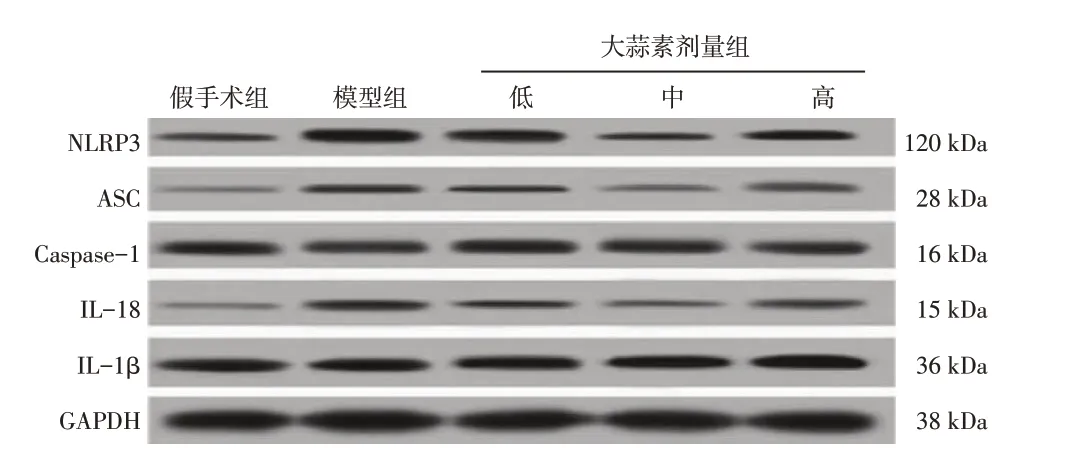
图5 NLRP3、ASC、Caspase-1、IL-18、IL-1β的Western Blot电泳图Figure 5 Western Blot electrophoretogram of NLRP3,ASC,Caspase-1,IL-18,IL-1β
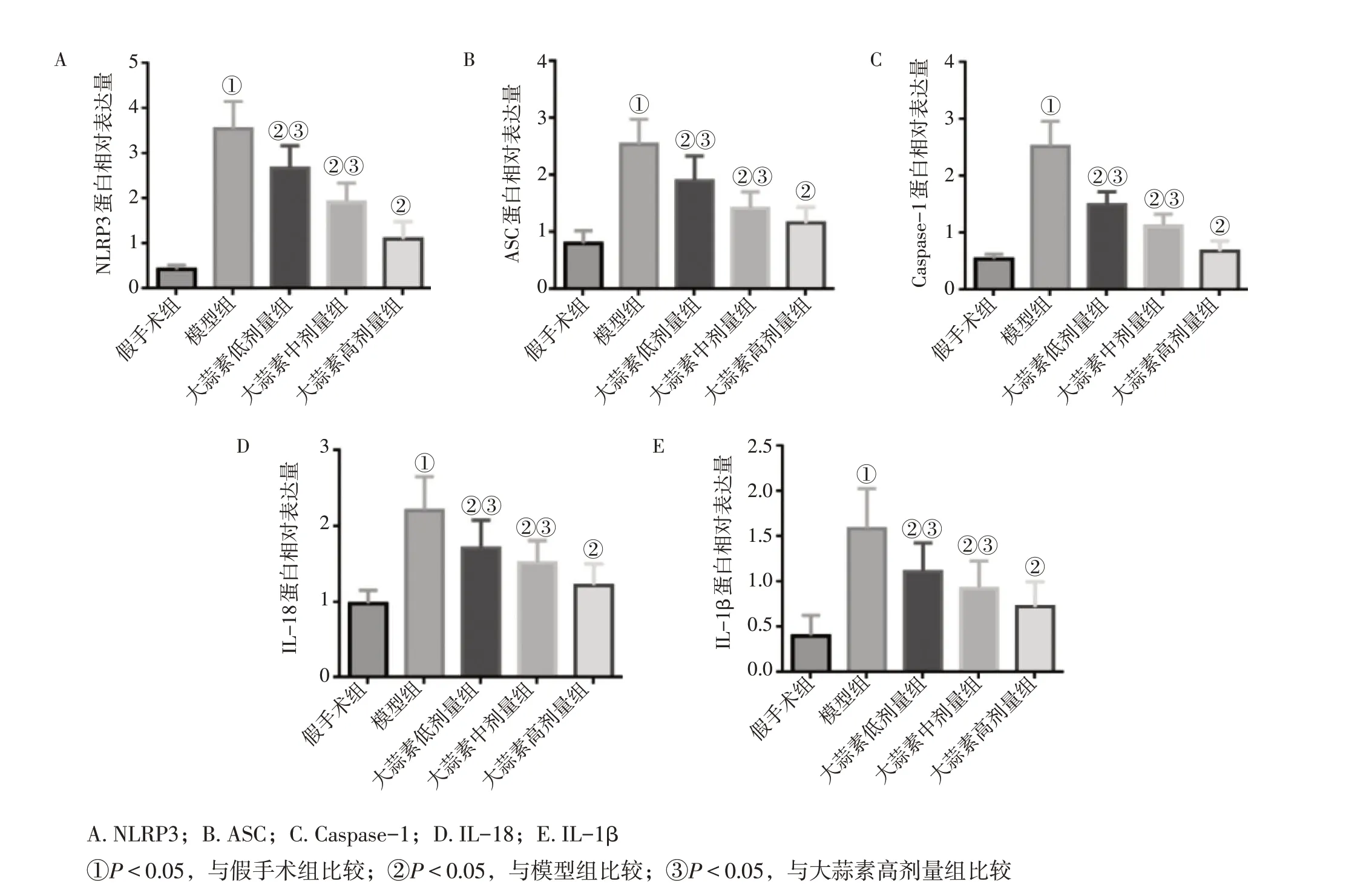
图6 各组大鼠肾组织NLRP3、ASC、Caspase-1、IL-18、IL-1β蛋白表达水平比较Figure 6 Comparison of the expression levels of NLRP3,ASC,Caspase-1,IL-18 and IL-1β proteins in kidney tissues among various groups of rats
2.5 各组大鼠肾组织IL-1β、IL-18 阳性表达比较与假手术组比较,模型组小鼠肾组织IL-1β、IL-18 表达水平显著升高(P<0.01);与模型组比较,大蒜素低、中、高剂量组大鼠肾组织IL-1β、IL-18 表达水平降低(P<0.05);各剂量组组间比较,大蒜素高剂量组IL-1β、IL-18 表达水平最低(P<0.05)。结果如图7、图8所示。

图7 各组大鼠肾组织IL-1β、IL-18免疫组织化学结果(×200)Figure 7 Immunohistochemistry results of IL-1β and IL-18 in kidney tissues in various groups of rats(×200)

图8 各组大鼠肾组织IL-1β(A)、IL-18(B)阳性表达比较Figure 8 Comparison of the positive expression of IL-1β(A)and IL-18(B)in kidney tissues among various groups of rats
3 讨论
糖尿病肾病(diabetic nephropathy)是糖尿病最常见最严重的微血管并发症之一,不但会缩短患者的预期寿命,严重降低患者的生活质量,还会给家庭和社会带来沉重的负担[10-11]。目前,尚无治疗糖尿病肾病的特效药物,主要通过改善患者生活方式、控制血糖、控制血压、纠正脂质代谢紊乱等方式来延缓糖尿病肾病的病情进展。因此,进一步探索糖尿病肾病发病机制及寻找治疗糖尿病肾病的药物研究具有重要的社会和经济意义。
研究发现,焦亡在糖尿病肾病发展中发挥重要作用[12]。细胞焦亡(pyroptosis)是一种炎症小体介导的依赖于Caspase-1 的细胞程序性死亡方式。NLRP3 炎症小体是细胞内的免疫复合物,通过NOD 受体识别进而激活并释放Caspase-1,诱导细胞肿胀,胞膜溶解,细胞破裂释放炎性物质(IL-18、IL-1β 等)引起炎症反应[13-14]。当细胞内ROS 产生过多,激活NLRP3 炎性小体,致使细胞焦亡[15-16]。线粒体是ROS 产生的重要部位,90%内源性ROS 由线粒体产生[17]。而肾脏是高耗能器官,富含线粒体,高糖可直接诱导肾小管上皮细胞产生ROS,还可通过晚期糖基化终末产物和细胞因子间接诱导细胞内ROS 的产生[18]。当肾组织ROS增加,ROS 通过NLRP3 诱发炎症反应介导细胞焦亡,当使用线粒体分裂抑制剂(Mdivi-1)能有效减少ROS 产生,从而抑制肾小管上皮细胞焦亡,保护肾脏功能[19]。高血糖症所致的糖基化终末产物增加,也是糖尿病肾病氧化应激的重要刺激因素,后者促进细胞内线粒体分解代谢,导致ROS 积聚并触发NLRP3 炎性小体途径,最终导致细胞发生焦亡[20]。Li 等[21]发现通过调节ROS 可以降低Caspase-1 水平从而抑制糖尿病肾病肾小管上皮细胞的焦亡。上述研究均证实了ROS 介导的细胞焦亡是糖尿病肾病发病的关键因素。
中药含有丰富抗氧化单体,可用于糖尿病肾病的防治[22]。本项目负责人长期从事大蒜素治疗肾病的研究。大蒜作为药食同源植物,其营养、药用成分及功效均得到了广泛关注和研究,《本草纲目》记载:其“能达下焦,消水,利大小便……能通幽门,治关格不通”。说明大蒜可用于治疗慢性肾病。大蒜素属于抗氧化剂,在有机溶剂中能够捕捉自由基,可保护重要的生物分子不被氧化[23]。对烟曲霉感染的小鼠,已有研究发现大蒜素可减轻其ROS/NLRP3 途径所致的自噬和焦亡[24]。因此,我们预测大蒜素是具有一定潜力的治疗糖尿病肾病中药单体。
本研究结果显示:建立的糖尿病肾病模型大鼠肾组织ROS 水平及NLRP3、ASC、Caspase-1、IL-1β、IL-18 表达升高,肾组织发生细胞焦亡;经大蒜素治疗后糖尿病肾病大鼠肾组织病理损伤减轻,肾组织ROS 水平降低,NLRP3、ASC、Caspase-1、IL-1β、IL-18 表达下降,与剂量呈相关性。提示大蒜素可以通过抑制细胞焦亡有效减轻糖尿病肾病大鼠肾组织病理损伤,从而达到治疗糖尿病肾病的目的。
综上所述,大蒜素能有效减少糖尿病肾病大鼠尿蛋白,其机制可能与抑制ROS/ NLRP3/Caspase-1通路活化,减轻肾组织细胞焦亡相关。

