加减仙方活命饮治疗重度痤疮的疗效及与血清IL-1α和IL-4表达的相关性分析
杨文志, 潘锡伟, 甘海芳
(深圳市宝安中医院皮肤科,广东深圳 518100)
痤疮,临床多发于青春期人群,该病一般是由于体内热毒引发的皮肤炎症,进而伤害面部及背部等油脂溢出部位毛囊皮脂腺的病症,在临床上有丘疹、结节、粉刺、囊肿、脓疱等不同表现[1]。痤疮虽不会危及生命,但对面部美观的损害,可能会导致患者尤其是青少年患者缺失自信,进而引起社交障碍的发生,严重者会导致患者出现心理疾病[2-4]。因此,探讨和研究痤疮疾病的防治已成为了皮肤科的重要课题。既往研究[5]表明,中药治疗痤疮可取得较好的疗效,且副作用小。仙方活命饮出自《校注妇人良方》,该方有清热解毒、消肿散结等功效,是“疮疡之圣药,外科之首方”[6]。现代医学研究发现,痤疮的发生发展与机体免疫功能出现异常之间存在紧密的联系,细胞因子在血清中的表达失衡直接或者间接参与痤疮疾病过程的炎性损害反应,提示机体微环境失衡是引发痤疮发生的重要诱因[7]。白细胞介素1(IL-1)是一个炎症细胞因子家族,其中白细胞介素1α(IL-1α)是其在皮肤的主要存在形式,IL-1α会引起毛囊皮脂腺导管的过度角化,导致痤疮疾病的发展[8]。有研究[9-11]证明,免疫细胞分泌的IL-1α、白细胞介素4(IL-4)参与了免疫反应的调节过程,均可作为痤疮严重程度的指标。本研究旨在通过采用加减仙方活命饮治疗重度痤疮,并探讨患者血清IL-1α、IL-4表达与疗效的关系,为重度痤疮的治疗寻求更有效的方法。
1 对象与方法
1.1 研究对象及分组选取2018年1月至2019年10月期间在深圳市宝安中医院皮肤科门诊就诊且明确诊断为重度痤疮的80例患者作为试验对象,采用随机数字表将患者随机分为治疗组与对照组,每组各40例;另选取40例体检健康者作为正常组。本研究经过深圳市宝安中医院伦理委员会的审核批准,且所有受试者均签署了知情同意书。
1.2 诊断和分级标准
1.2.1 痤疮诊断标准 参照《中国临床皮肤病学》[6]中的有关痤疮的诊断标准:①青少年人群多发;②创面多发于前胸后背以及脸部;③痤疮轻者表现为粉刺、丘疹,重者表现为红肿型脓疱、囊肿或结节;④痤疮一般会致皮肤完整性受损及病灶刺痛或疼痛。
1.2.2 痤疮分级标准 ①轻度(Ⅰ级):表现为粉刺、丘疹,病灶数≤30 个;②中度(Ⅱ级):表现为粉刺、丘疹和脓疱,病灶数为31~50 个;③中度(Ⅲ级):表现为大量丘疹、脓疱,皮损严重,病灶数为51~100 个,结节数≤3 个;④重度(Ⅳ级):痤疮多呈聚集型的结节和囊肿,并且病灶及周围痛感强烈,病灶数≥100个,结节数或囊肿数≥3个。
1.3 纳入标准①符合上述痤疮诊断标准且痤疮分级为重度;②年龄18~30岁,性别不限;④自愿参加本研究并签署知情同意书的患者。
1.4 排除标准①年龄<18岁或>30岁的患者;②根据痤疮分级标准,属于轻中度的患者;③过敏性假性痤疮患者;④近期服用维生素酸类、抗生素类以及与本次试验相关药物的患者;⑤对试验药物过敏的患者;⑥合并有胃肠道疾病、心脑血管疾病、自身免疫性疾病、精神疾病及其他并发症的患者;⑦哺乳期或妊娠期女性;⑧依从性差,未按治疗方案进行治疗的患者。
1.5 治疗方法
1.5.1 外用治疗 2组患者均给予阿达帕林凝胶外涂治疗。用法:阿达帕林凝胶(商品名:泰林海;生产厂家:福元药业有限公司;批准文号:国药准字H20183400)外用,每日1次,涂抹于患处。
1.5.2 治疗组 给予加减仙方活命饮内服治疗。用法:加减仙方活命饮(为本院协定验方,由白芷、贝母、防风、赤芍、当归尾、甘草、皂角刺、天花粉、乳香、没药、金银花、陈皮等中药组成,由深圳市宝安中医院中药房按规定剂量统一配制),每日1剂,常规煎取约300 mL药液,分2次分别于早晚饭后服用。疗程为1个月。
1.5.3 对照组 给予盐酸多西环素片联合维生素B6片内服治疗。①盐酸多西环素片(生产厂家:江苏联环药业股份有限公司;批准文号:国药准字H32021266),口服,每天2 次,每次1 片。②维生素B6 片(生产厂家:广东华南药业集团有限公司;批准文号:国药准字H44023351),口服,每日3次,每次1片。疗程为1个月。
1.6 观察指标
1.6.1 皮损评分 参照《中国痤疮治疗指南(2014年修订版)》[2]制定皮损评分标准。(1)粉刺:①0 分:<8 个;②1 分:8~20 个;③2 分:21~30个;④3分:31~50个;⑤4分:>50个。(2)丘疹:①0分:≤3个;②1分:4~8个;③2分:9~15个;④3分:16~30个;⑤4分:>30个。(3)脓疱:①0分:无;②1分:1~3个;③2分:4~5个;④3 分:6~20 个;⑤4 分:>20 个。结节囊肿:①0分:无;②3分:1~3个;③4分:>3个。各皮损评分之和为皮损总积分。分值越高,表示皮损情况越严重。观察2组患者治疗前后各项皮损评分及皮损总积分的变化情况。
1.6.2 血清IL-1α与IL-4检测 抽取受试者清晨空腹静脉血各5 mL,离心后取上清,采用酶联免疫吸附(ELISA)法检测血清IL-1α、IL-4 的表达水平,严格按照试剂盒操作说明书进行。IL-1α检测试剂盒、IL-4 检测试剂盒均由浙江华立生命科技有限公司提供,RT-6100酶标仪由江苏赛德力制药机械制造有限公司提供。2组患者于治疗前后各检测一次,并与正常组进行比较。
1.6.3 安全性评价 治疗过程中,观察2组患者腹泻、腹部不适、皮肤瘙痒、皮肤红肿等不良反应发生情况,以评价2组治疗方案的安全性。
1.7 疗效评价标准参照《中药新药临床研究指导原则(试行)》[12],根据治疗前后症状积分的变化情况评价疗效。症状积分减少率=(治疗前积分-治疗后积分)/治疗前积分×100%。①痊愈:皮损消退,症状消失,仅留痘疤,治疗后症状积分减少率在95%及以上;②显效:皮损大面积消失,症状明显减轻,治疗后症状积分减少率在70%~95%之间;③有效:皮损部分好转,治疗后症状积分减少率在50%~70%之间;④无效:皮损未见消退,临床症状未见好转甚至进一步恶化,治疗后症状积分减少率在50%以下。总有效率=(临床痊愈例数+显效例数+有效例数)/总病例数×100%。
1.8 统计方法采用SPSS 19.0统计软件进行数据的统计分析。计量资料用均数± 标准差(x±s)表示,组间比较采用两独立样本t检验,组内治疗前后比较采用配对t检验;计数资料用率或构成比表示,组间比较采用χ2检验;等级资料组间比较采用秩和检验;相关性分析采用Pearson 相关性检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组患者基线资料比较治疗组40例患者中,男21例,女19例;平均年龄(22.67±3.22)岁;病程为2 个月~5年;病灶数为(112.00 ± 9.00)个;结节或囊肿数为(5.50±1.00)个。对照组40例患者中,男22例,女18例;平均年龄(22.49±3.56)岁;病程为9 个月~4年;病灶数为(114.0±10.00)个;结节或囊肿数为(5.50±1.00)个。正常组40例健康体检者中,男22例,女18例;平均年龄(22.36±3.35)岁。2组患者和正常组健康体检者的性别、年龄比较,差异均无统计学意义(P>0.05),具有可比性。2组患者的病程及治疗前病灶数、结节或囊肿数比较,差异也均无统计学意义(P>0.05),具有可比性。
2.2 2组患者治疗前后皮损评分比较表1结果显示:治疗前,2组患者的粉刺、丘疹、脓疱、结节或囊肿等各项皮损评分及皮损总积分比较,差异均无统计学意义(P>0.05)。治疗后,2组患者的粉刺、丘疹、脓疱、结节或囊肿等各项皮损评分及皮损总积分均较治疗前明显降低(P<0.05),且治疗组的降低作用均明显优于对照组,差异均有统计学意义(P<0.05)。
表1 2组重度痤疮患者治疗前后皮损评分比较Table 1 Comparison of skin lesion scores in the two groups of severe acne before and after treatment (±s,分)

表1 2组重度痤疮患者治疗前后皮损评分比较Table 1 Comparison of skin lesion scores in the two groups of severe acne before and after treatment (±s,分)
①P<0.05,与治疗前比较;②P<0.05,与对照组治疗后比较
组别治疗组对照组时间治疗前治疗后治疗前治疗后例数/例40404040粉刺3.50±0.501.50±0.50①②3.50±0.502.50±0.50①丘疹3.00±1.001.00±0.50①②3.00±1.002.00±0.50①脓疱3.20±0.800.50±0.50①②3.10±0.751.50±1.00①结节/囊肿3.15±0.550.70±0.40①②3.20±0.502.10±0.60①总积分14.70±1.103.00±2.50①②14.60±1.207.50±2.80①
2.3 2组患者治疗前后血清IL-1α 与IL-4水平比较表2结果显示:治疗前,2组患者的血清IL-1α 与IL-4 水平比较,差异均无统计学意义(P>0.05),且均较正常组明显升高(P<0.05)。治疗后,2组患者的血清IL-1α与IL-4水平均较治疗前明显降低(P<0.05),其中,治疗组已基本恢复至正常组水平(P>0.05),而对照组仍均高于正常组水平(P<0.05);组间比较,治疗组对血清IL-1α 与IL-4 水平的降低作用均明显优于对照组,差异均有统计学意义(P<0.05)。
表2 2组重度痤疮患者治疗前后血清IL-1α与IL-4水平比较Table 2 Comparison of serum IL-1α and IL-4 levels in the two groups of severe acne before and after treatment (±s,pg·mL-1)
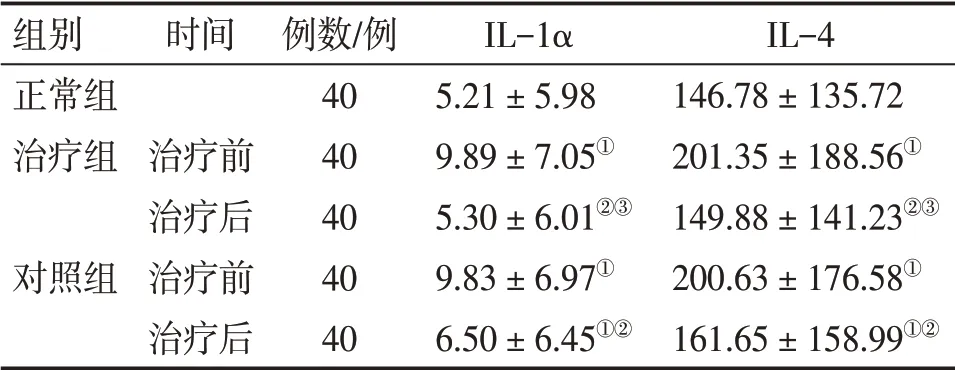
表2 2组重度痤疮患者治疗前后血清IL-1α与IL-4水平比较Table 2 Comparison of serum IL-1α and IL-4 levels in the two groups of severe acne before and after treatment (±s,pg·mL-1)
①P<0.05,与正常组比较;②P<0.05,与治疗前比较;③P<0.05,与对照组治疗后比较
组别正常组治疗组对照组时间治疗前治疗后治疗前治疗后例数/例4040404040 IL-1α 5.21±5.989.89±7.05①5.30±6.01②③9.83±6.97①6.50±6.45①②IL-4146.78±135.72201.35±188.56①149.88±141.23②③200.63±176.58①161.65±158.99①②
2.4 2组患者临床疗效比较表3结果显示:治疗1个月后,治疗组的总有效率为90.0%(36/40),对照组为75.0%(30/40);组间比较(秩和检验),治疗组的疗效明显优于对照组,差异有统计学意义(P<0.05)。

表3 2组重度痤疮患者临床疗效比较Table 3 Comparison of clinical efficacy in the two groups of severe acne [例(%)]
2.5 2组患者不良反应发生情况比较表4结果显示:治疗过程中,治疗组的不良反应发生率为7.5%(3/40),对照组为10.0%(4/40),组间比较(χ2检验),差异无统计学意义(P>0.05)。

表4 2组重度痤疮患者不良反应发生情况比较Table 4 Comparison of adverse reaction incidence in the two groups of severe acne [例(%)]
2.6 IL-1α、IL-4表达与加减仙方活命饮疗效的相关性分析临床疗效用治疗后患者症状积分减少率表示,症状积分减少率越大,疗效越好。图1结果显示:加减仙方活命饮治疗重度痤疮患者1个月后,患者血清IL-1α 和IL-4 的相对表达水平与治疗后患者症状积分减少率呈负相关(r值分别为-0.51、-0.60),差异均有统计学意义(P<0.05)。
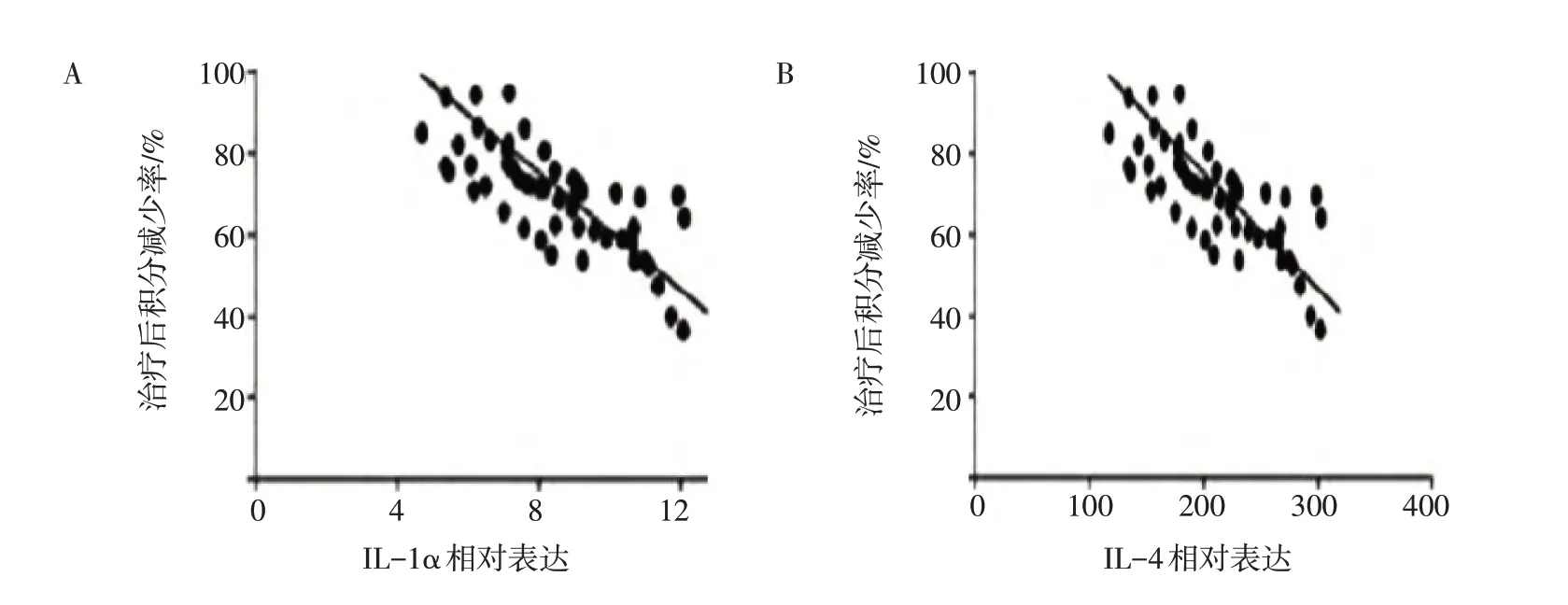
图1 IL-1α(A)、IL-4(B)表达与加减仙方活命饮疗效的相关性分析Figure 1 Correlation analysis of serum IL-1α and IL-4 levels with the clinical efficacy of modified Xianfang Huoming Yin for the treatment of severe acne
3 讨论
重度痤疮对面部美观的损害,给患者的生活带来一定的不良影响,因此,人们一直致力于寻求重度痤疮最合适的治疗方案。中医学认为,痤疮的发病在于热毒,治疗上宜清热、解毒为主[13]。现代医学有关痤疮的发病机制较为复杂,部分学者的研究[14-15]指出,痤疮是由于遗传、体内激素失调以及不注意卫生等所导致的毛囊皮脂腺的炎症性疾病。有研究[16]表明,免疫功能的失衡很大可能与寻常痤疮向重度痤疮发展相关,多种细胞因子也参与疾病的发展过程。研究[17-18]发现,IL-1α 作为重要的细胞因子存在于粉刺中,毛囊壁受损导致IL-1α进到真皮层,诱导内皮细胞中的黏附分子的表达,且诱导细胞分泌产生次级因子,与炎症发生发展关系密切。IL-4 是机体免疫调节的重要活性物质。研究[19-21]表明,重度痤疮患者血清IL-4表达较健康人显著上升,提示IL-4 参与了与痤疮疾病发展相关的体液免疫应答反应。
仙方活命饮出自《校注妇人良方》,该方有清热解毒、消肿散结等功效,是“疮疡之圣药,外科之首方”[6]。本研究通过采用加减仙方活命饮和临床常规疗法治疗重度痤疮患者,比较2组的临床疗效和不良反应情况,探究加减仙方活命饮治疗重度痤疮的临床可行性,并分析IL-1α、IL-4细胞因子的表达与加减仙方活命饮疗效的相关性。研究结果显示:治疗1个月后,治疗组的总有效率为90.0%(36/40),对照组为75.0%(30/40);组间比较,治疗组的疗效明显优于对照组,且治疗组对粉刺、丘疹、脓疱、结节或囊肿等各项皮损评分及皮损总积分的改善作用均明显优于对照组,差异均有统计学意义(P<0.05)。提示加减仙方活命饮治疗重度痤疮较常规治疗效果更好。
本研究结果还显示:与正常组相比,2组重度痤疮患者治疗前血清IL-1α 与IL-4 表达水平均明显升高(P<0.05);治疗后,2组患者血清IL-1α及IL-4 水平均较治疗前明显降低(P<0.05),其中,治疗组已基本恢复至正常组水平(P>0.05),而对照组仍均高于正常组水平(P<0.05);组间比较,治疗组对血清IL-1α 及IL-4 水平的降低作用均明显优于对照组,差异均有统计学意义(P<0.05)。提示重度痤疮患者血清中的IL-1α 及IL-4 表达较健康体检者明显上调,加减仙方活命饮以及常规治疗方法均可下调二者的表达水平,且加减仙方活命饮下调血清IL-1α 及IL-4 表达水平至正常状态的效果优于常规治疗。同时,2组患者出现不良反应的概率均较低,组间比较,差异无统计学意义(P>0.05),说明加减仙方活命饮治疗重度痤疮安全可靠。
相关性分析结果显示:加减仙方活命饮治疗重度痤疮患者1个月后患者血清中IL-1α、IL-4的相对表达水平与治疗后患者症状积分减少率呈负相关,即采用加减仙方活命饮治疗重度痤疮患者1 个月后患者血清中IL-1α以及IL-4的相对表达水平越高,临床疗效越差。提示患者血清IL-1α、IL-4 的变化趋势可用于临床预后评估,重度痤疮的发展与IL-1α 和IL-4 表达失衡相关,加减仙方活命饮在一定程度上能通过调节细胞因子水平,使其恢复至稳态,进而达到治疗痤疮的目的。
综上所述,加减仙方活命饮治疗重度痤疮疗效显著,安全性高;采用加减仙方活命饮治疗重度痤疮患者1个月后,患者血清IL-1α和IL-4的相对的表达与临床疗效呈负相关,提示本方治疗重度痤疮的机制与调节患者血清中失调的IL-1α、IL-4 相关。本研究仍存在一定不足,如样本量不足以及未对加减仙方活命饮用量进行探究等,后续研究可在此基础上做相应改进。

