报废锂电池高效便捷放电液对比研究
肖 顺,庄绪宁,马 恩
(上海第二工业大学a.资源与环境工程学院;b.上海电子废弃物资源化协同创新中心,上海 201209)
0 引言
随着“双碳”目标的确立,我国的经济发展将越来越注重使用低碳清洁能源。在政策引导下,新能源汽车产业迅速发展,市场渗透率(新能源车占所有类型车比例)持续攀升。2019年,以电动汽车为代表的新能源车销量达124.2万辆,市场渗透率4.7%[1-2]。2020年,我国新能源汽车销量达到136.7万辆[3]。2021年1~11月,新能源汽车年累计产量突破300万辆,市场渗透率达到12.7%[4]。这些新能源汽车搭载的动力电池在数年后将进入报废期。预计到2023年,动力锂电池的报废量将达到101 GW·h,累计报废量将达到116万t[5]。由于报废锂电池有大量残余电量,在综合回收过程中如拆解、破碎处理,极易引发火灾、爆炸等安全事故[3]。所以,处理报废锂电池的第一步通常是对电池进行安全放电。
近年来,科研人员对报废锂电池中稀贵金属资源化的方法进行了大量研究[6-7]。但是对电池的放电过程研究较少,大部分研究采取的是NaCl溶液浸泡方法,这与当前企业大规模回收时采用的方法一致。虽然NaCl溶液具有导电性和较大的比热容,可以对电池进行放电,并且避免热量积聚而导致起火。但放电过程中电池阳极会被NaCl溶液强烈腐蚀[8],从而导致电解液和重金属的大量释放[9]。电解液与水接触还会生成氟化氢(HF)气体[10],造成严重的二次污染,危害放电操作人员的健康。如何在高效放电的同时降低环境污染风险一直是科研人员关注的焦点。
针对以上问题,Lu等[11]将电池分别浸泡在质量浓度为1%、5%、10%的NaCl溶液中进行放电,其充电状态约为60%,电压约为3.85 V,发现在10%的NaCl溶液中电池的电压在7 min内迅速下降,说明NaCl溶液具有较高的放电效率。关于环境友好性方面,Li等[12]将电池浸泡在NaCl溶液中彻底放电,之后使用电感耦合等离子光谱发生仪(ICP)测量放电溶液中的金属浓度。实验结果表明,残留溶液中的Fe和Al的含量很高,正极材料中的Ni、Li、Mn含量也处于超标水平。说明利用NaCl溶液放电会造成重金属的释放,为后续的水处理增加了成本。为了寻找更加绿色且高效的放电液,Shaw-Stewart等[13]制备了26种电解质溶液,浓度均为5%,溶质的纯度均在95%以上,对电池进行放电研究。实验结果表明,不同的盐溶液均具有导电性,具备放电效果。但是,达到快速放电还是依赖于电池外壳的破损,而破损必然带来污染物释放。因此,NaCl溶液放电过程中尽量减小电池外壳破损的程度,可以在快速放电的同时最大限度减少污染物的释放。Xiao等[14]选用NaCl、NaNO3、MnSO4等溶液作为放电液,在综合考察放电效率和污染物释放情况后认为:采用MnSO4溶液作为放电液时,溶液中的O2-与Mn2+在阳极形成一种竞争关系,导致阳极表面形成一层不影响放电的保护膜,从而在不腐蚀阳极的情况下实现清洁放电。但是,经过实验验证后发现,MnSO4溶液会在电池阴极析出大量金属,当放电进行一定时间后,会阻碍电池进一步放电,电池难以达到安全破碎电压。
本文选用18650型锂电池作为研究对象,考察不同阴离子溶液(NaCl、NaOH、Na2SO4、Na2CO3溶液)对电池放电效率、重金属释放情况、氟离子释放及截留能力、放电液循环利用的影响,寻找适合工业化应用的高效、清洁、污染可控的锂电池放电液。
1 实验部分
1.1 实验材料
实验中使用的18650型锂电池从市场购买,初始电压均为3.970 V。使用的NaCl、NaOH、Na2SO4、Na2CO3采购于国药集团化学试剂有限公司,纯度等级为AR。
1.2 实验过程
配置1 mol/L的NaCl、NaOH、Na2SO4、Na2CO3放电溶液400 mL,用浸泡法释放电池中的电量。通过数字伏安计测量溶液中电池的剩余电压。当电压下降到1 V以下(剩余电量25%以下)时视为达到安全电压。每份溶液循环放电5次,观察阳极和阴极在溶液中的腐蚀情况。过滤剩余溶液,烘干沉淀物,并对沉淀物和溶液进行分析测试,得到溶液中的重金属浓度和固体残渣中重金属元素的质量。最后,观察不同溶液对阳极的腐蚀情况。
1.3 分析测试方法
采用ICP对溶液和沉淀物进行金属元素含量,使用上海三信仪表厂生产的WS200型pH/COND/氟离子浓度计测量溶液中的氟离子浓度。放完电的锂电池使用岛津SMX-225CT得到腐蚀情况的照片。岛津SMX-225CT采用了岛津公司生产的微焦点X射线发生器与高灵敏度X射线检测器如图1(a)所示,是高性能的微焦点X射线CT系统。用户界面更直观,可以很容易地对样品的内部结构进行三维观察。宽大的CT载物台,可以实现更大型样品检查。工作原理如图1(b)所示,检测目标(样品)放置在X射线发生器与X射线检测器之间。使其360°旋转,从各角度收集X射线透射数据,计算出断面图像(CT图像)。

图1 岛津SMX-225CT示意图(a)及系统结构和工作原理(b)Fig.1 Schematic diagram of InspeXio SMX-225CT(a)and system structure and operating principle(b)
剩余电量Rc(t)与时间(t)关系为:

2 结果与讨论
2.1 不同类型放电液放电效率对比研究
将单支锂电池分别浸泡于400 mL浓度为1 mol/L的NaCl、NaOH、Na2SO4、Na2CO3溶液中进行放电处理。放电时间与剩余电量的关系如图2所示。
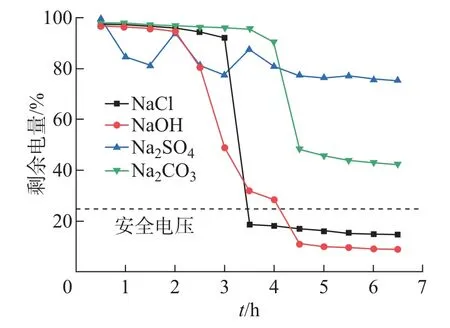
图2 不同种类溶液浸泡下电池浸泡时间和剩余电量之间的关系Fig.2 The relationship between soaking time and residual electricity of batteries soaked in different kinds of solutions
可以看出:
(1)电池在NaCl溶液中首先经历3 h左右缓慢放电过程,之后30 min内,电压迅速降低至安全电压(剩余电量25%以下),并保持不变。这与文献中的放电规律相似[11]。通过观察可以发现,放电后阳极外壳被完全腐蚀消失,内部电芯裸露,这是导致电池电量迅速下降的直接原因。
(2)电池在NaOH溶液中经历2 h缓慢放电后,电压开始迅速下降,之后在2 h内电池电压降低至安全电压。可见电池在NaOH溶液中比在NaCl溶液中更早出现结构破损,导致电压迅速降低。但可能由于破裂程度较低,电量释放稍慢于NaCl溶液。
(3)电池在Na2CO3溶液中需要经过4 h以上才会出现迅速放电现象。但是在剩余电量达到50%后,放电效率再次放缓且难以达到安全电压。可见,Na2CO3溶液对电池外壳腐蚀性较低,导致电池破损较小,因此难以实现高速放电。
(4)电池在Na2SO4溶液中始终保持低速放电状态,剩余电量维持在80%以上。可见Na2SO4溶液对电池外壳的腐蚀能力最弱,难以对电池外壳造成破坏。因此,Na2SO4溶液也不能实现高效放电。
基于以上研究可以得出,NaCl溶液和NaOH溶液均可以实现电池高效放电,而Na2CO3与Na2SO4溶液难以满足高效放电的需求。此外,通过观察发现NaCl溶液水质浑浊发黑,生成大量悬浮物和沉淀物如图3(a)所示,根据文献[15-16]推断为Fe和Al的氧化物;NaOH溶液在放电后溶液澄清,无肉眼可见杂质如图3(b)所示。将两种溶液过滤烘干、称重后得到NaCl溶液中悬浮物和沉淀物的质量为6.23 g,NaOH溶液中无沉淀物。观察放电后的电池发现NaCl溶液浸泡后,阳极几乎全部腐蚀消失,内部电极片裸露如图3(c)所示;NaOH溶液浸泡后,电池表面无法观察到明显破损。通过面积法得出NaCl溶液放电后阳极腐蚀面积达98%,NaOH溶液放电后电池阳极无腐蚀。在放电效率均能满足需求的情况下,NaOH溶液比NaCl释放溶液污染物更少、更可控,有必要继续对比研究放电液NaCl溶液和NaOH溶液的污染物释放情况和放电机理。

图3 (a)放电后的NaCl溶液;(b)放电后的NaOH溶液;(c)NaCl溶液放电后的电池阳极;(d)NaOH溶液放电后的电池阳极Fig.3 (a)NaCl solution after discharge,(b)NaOH solution after discharge,(c)anode of battery after discharging in NaCl solution,(d)anode of battery after discharge of NaOH solution
2.2 溶液浸泡放电过程中污染物的释放
2.2.1 放电过程金属元素的释放
在放电过程中,电池阳极外壳在放电溶液的电化学腐蚀下会发生分解。同时,电池内部的阳极活性物质也可能由于溶液的侵蚀而向溶液中释放金属离子。分别对单支电池在400 mL NaCl溶液和NaOH溶液1次浸泡放电后的溶液和固体残渣(过滤后的悬浮物和沉淀物)中的金属元素进行分析测定,金属元素成分和含量如表1所示。由表可知,NaCl溶液体系中电池释放的金属元素按照含量排序依次为Fe、Al、Li、Ni、Mn,且大部分金属元素集中在固体残渣中,尤其是重金属Fe的含量接近于NaOH溶液体系中的10倍;NaOH溶液体系浸泡下释放出来的Al与NaCl溶液体系释放出来的Al(溶液与残渣中的Al的总和)相近,可见NaOH溶液主要通过溶解阳极外壳上的Al来实现外壳的破损。对比两种放电液的金属释放量可以发现,以NaCl溶液为放电液,电池释放的总金属元素量(尤其是重金属元素量)远大于NaOH溶液中电池释放的总金属元素量。

表1 不同溶液放电副产物金属成分及含量Tab.1 Metal composition and content of discharge by-products in different solutions
此外,在实验过程中发现,NaCl溶液中大量固体残渣会吸附在电池外壳上,需要反复冲洗才能清理干净。冲洗电池又会产生新的废水,增加二次污染风险和后续处理成本。而NaOH溶液没有沉淀产生,电池取出后较清洁,只需简单冲洗即可进行下一步回收处理。
2.2.2 放电过程氟的释放
电池阳极的损坏会导致电池内的电解液与放电溶液直接接触。电解液中含有大量六氟磷酸锂(LiPF6),遇水会产生大量的HF[17]。为了解不同放电液破坏电池阳极后HF的释放情况,分别将NaCl溶液和NaOH溶液放电过程中产生的气体通入到串联的三级气体吸收瓶中,吸收瓶中装有1 mol/L的NaOH溶液[18]用于吸收两种放电过程所产生的HF气体。NaCl溶液放电所释放的气体串联通入吸收液1、2、3。NaOH溶液放电所释放的气体串联通入吸收液4、5、6。放电结束后测得两种放电溶液中以及三级吸收液中的氟离子浓度如图4所示。
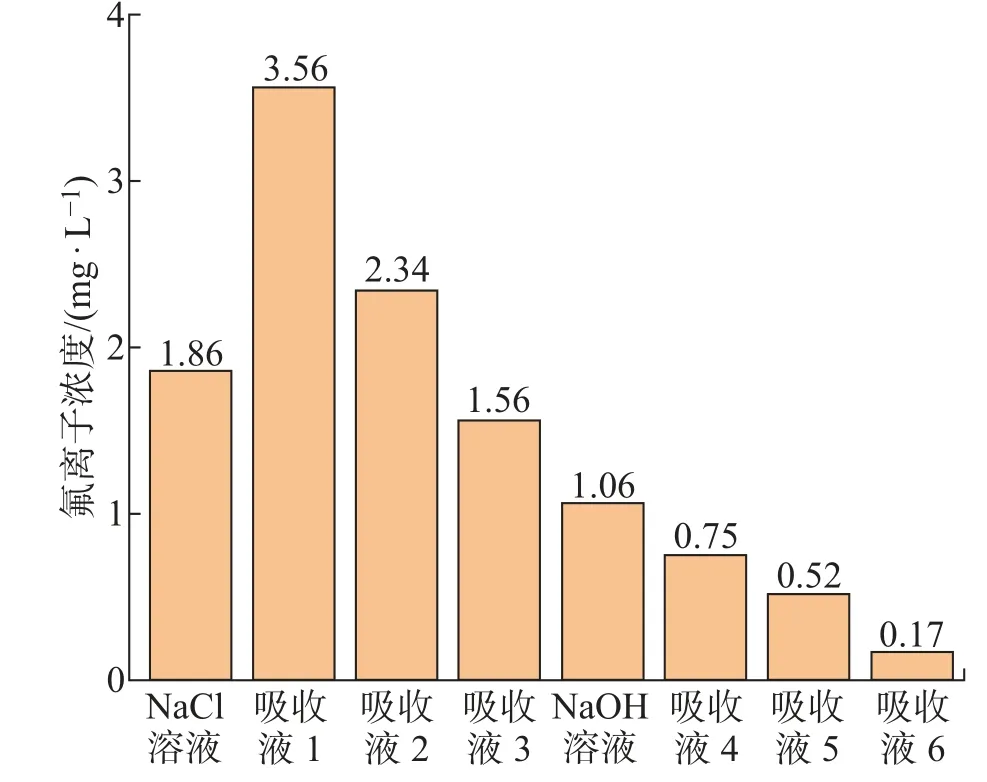
图4 不同溶液中氟离子浓度Fig.4 Fluorine ion concentration in different solutions
从图4中可以发现,NaCl溶液及其吸收液中的氟离子浓度比NaOH溶液及其吸收液中的高,说明NaCl溶液放电相比NaOH溶液放电产生了更多的HF气体。此外,采用NaCl溶液放电后大部分的氟离子被固定于吸收液中,如果单纯用NaCl溶液放电而不对放电释放的气体进行捕集和处理将导致大量HF释放到环境中。采用NaOH溶液放电法大部分氟离子会被放电溶液捕集,吸收液中的氟离子浓度很低。综上说明,NaOH溶液放电向环境释放的HF少,且能较好地固定在放电溶液中,比NaCl溶液放电对环境的污染更小。
2.3 不同溶液放电的原理研究
从两种溶液中金属离子的含量可以看出,NaCl溶液以及固体残渣中Fe含量远大于NaOH溶液中Fe含量,意味着两种溶液对电池外壳的破坏机理不同。由于NaOH溶液放电后电池外观没有明显变化,难以肉眼识别其破坏机理的不同。因此,通过工业CT对放电后的电池进行三维立体成像分析,结果如图5所示。由图5(a)和(b)可见,NaCl溶液浸泡后的电池正极被完全腐蚀,内部卷状电极片裸露;由图5(c)和(d)可见,NaOH浸泡后的电池正极钢制外壳看上去十分完整,但外壳下方连接极片的铝制薄膜消失了。铝制薄膜是连接电池正极集流体和外壳的一层极薄的封闭结构,起到导电和封闭电池的作用。可以分析得出,与NaCl溶液通过Cl的电化学腐蚀不同,NaOH溶液放电是利用Al作为两性金属在NaOH溶液中具有很高的溶解性来达到破坏电池密封性的目的,从而实现快速放电。

图5 (a)NaCl溶液浸泡后电池CT照片;(b)NaCl溶液浸泡后电池结构三维建模;(c)NaOH溶液浸泡后电池CT照片;(d)NaOH溶液浸泡后电池结构三维建模Fig.5 (a)CT photo of battery after soaking in NaCl solution,(b)three-dimensional modeling of battery structure after soaking in NaCl solution,(c)CT photo of battery after soaking in NaOH solution,(d)three-dimensional modeling of battery structure after soaking in NaOH solution
两种溶液电池腐蚀化学反应过程如下所示:
NaCl溶液中的沉淀反应

NaOH溶液中的溶解反应

2.4 放电溶液重复利用性能
为了探究NaCl和NaOH溶液在经历多次放电后放电效率的变化情况,用1mol/L的NaCl和NaOH溶液分别对电池完成5次放电。放电时间和剩余电量的关系如图6所示,在5次放电过程中,NaCl溶液和NaOH溶液放电时间均在3~4 h内,变化并不明显,可以看出两种溶液的重复利用性均很高。

图6 NaCl溶液(左)和NaOH溶液(右)放电5次剩余电量和时间之间的关系Fig.6 The relationship between residual electricity and time for five discharges of NaCl solution(left)and NaOH solution(right)
3 结 论
(1)研究表明电池溶液浸泡快速放电过程主要分为两个阶段:第1阶段为电解水缓慢放电阶段;第2阶段为正极腐蚀泄露后迅速放电阶段。
(2)NaCl放电液释放的主要污染物为Fe、Al、Li、Ni、Mn和HF,来源于电池外壳和内部结构电化学腐蚀和电解液与水的反应。其中大部分Fe和Al生成固体残渣,而HF排放到空气中会对环境造成危害。
(3)NaOH放电液放电效率与NaCl放电液相近,放电过程中释放少量Fe、Al、Li、Mn并全部保存在溶液中,减少了电池放电后的清洗和放电液的过滤。NaOH放电液相比NaCl放电液释放的HF更少且大部分被放电液固定,环境风险更小。在保证放电设施安全可靠的情况下,用NaOH溶液放电更加高效便捷,工业应用潜力大。

