活性炭负载碳酸锰协同紫外光降解甲苯的研究
袁 昊,杨 康,周 铜,彭 贺
(上海第二工业大学 资源与环境工程学院,上海 201209)
0 引言
挥发性有机物(volatile organic compounds,VOCs)在工业和交通业生产排放中广泛存在,是臭氧(O3)、二次有机气溶胶(secondary organic aerosol,SOA)和过氧乙酰硝酸酯(PAN)等光化学污染物的重要前体物质,对大气环境治理带来很大的困难[1]。VOCs不仅破坏大气环境,还会对人体健康造成许多严重影响,目前已被我国列入大气污染主要治理因子[2-3]。紫外光降解挥发性有机废气是本世纪快速发展起来的工业废气治理工艺,在实际工程应用中,挥发性有机废气成分复杂,浓度变化幅度较大,单纯依靠紫外光降解VOCs效果并不理想,并且还有高于相关排放浓度要求的副产物O3的产生[4]。袁昊等[5]发现185 nm紫外光照射下,停留时间达13 s,甲苯的去除效率仅达70%。王灿等[6]使用185 nm和254 nm复合波段紫外光降解高浓度氯苯废气,停留时间为27 s时,氯苯去除率仅达40%。因此,在工业需求的驱动下,许多学者潜心钻研以求制备高效催化剂,协同紫外光催化降解VOCs,取得了比较理想的效果[7-8]。紫外光催化剂主要有两种,一种是贵金属类催化剂,Ye等[9]原位合成了具有多孔层次的Pt/MnO2纳米片装饰的三维泡沫炭(Pt/MnO2-cf)用于甲醛的室温催化氧化,表现出良好的催化活性。另一种是非贵金属催化剂,Zhang等[10]系统研究了氟(F)掺杂在纳米二氧化钛(TiO2)降解甲苯光催化活性中的特殊作用,可将体系中残留的O3完全消除,甲苯降解效率可提高至96%。戴津星等[11]研究了紫外光催化降解下TiO2薄膜对气态偏二甲肼的效果以及光源种类和废气初始浓度的影响。Yang等[12]讨论了MnO2基复合材料的设计和制备方法,指出催化剂在环境净化系统中可用于去除重金属、染料和某些吸附剂材料,以及可当做用于降解污染物的热催化剂、光催化剂和电催化剂。Liu等[13]以MnCO3为前驱体,制备高效稳定的MnO2催化剂,用于湿流中气态O3的分解,可实现紫外反应产生O3的降解,O3的分解活性较好,达到63%的去除效率。贵金属催化剂虽然在某类污染物催化过程中展现出优异的性能,但对成分复杂的有机废气普适性较差,处理含卤素的有机废气易中毒,且应用成本相对较高。相比非贵金属催化剂效果稍有差距,但原材料获取途径广泛,能满足工业应用需求,其较低的成本是走向市场的巨大优势。
结构设计合理,反应高效的反应器对光催化反应系统工作来说至关重要,尤其是对系统内部传质和光催化降解过程影响较大。设计不规则或结构不合理的光反应器易发生死区和紊流,导致紫外光分布不均匀。通过数值模拟可确定催化剂摆放位置最大化光能的利用效率,也可模拟反应过程对实验进行预判,节约人力物力[14]。Liu等[13]根据计算流体动力学(computational fluid dynamics,CFD)数值仿真技术对反应器流场与光场进行模拟并做出设计优化,验证了光催化降解多组分VOCs的可靠性。为探究流体在光反应器内部流动的轨迹和光的分布,进行流体质点运动轨迹与紫外灯辐射的数值模拟。
本文以锰系氧化物为基础材料进行研究,在保证良好催化性能的前提下,制得的催化剂不仅大大降低了催化剂的成本,还能有效消除紫外降解VOCs过程中主要的副产物O3。重点探究了MnCO3/UV、TiO2/UV、MnCO3/AC/UV和紫外光降解4种不同工艺降解VOCs的效果。通过X射线衍射仪(XRD)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)、X射线电子能谱(XPS)对催化剂进行了详细的表征,并使用CFD仿真软件对光反应器进行数值模拟。在全球节能减碳的需求下,紫外光催化降解VOCs以低耗能高效率的明显优势指出了未来的挥发性有机废气治理方向。
1 实验材料与方法
1.1 催化剂制备
5 g活性炭(AC)浸没于200 mL NaOH溶液(1 mol/L)12 h,去离子水冲洗5遍后浸入200 mL HNO3溶液(1 mol/L)中水浴加热2 h,去离子水冲洗5次除杂质,干燥后研磨至40~60目(380~250µm),密封保存。取5 g MnCO3粉末烘箱中恒温(105℃)12 h。将干燥后的MnCO3粉末放入台式马弗炉中,升温速率5℃/min,升温至350℃恒温焙烧300 min,冷却后研磨成40~60目粉末备用。随后将上述制备好的MnCO3粉末与AC混合溶于130 mL蒸馏水(乙醇对比实验)中,超声30 min后放置恒温水浴摇床,在90℃下150 r/min反应10 h,冷却后进行抽滤清洗5次,然后在105℃下干燥12 h得到催化剂MnOx/AC。纳米TiO2为商用,研磨至40~60目使用(380~250µm)。本文所用到的实验药品和实验仪器明细表分别如表1、表2所示。

表1 实验药品明细表Tab.1 List of experimental drugs

表2 实验仪器明细表Tab.2 List of experimental instruments
1.2 催化剂表征
为探究所制得的催化剂组成及比例的区别,本文使用德国布鲁克XRD(Bruker D8 Advance)对催化剂进行XRD分析,电压设定40 kV,电流选择40 mA,扫描角度选择为8°,扫描步长为0.02°,扫描速度为10°/min。采用日本Hitachi公司的S-4800 SEM对催化剂进行表征,同时利用能谱仪(EDS)对催化剂表面元素进行表征。使用Agilent 7890B型号的GC-MS对甲苯废气及中间产物进行测定。
1.3 光反应器设计与仿真
在仿真过程中,反应体系中只针对空气这一相,采用单相流进行模拟,且假定系统内部无热传导现象,根据本文研究需求,选用DO模型。光反应设备直径110 mm,高200 mm,有效体积约为1.850 mL。石英管内外径15 mm,内径13 mm。使用Mesh软件对网格进行划分,数量划分为152 782个。
1.4 催化氧化性能测试
为实现可控实验条件,本文设计光反应系统图如图1所示。左侧为配气系统,提供不同载气和洗气装置搭配方案,实现满足光反应器不同进气;右侧为光反应器部分,进气由两侧进气空孔进入腔体反应,而后由中间石英管经过催化剂作用后排出。本文探究了废气初始浓度为0.01~0.07µg/kg,60 RH%(±2%),废气流量为3.2 L/min,紫外灯的总功率为20 W,投加1 g不同催化剂时不同工艺下降解甲苯的效率。

图1 光反应系统图Fig.1 Diagram of photo reaction system
2 表征与结果
2.1 催化剂的形貌分析
在MnCO3/AC材料中,AC主要起到增大MnCO3与紫外光和甲苯的接触面积和提升对甲苯的吸附能力[15]。本文对比了MnCO3与AC粉末超声后置于蒸馏水和乙醇中混合反应时的不同,催化剂的SEM如图2所示。
图2(a)、(b)分别为MnCO3与AC粉末混合溶解在去离子水以及溶解在乙醇中10 h后经干燥制得的催化剂。图2(c)、(d)分别为图2(a)、(b)两种催化剂使用10 h后的SEM。图2(e)为MnCO3与AC粉末溶解在去离子水中10 h所制得催化剂的EDS图。由图2(a)~(d)可观察到,AC表面附着的催化剂为不规则球状,粒度范围为0.5~3µm。对比图2(a)、(b)可以发现,置于去离子水中的催化剂相比于置于乙醇中的催化剂MnCO3附着效果更好。分别对比图2(a)、(c)与图2(b)、(d),可以看出催化剂的附着量有所减小,在使用过程中存在一定程度的损耗。结合图3中GC-MS结果分析损耗原因,可能是催化反应过程中产生了酸性物质与催化剂发生了反应。由图2(e)观察到O元素与Mn元素质量比不符合MnCO3中比例,因此催化剂中还含有其他Mn的氧化物。

图2 不同催化剂的SEMFig.2 SEMof different catalysts

图3 不同比例MnCO3/AC XRD分析Fig.3 XRD analysis of different proportions of MnCO3/AC
2.2 MnCO3/AC催化剂的XRD分析
对不同质量掺杂比以及使用过的催化剂进行XRD分析,从图3可以看出,本催化剂为六方晶系,与MnCO3(PDF#44-1472)三方晶系菱面体对应,晶格参数为:a=0.477 nm,b=0.477 nm,c=0.156 42 nm。在37.5°、42°、60.3°和60.4°处也属于MnO2的特征吸收峰。邹飞等[16]研究了MnCO3在400~800℃、不同气氛中高温的产物变化,发现在空气中焙烧产物主要为MnO2和Mn2O3,且不同气氛条件下焙烧后获得的不同产物与MnCO3相似,锰化合物的化合价涉及+2价,+8/3价,+3价和+4价。张平等[17]热解MnCO3,310~330℃范围内过程产物MnO被氧化为Mn2O3,在350~450℃范围内,过程产物MnO反应生成MnO2,450℃下热解产物中四价锰占比最高。450~490℃范围内MnO2受热转化为Mn2O3。MnCO3受热易分解,产物受温度影响较大且多样[13,18]。本文催化剂焙烧温度为300℃,推断催化剂中主要活性物质为MnCO3/MnOx。
催化剂复合比例为0.3:1时,主峰宽且杂峰多,说明催化剂晶型成长还不够成熟,晶粒也较小;复合比例为0.5:1时杂峰已相对0.3:1时较少;复合比例为0.75:1时,衍射峰强度较大;当复合比例为1:1时,衍射峰强度变化不明显。结合不同催化剂实验结果,本催化剂复合比例为0.75:1时效果最佳,说明此时催化剂晶型最佳。
MnCO3/AC催化剂使用一段时间后,峰强明显变弱,说明催化剂协同剂紫外光降解甲苯分子时可能存在部分的分解,这与SEM表征结果一致。结合产物分析,导致催化剂损耗的主要原因是甲苯在被降解过程中生成了苯甲酸等物质,并与部分催化剂之间发生了化学反应。MnCO3与AC之间黏结性差也是本催化剂损耗的另一个原因。
2.3 紫外光催化氧化产物分析
对经紫外光催化氧化的废气进行采样,送入GCMS仪器进行分析,结果如图4所示。发现废气中产物除甲苯外还包括CO2、乙酸乙酯、甲酸、乙酸、苯甲醛、苯酚和苯甲醇等中间物质。
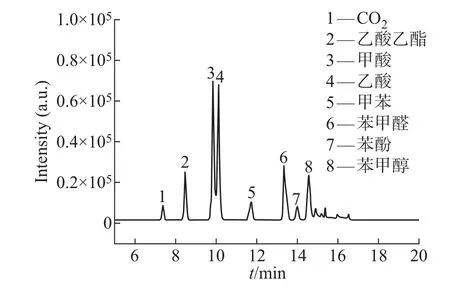
图4 真空紫外-MnCO3/AC降解甲苯产物分析Fig.4 Analysis of toluene degradation products by vacuum UV-MnCO3/AC
2.4 催化剂催化氧化性能对比
经实验验证MnCO3/AC催化剂中MnCO3与AC的掺杂质量比为0.75:1时甲苯降解效果最佳。室温条件下,应用控制变量法,调整光反应系统,模拟废气调节甲苯初始浓度为0.01~0.07µg/kg,60 RH%(±2%),分别将等质量不同催化剂放入光反应器中与紫外耦合协同降解甲苯。由图5可知,随着废气浓度不断升高,4种催化剂对甲苯催化氧化效率均有下降,MnCO3/AC/UV对甲苯的降解性能最好,当废气中甲苯浓度为0.04µg/kg时,甲苯降解效率也能达到95%以上。出口废气经GC-MS测定,发现主要产物包含醛类、酸类和酮类等几种物质。根据产物分析,推断在光催化降解的过程中,良好的湿度条件为反应提供了大量的·OH,同时MnCO3与O3作用提供了一定量的·O,加之甲苯在高能紫外光子轰击下,首先断裂甲基上的C—H键,·OH和·O强氧化作用使中间产物生成苯甲醇、苯甲醛,进一步氧化生成苯甲酸,高能·OH使苯环断裂,生成短链的醛类、醇类、酸类,经进一步氧化生成CO2和H2O[19-20],具体过程如图6所示。
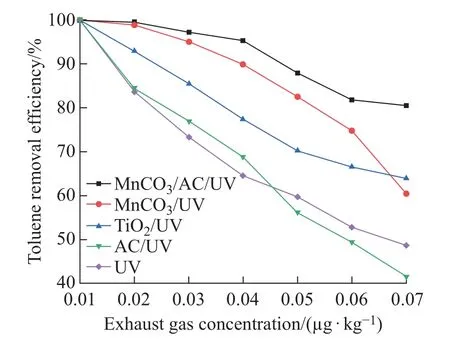
图5 不同催化剂催化氧化性能对比图Fig.5 Comparison of catalytic oxidation performance of different catalysts

图6 紫外光催化反应机理图Fig.6 Mechanism diagram of UV catalytic reaction
本催化剂相比于其他已研制出的紫外光催化剂,具有制作方法简单、降解效率高等优点(见表3)。
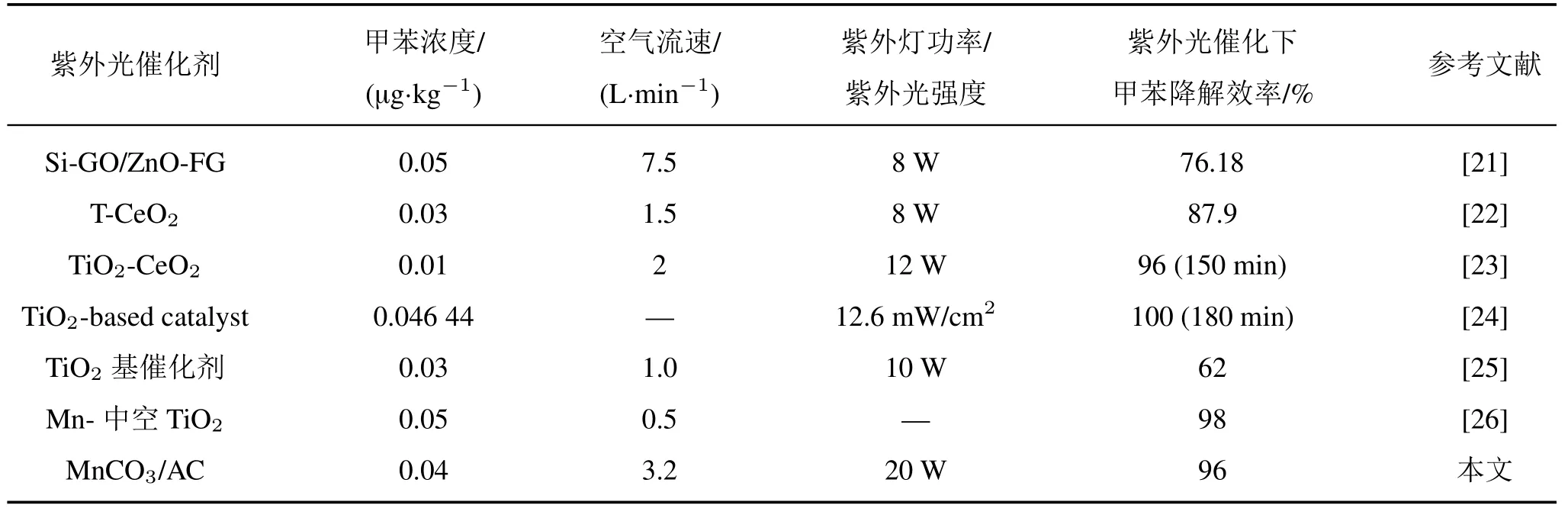
表3 不同紫外光催化剂降解效率对照表Tab.3 Comparison of degradation efficiency of different UV catalysts
2.5 仿真结果
对光反应器腔体内气体运动情况进行模拟分析,并采用粒子追踪模型模拟污染因子的运动轨迹。由图7可以看出,气体进入反应器入口时速度较大,约为1.5 m/s,完全进入光反应器内部后速度约为0.2 m/s,保证了污染物在墙体内的停留时间,紫外光高效作用于甲苯分子及其他中间产物,提升降解效率。污染物粒子在反应器内运动几乎无死角,污染因子穿过两个灯管中间,从石英管通道与催化剂进行进一步接触后排出反应装置。表明光反应器设计合理且能实现利用紫外光协同催化剂降解VOCs,实现紫外光能量的充分利用。

图7 光反应器CFD仿真模拟图Fig.7 CFD simulation diagram of photoreactor
3 结 论
(1)MnCO3、TiO2、MnCO3/AC 3种催化剂与紫外光协同降解甲苯催化效果最好的是MnCO3/AC,并且MnCO3与AC掺杂效果最好的质量比为0.75:1。
(2)置于去离子水中恒温制备的催化剂相比于置于乙醇中恒温制备的催化剂AC基表面MnCO3的附着效果更好。
(3)在甲苯降解过程中,催化剂有一定程度的损耗,导致催化剂损耗的主要原因是甲苯在降解过程中产生了酸性物质与MnCO3等化合物之间发生了反应。
(4)根据产物分析,推断在紫外光协同催化剂对甲苯作用的过程中,MnCO3催化O3提供了一定量的·O,甲苯受高能紫外光子轰击,首先断裂甲基上的C—H键,在·O与·OH强氧化作用下生成中间产物苯甲醇、苯甲醛和苯甲酸,·OH高能作用导致苯环断开,生成短链的醇类、醛类、酸类,最终氧化生成CO2和H2O。
本文制得的MnCO3/AC光催化剂虽然性能显著,在工业上也得到了广泛应用,但也存在一些缺陷,主要包括紫外光利用率仍有待提高和催化剂在重复使用过程中存在MnCO3损耗现象,在今后研究中这两个方面将会成为解决本催化剂更大范围应用的重要方向。

