FOXM1在高糖诱导的MRC-5细胞胶原合成中的作用
赵盛男,张振旺,尧 青,刘 超
(湖北科技学院 1. 医学部药学院、2. 糖尿病心脑血管病变湖北省重点实验室、3.医学部医药研究院,湖北 咸宁 437100)
糖尿病肺纤维化严重损害患者身心健康,但目前尚无行之有效的治疗,因此,明确其分子机制有重要意义。多项研究表明[1-3],患者长期处于高糖状态会活化成纤维细胞和肌成纤维细胞,增加胶原分泌,而促进胶原降解的基质金属蛋白酶活性降低、其酶抑制剂表达上调,导致胶原降解减少,最终形成胶原合成增加和沉积,致使肺纤维化的产生[4-5]。而纤维化产生的信号主要是通过 TGF-β/Smads通路传导的,在刺激作用下,TGF-β1蛋白表达增加,Ⅰ、Ⅱ型跨膜丝氨酸/苏氨酸激酶受体活化,促进Smad2和Smad3蛋白磷酸化,并与Smad4蛋白形成活性复合体,进入细胞核,上调胶原等纤维化相关基因的表达,从而促进纤维化的形成[6-7]。由此可见,胶原合成增加是糖尿病肺纤维化的基础,明确高糖诱导胶原合成的分子机制能够为糖尿病肺纤维化提供新的治疗方向。
Fox蛋白家族是真核生物中广泛存在的一类转录因子,主要与糖脂代谢、胚胎发育、细胞周期调节等功能有关,其家族中的FOXM1在TGF-β/Smads通路的信号传导中有重要的调节作用。研究表明[8-10],FOXM1以剂量依赖的方式抑制TIF1γ对Smad4的泛素化作用,促进Smad4的稳定,并且诱导Smad3磷酸化,维持P-Smad3/Smad4复合物的形成,驱动并加强TGF-β/Smads信号通路的传导,从而促进胶原合成,减少胶原降解,加剧纤维化发生。因此,我们推测FOXM1可能是高糖诱导胶原合成及糖尿病肺纤维化发生过程中的一个相关因子。
本文通过高糖刺激MRC-5细胞模拟糖尿病诱导的肺纤维化模型,探讨高糖诱导胶原合成的机制及FOXM1在高糖诱导胶原合成过程中的作用。
1 材料与方法
1.1 材料MRC-5为人胚肺成纤维细胞,MRC-5细胞及其专用MEM培养基均购于武汉普诺赛生命科技有限公司;Glucose、DMSO和Mannitol均购于Sigma公司;Thiostrepton购于MedChemExpress生物科技公司;COL Ⅰ、COL Ⅲ、TGF-β1、α-SMA、Fibronectin、MMP9、TIMP1、FOXM1、P-Smad2、Smad2和α-Tubulin抗体均购于ABclonal公司;HRP标记二抗购于biosharp公司;逆转录试剂盒和qPCR试剂盒均购于ABclonal公司;ECL试剂盒和CCK8试剂盒均购于大连美仑生物技术有限公司;DEPC水购于碧云天生物技术有限公司。
1.2 仪器超净工作台(苏州净化公司);CO2培养箱(Thermo公司);全波段多功能酶标仪(美国Bio-Tek公司);垂直电泳仪、电转移槽和自动发光凝胶成像系统(美国Bio-Rad公司)等。
1.3 方法
1.3.1CCK8检测增殖活性 (1)检测不同时间点高糖对MRC-5细胞增殖活性的影响:选择第3~5代处于对数生长期的MRC-5细胞接种至96孔板,24 h后换无血清培养基饥饿细胞过夜,按预设时间点72、48、24、12、6 h给予30 mmol·L-1葡萄糖培养细胞,每组8个复孔,最后一起给予每孔10 μL CCK8试剂,培养细胞30 min后,在450 nm波长下用酶标仪检测细胞活性。(2)检测不同浓度葡萄糖对MRC-5细胞增殖活性的影响:选择第3~5代处于对数生长期的MRC-5细胞接种至96孔板,24 h后换无血清培养基饥饿细胞过夜,分别给予30 mmol·L-1甘露醇及5.5、15、30、45 mmol·L-1葡萄糖培养细胞,每组8个复孔,24 h后给予每孔10 μL CCK8试剂,培养细胞30 min后,在450 nm波长下用酶标仪检测细胞活性。
1.3.2细胞培养及分组 将第3~5代处于对数生长期的MRC-5细胞于含10% FBS、1%青-链霉素双抗的MEM完全培养基中,于37 ℃、5% CO2培养箱中培养,每2 d换液1次。细胞长满后,传代接种于6孔板中,MEM完全培养基培养细胞至70%~80%时,换无血清培养基饥饿过夜,再给予不同的无血清含药培养基,将细胞分为以下4组:CON组(正常对照)、HM组(30 mmol·L-1甘露醇高渗对照)、HG组(30 mmol·L-1高糖)、HG+TST组(30 mmol·L-1高糖+1 μmol硫链丝菌素)[11],培养细胞24 h后,收细胞用于后续的Western blot和qPCR检测。
1.3.3Western blot法检测胶原合成相关因子的表达水平 细胞给药完成后,提取蛋白样品,BCA法测定蛋白浓度,调整浓度一致后变性,-20 ℃保存;常规Western blot法检测相关蛋白的表达情况:根据蛋白浓度调节上样量至25 μg,10% SDS-PAGE凝胶电泳后,250 mA,160 min转移至PVDF膜,5%脱脂牛奶室温摇床封闭2 h,分别孵育对应的一抗,4 ℃摇床过夜,TBST洗涤4次/10 min,室温摇床孵育相应的HRP标记二抗1 h,TBST洗涤3次/10 min,加入ECL显影液显影成像。
1.3.4qPCR法检测胶原合成相关因子的表达水平 细胞给药完成后,常规TRIzol法提取总RNA,逆转录成cDNA后用荧光定量PCR试剂盒将各组细胞的cDNA进行qPCR反应,具体引物信息见Tab 1,以GAPDH作内参,最终以2-ΔΔCt计算胶原合成相关目的基因的mRNA表达水平变化。
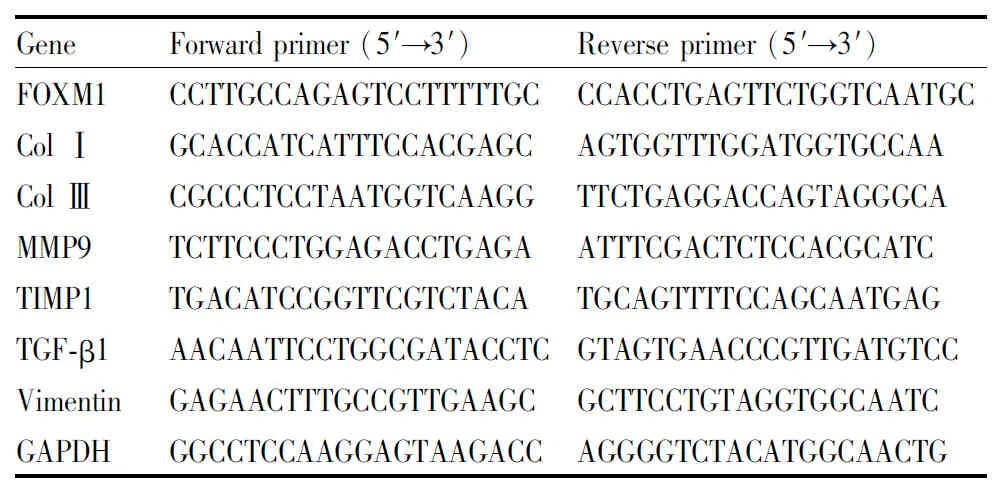
Tab 1 Primers involved in Real-time quantitative PCR
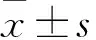
2 结果
2.1 MRC-5细胞高糖模型建立高糖(30 mmol·L-1)诱导培养MRC-5细胞,在不同时间检测细胞活性。结果如Fig 1A所示:高糖诱导培养MRC-5细胞24、48、72 h时,与CON组比,细胞增殖活性明显下降,差异有统计学意义(P<0.05),因此选择24 h作为高糖作用时间;由于培养基中葡萄糖浓度高于正常的5.5 mmol·L-1时,细胞会相应的出现渗透压改变,达到一定程度时对细胞活性有影响,因此在设置不同浓度梯度的葡萄糖诱导MRC-5细胞时,多设置了一个高渗对照HM组,结果如Fig 1B所示:与CON组比,HG的高渗对照HM组细胞增殖活性无显著变化(P>0.05),而葡萄糖浓度在30和45 mmol·L-1时,细胞活性较CON和HM组均有明显下降,且差异有统计学意义(P<0.05)。因此,选择高糖诱导模型建立的条件是30 mmol·L-1培养细胞24 h。

Fig 1 MRC-5 cell activities at different time points and different glucose concentrations detected by n=8)A: The MRC-5 cell activities in different time gradients cultured by high glucose. B: The MRC-5 cell activities in different glucose concentrations or 30 mmol·L-1 mannitol after 24 h. *P<0.05, **P<0.01 vs CON; △P<0.05 vs HM
2.2 高糖促进MRC-5胶原合成高糖(30 mmol·L-1)诱导培养MRC-5细胞,通过Western blot和PCR检测胶原合成相关因子的表达,结果如Fig 2所示:与CON相比,HG的高渗对照HM组对胶原合成相关因子的表达水平没有影响;HG能促进COL Ⅰ、COL Ⅲ、Fn、α-SMA、TGF-β1、P-Smad2和TIMP1的蛋白和mRNA表达,且降低MMP9的蛋白和mRNA表达,导致MMP9/TIMP1比值较CON组降低。
Fig 2 Collagen synthesis in MRC-5 cells induced by high glucose detected by Western blot and n=3)A-D: Western blot band graphs and corresponding results statistics of COL Ⅰ, COL Ⅲ, TGF-β1, P-Smad2, MMP9, TIMP1 and Fn, α-SMA; E-H:Col Ⅰ, Col Ⅲ, TGF-β1, MMP9, TIMP1 and Vim statistical graphs of qPCR results. *P<0.05 vs CON.
2.3 FOXM1在高糖诱导MRC-5细胞中高表达高糖(30 mmol·L-1)诱导培养MRC-5细胞,通过Western blot和PCR检测FOXM1的表达,结果如Fig 3所示,FOXM1蛋白在HG组的表达远较CON组高,其mRNA水平也有升高,而HG的高渗对照HM组与CON组相比没有明显差别。

Fig 3 The expression level of FOXM1 in MRC-5 cells induced by high glucose detected by Western blot and n=3)A: Western blot band and statistical diagram of FOXM1; B: FOXM1 qPCR statistical diagram. *P<0.05 vs CON.
2.4 抑制FOXM1降低高糖诱导MRC-5细胞胶原合成通过Western blot和qPCR检测各组胶原合成相关因子的表达,结果如Fig 4所示:与CON组相比,HG促进FOXM1的表达,但给予FOXM1抑制剂TST(HG+TST)干预后,FOXM1表达明显比单纯HG组减少(Fig 4A,F);同时,TST抑制了高糖对MRC-5胶原合成相关因子如COL Ⅰ、COL Ⅲ、TGF-β1、TIMP1和Fn、α-SMA的蛋白和mRNA诱导作用(Fig 4B-E;Fig 4G-I),TST还促进HG刺激后MMP9蛋白和mRNA的表达,导致MMP9/TIMP1比值较HG组增加;HG的高渗对照HM组对MRC-5胶原合成相关因子的蛋白及mRNA表达水平与CON组比差异无统计学意义(P>0.05)。
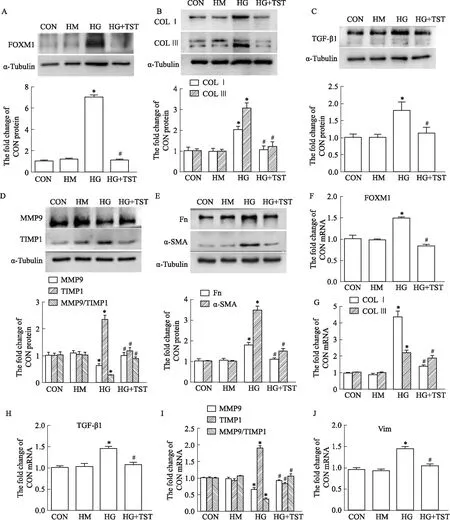
Fig 4 Expression of FOXM1 and collagen synthesis in MRC-5 cells induced by high glucose by Western blot and n=3)A: FOXM1 Western blot strip diagram and statistical diagram; B-E: COL Ⅰ, COL Ⅲ, TGF-β1, P-Smad2, MMP9, TIMP1 and Fn , α-SMA Western blot strip diagrams and corresponding results statistics; F: FOXM1 statistical graph of qPCR result; G-I: Col Ⅰ, Col Ⅲ, TGF-β1, MMP9, TIMP1 and Vim′s qPCR statistical graphs. *P<0.05 vs CON; #P<0.05 vs HG.
3 讨论
糖尿病患者长期处于高糖状态会加速胶原等细胞外基质的合成,诱导上皮间质转化,促进纤维化的发生发展,而纤维化的激素治疗会影响糖代谢甚至引起糖代谢紊乱,加重糖尿病的发展,说明高糖与纤维化相互影响[12-13]。纤维化的发生往往是细胞外基质如胶原等合成增多所致,主要由TGF-β/Smads信号通路调节,在这个传导过程中,FOXM1具有重要的调节作用[14-15],且被证实参与心肌胶原合成及其纤维化的发生发展[16],但其在糖尿病肺纤维化中的作用还未见报道,因此本研究通过高糖培养MRC-5细胞模拟高糖诱导肺纤维化的过程,在细胞水平上探讨高糖对肺细胞胶原合成的影响及FOXM1在其中的作用。
本研究显示,30 mmol·L-1高糖诱导培养MRC-5细胞24 h时,细胞活性与CON组相比明显下降,而HG的高渗对照HM组与CON组相比则无显著变化,可见HG组细胞增殖活性的下降不是由其高渗透压引起的,而是葡萄糖的作用所致,HG模型可靠。高糖促进MRC-5细胞中胶原合成和TGF-β/Smads信号通路相关因子COL Ⅰ、COL Ⅲ、Fn、α-SMA、TGF-β1、p-Smad2和TIMP1的蛋白和mRNA表达,却降低了降解胶原的MMP9蛋白及mRNA表达,而高渗对照HM组对上述相关因子的表达水平均未发现有显著性改变,可见高糖可以促进MRC-5细胞胶原合成,减少胶原降解,诱导肺纤维化相关因子的表达,且其作用与高糖产生的渗透压内环境无关,而是由其高葡萄糖作用所致。另外,我们发现高糖诱导下FOXM1的表达水平增加,为进一步探讨FOXM1的作用,我们在高糖培养的MRC-5细胞中加入FOXM1的抑制剂硫链丝菌素共培养细胞,结果显示FOXM1表达较单独的HG组明显有被抑制,且其参与的TGF-β/Smads信号通路相关因子表达明显下调,胶原合成相关因子也均较HG组有不同程度的改变,这与Penke等[17]证实的FOXM1是肺纤维化的一个关键驱动因子研究结果是一致的。而Girish等[18]报导的糖尿病肺纤维化是通过激活TGF-β/Smads信号通路所致,FOXM1又可以驱动并加强TGF-β/Smads信号通路的传导[7-8]。因此,我们有理由认为FOXM1是高糖诱导胶原合成过程的一个相关调节因子,且其发挥作用的机理和TGF-β信号通路有关。
综上所述,本研究通过设立高糖的高渗对照,建立高糖模型,并对细胞给予硫链丝菌素处理,检测高糖状态下COL Ⅰ、COL Ⅲ等胶原合成因子的表达及FOXM1的表达,证实了高糖会通过TGF-β/Smads通路促进胶原合成且加剧肺纤维化的发生发展,FOXM1是参与其中的一个相关调节因子。本研究为进一步了解高糖诱导胶原合成以及糖尿病肺纤维化的机制提供了依据,为防治糖尿病肺纤维化提供了新思路,但本实验只涉及了体外细胞实验,对于FOXM1在高糖诱导胶原合成及纤维化中的作用还应辅以分子生物学、动物模型实验等加以深入研究。

