低温胁迫后水分对水稻幼苗根系活力和水孔蛋白相关基因表达的影响
黄奇娜 江苏 汪利民 张燕 俞林飞 李春福 丁利群 邵国胜, *
低温胁迫后水分对水稻幼苗根系活力和水孔蛋白相关基因表达的影响
黄奇娜1, #江苏2, #汪利民2张燕1俞林飞1李春福1丁利群2邵国胜1, *
(1中国水稻研究所, 杭州 310006;2浙江省开化县农业农村局, 浙江 开化 324300;*通信联系人, E-mail: shaoguosheng@caas.cn)
【目的】为了探究低温冷害胁迫后水分/湿度对水稻幼苗根系活力和水分运输等的影响,【方法】以具有低温耐性差异的嘉籼7号和辐8329两个水稻品种为研究材料进行低温胁迫处理后,在进行实验Ⅰ(不同湿度梯度,正常温度培养条件下)和实验Ⅱ(快速回温处理实验,以正常温度恢复为对照)。【结果】实验Ⅰ结果表明,与较低湿度(30%)相比,较高的湿度(60%和90%)可以提高根系活力,有效保证水稻幼苗的存活率并缓解其遭受的低温冷害。水孔蛋白基因和的表达水平与根系活力密切相关,对水稻的抗寒和低温耐性具有显著的调控作用。实验Ⅱ结果表明,与对照组(CK)相比,快速回温处理后水稻幼苗的含水量和根系活力显著降低;且正常自然恢复状态下,两个水稻品种的存活率明显高于快速回温组幼苗。【结论】低温胁迫显著影响水稻幼苗的生长发育过程。较高的湿度环境有助于缓解幼苗的低温冷害损伤,保证存活率。同时,低温胁迫后的外界环境湿度对水稻幼苗的含水量、根系活力和水孔蛋白相关基因表达有显著影响,其中和的表达水平与根系活力正相关,在水稻幼苗抵御外界低温冷害过程中起重要作用。因此,与低温胁迫后田间大量灌溉相比,正常温度下土壤缓慢的温度上升对幼苗的根系活力影响较小,有助于其在低温冷害后恢复生命活动。
水稻;低温胁迫;基因表达;根系活力;水孔蛋白;水分含量
水稻作为主要粮食作物之一,其产量受到外界环境的影响,其中水稻苗期的低温冷害是影响我国南方早稻产量的重要因素之一。低温冷害会严重扰乱水稻等农作物的生长及生理代谢,导致其生长缓慢,抑制有效穗的形成,甚至引起青枯死亡,最终影响水稻的产量和品质[1, 2]。水稻是喜湿耐湿的农作物,水分调控在水稻的生命活动中尤为重要,主要影响其蒸腾作用、光合和呼吸作用,以及其他激素调节相关的生理生化过程[3, 4]。低温加重了水稻植株的水分胁迫,导致植物的含水量降低,诱发细胞间严重失水。不同湿度环境对植物低温冷害具有不同的影响,在低温处理下高湿度环境具有较强的抗失水能力,能有效缓解细胞膜渗漏等[5]。此外,低温还能影响水稻的根数、根长、根系活力等[6-8],其中,对根系活力的影响尤为显著。水稻苗期对低温的耐性在不同品种间存在显著差异,其中粳稻对低温的耐性高于籼稻[8],且低温耐性与水稻的生育期密切相关[1, 2, 9]。
低温胁迫时,植物会通过调节自身的胁迫应答机制和水分的内稳态来维持细胞的正常生长和发育,其中具有介导水分跨膜运输的水孔蛋白在水分调控途径中起重要作用[10],且低温胁迫应答机制与水孔蛋白密切相关[11]。研究表明在低温胁迫下,不同的水孔蛋白相关基因的表达模式各不相同,且在不同程度低温胁迫下,同一水孔蛋白基因表达的方式在植物不同组织器官中也呈不同变化趋势[12]。根据多肽序列的特异性及其分布差异,在高等植物中水孔蛋白主要被分为PIPs(plasma membrane intrinsic proteins)、TIPs(tonoplast intrinsic proteins)、NIPs(nodulin26-like intrinsic proteins)、SIPs(small and basic intrinsic proteins)。其中,水孔蛋白PIPs和TIPs具有较高的蛋白活性和输水渗透能力。此外,Danielson等[13]在植物中发现还存在第五类亚家族水孔蛋白XIPs(X intrinsic proteins),但单子叶中并不存在该水孔蛋白。在水稻中已发现至少有38个水孔蛋白在保持水分平衡方面有重要的作用[14]。低温胁迫下,植物水孔蛋白相关基因的表达会受到严重影响。在水稻苗期低温胁迫后,除去,大部分水稻质膜基因的表达均显著降低[15, 16],表明基因与低温胁迫耐性相关[17]。在拟南芥中,水孔蛋白相关基因均对低温胁迫产生响应,其中的表达水平呈上调趋势,其他水孔蛋白相关基因的表达均受到显著抑制[12];同时,在水稻中,Ahamed等[11]发现在根系低温(10℃)处理而地上部常温(25℃)的条件下基因的表达量也显著增加,表明水孔蛋白OsPIP2;5在改善低温条件下的水分交换和运输中起重要作用。Kuwagata等[18]研究发现根系在低温处理后2个根特异性水通道蛋白基因和的表达水平显著升高。此外,Sakurai等[19]研究发现在受到低温冷害胁迫时,水孔蛋白相关基因的表达水平会受到显著抑制,而在25℃或常温恢复过程中,其表达水平会逐渐上调。低温胁迫对水孔蛋白的转录水平影响十分复杂,且由于水孔蛋白不仅参与细胞水分子的转运和代谢,也介导其他分子物质(甘油、尿素、CO2等)的跨膜输送[20]。因此,目前对水孔蛋白如何调控低温胁迫的作用机制尚不十分清楚。本研究以低温耐性差异的2个籼稻品种为研究对象,进行沙土培养,观察其在不同低温胁迫后的表型,评估低温胁迫后不同湿度恢复处理下的耐冷性,测定快速回温处理后相关的生理指标等,运用实时荧光定量PCR分子技术研究水孔蛋白在苗期水稻低温胁迫下表达量的变化情况,为早稻苗期低温伤害控制提供理论依据。
1 材料与方法
1.1 试验材料
通过前期低温耐性筛选实验,选用具有低温耐性差异的嘉籼7号和辐8329两个籼稻品种为研究材料,其中嘉籼7号为低温敏感型水稻品种,辐8329为低温耐型水稻品种。上述水稻材料在中国水稻研究所浙江杭州富阳基地试验区进行相关试验。
1.2 种植方法和低温胁迫
种子经0.5%次氯酸钠消毒5 min后用自来水冲洗3遍,清水中浸种48 h后于35℃下催芽24 h。将发芽种子均匀播于装有洗净沙子的发芽盒中,每盒播种4 g(约100粒饱满种子)。常温培养,待幼苗长至2叶1心进行低温胁迫处理。在进行低温处理前,发芽盒加入2 cm清水。低温处理在人工气候箱内进行,温度设置为10℃(10℃昼/10℃夜),低温胁迫处理3 d,自然光照,相对湿度75%,各处理3次重复。
1.3 不同湿度梯度实验(实验I)
低温胁迫处理3 d后进行不同湿度恢复培养处理(28℃昼/22℃夜),采用培养箱控制湿度,按照大气环境中的雨天(高湿度90%)、阴雨天(中湿度60%)和晴朗天(低湿度30%)的湿度设置,光照强度为72 µmol/(m2·s),13 h光照/11 h黑暗,不同湿度处理时间为5 d,每个处理各3次重复。同时将温度计插入沙子中,深约5 cm,每隔1 h观测并记录温度,直至恢复至常温。恢复处理5 d后对嘉籼7号和辐8329两个籼稻品种进行取样,保存于−80℃低温冰箱中,待后续实验测定相关指标。幼苗存活率 =(总幼苗数量−幼苗死亡数量)/总幼苗数量。水稻根系活力采用氯化三苯基四氮锉(TTC)法进行测定,方法参考赵世杰等[21]。操作过程略有改进,具体步骤如下:选取不同湿度处理的嘉籼7号和辐8329根系0.5 g放入烧杯中,加入提取混合液(0.4%TTC溶液,pH为7.0 0.1 mol/L磷酸缓冲液)(∶= 1∶1)。以先加入根系样品和硫酸(室温放置10~15 min),再加入提取混合液为空白对照。将上述根系样品在37℃黑暗培养箱中放置3 h,加入2 mL 1 mol/L硫酸终止反应。将反应后的根系用吸水滤纸吸干水分放于研钵内,加入4 mL乙酸乙酯研磨成匀浆,用2 mL的乙酸乙酯冲洗2~3次后定容至终体积为10 ml。采用紫外分光光度计在波长485 nm下进行比色。换算公式为四氮唑还原强度(mg·g−1h−1)=四氮唑还原量/(根质量×时间)。
1.4 快速回温试验(实验II)
低温胁迫处理3 d后进行快速回温恢复试验,设置两个处理:一组为对照处理(CK,control treatment):按照外界温度正常恢复培养3 d;另一组为快速回温处理(QR,quick rewarming treatment),将低温处理后的表层水倒掉,迅速加入常温(25℃)清水,反复冲洗5~6次,每个处理各3次重复。同时观察沙土温度变化(沙土中插入温度计,深约5 cm,每隔1 h观测并记录温度,直至恢复至常温)。按照不同时间段(0、4、8 h)取样测定两个水稻品种根系和地上部的含水量和根系活力。含水量 = 植株组织鲜重―干质量;稻根系活力采用上述氯化三苯基四氮锉(TTC)法进行测定。
1.5 水孔蛋白相关基因荧光定量分析
以不同湿度梯度实验中嘉籼7号和辐8329两个籼稻品种的根系为样品,进行实时荧光定量PCR分析,测定相关水孔蛋白基因的表达情况(引物序列参考Sakurai-Ishikawa等[22])。采用TRIZOL法提取植物根系总RNA,运用反转录试剂盒(TaKaRa)将RNA反转录成cDNA后,以18S rRNA为内参,以30%湿度梯度为对照,运用实时荧光定量PCR仪(ABI, Thermo Fisher Scientific, 美国)和总体积为20 μL反应体系进行实时荧光定量PCR(qRT-PCR),采用2方法计算数据[23]。利用Microsoft Excel 2013绘图,应用-检验方法进行数据统计分析。
1.6 数据方差分析
用Microsoft Excel 2013 和Statistix 9方差分析软件(Analytical Software Tallahassee, FL)对数据进行处理与统计分析,采用LSD法进行差异显著性检验(< 0.05)。
2 结果与分析
2.1 低温胁迫处理
将嘉籼7号和辐8329两个籼稻品种培养至两叶一心进行低温胁迫处理(图1-A)。结果显示低温处理1 d后,两个品种的水稻叶片由正常逐渐转为卷曲,且两种材料均出现不同程度的萎蔫(图1-B)。处理3 d后,辐8329的叶片大部分呈展开状态,但嘉籼7号的叶片还处于卷曲状态(图1-C)。结果表明,辐8329对低温的耐性和适应能力明显高于嘉籼7号。
2.2 低温胁迫后不同湿度恢复处理(实验I)
2.2.1 表型变化和幼苗存活率
低温处理后将两个材料进行不同湿度恢复处理(图2)。结果显示,随着处理湿度的提高两个水稻品种的叶片均出现不同程度的叶尖枯死,且低湿度(30%)处理下的嘉籼7号水稻叶尖枯死的症状明显要高于中湿度(60%)和高湿度(90%),但在辐8329中,三个湿度梯度下,幼苗的叶尖枯死症状基本一致(图2-A, B)。同时,秧苗的存活率结果显示,恢复常温处理3 d后,随着处理湿度的提高,嘉籼7号的幼苗存活率极显著提高,其中在低湿度处理下幼苗存活率约为45.33%,中湿度处理下为60.00%,而高湿度(90%)下幼苗存活率最高,约86.67%;但在辐8329籼稻品种中,在三个湿度处理下的幼苗存活率基本一致(≥94.67%)(图2-D)。沙子温度变化结果(图2-C)显示,各处理之间沙子温度在低温处理(10℃)后1~3 h均逐渐升至常温,但在0.5~1 h的范围内温度变化最为明显,其中嘉籼7号在高湿度(90%)常温处理下增幅最为显著,约12.88℃,但在低湿度(30%)下沙子温度仅增加了8.2℃,两者相差4.77℃;同样辐8329在高湿度(90%)和低湿度(30%)下的增温幅度相差4.4℃。而在中湿度(60%)环境下两个水稻品种沙子温度恢复情况较为一致。综上所述,较高的湿度可以有效缓解低温对幼苗的伤害,同时,与低湿度相比,高湿度具有更高的抗失水能力,且辐8329的低温耐性高于嘉籼7号。

A―低温处理前;B―低温处理1 d后;C―低温处理3 d后。
Fig. 1. Phenotype of Jiaxian 7 and Fu 8329 after 3 days of low temperature treatment.

A-嘉籼7号在低湿度(30%)、中湿度(60%)和高湿度(90%)三个湿度处理5 d的表型;B―辐8329在三个湿度处理5 d的表型;C―嘉籼7号和辐8329在不同湿度处理下沙子温度变化;D,嘉籼7号和辐8329在三个湿度处理5 d后的幼苗存活率。数值表示平均值±标准差(n=3)。不同小写字母表示幼苗存活率在处理之间的差异达0.05显著水平。
Fig. 2. Phenotype, sand temperature and survival rate of Jiaxian 7 and Fu 8329 under different humidity after low temperature stress.
同时在不同湿度恢复处理5 d后进行水稻根系活力的检测。表1结果显示,在嘉籼7号的根系中,低湿度(30%)、中湿度(60%)和高湿度(90%)常温恢复处理下的根系活力分别为129.75、170.92和97.48 mg/(g·h);而辐8329的根系活力分别为144.84、404.19和161.63 mg/(g·h)。结果表明中湿度(60%)处理下两个品种的根系活力最高。在嘉籼7号的根系中,中湿度(60%)处理下的根系活力较低湿度(30%)与高湿度(90%)分别高出31.77%与75.34%,而辐8329的根系活力则分别增加约179.05%和150.08%;且辐8329的根系活力在三个湿度处理下均显著高于嘉籼7号,尤其是在中湿度(60%)处理下的根系活力与嘉籼7号相比增加约136.48%。表明不同湿度对水稻根系活力有显著影响,且根系活力与水稻低温耐性相关。
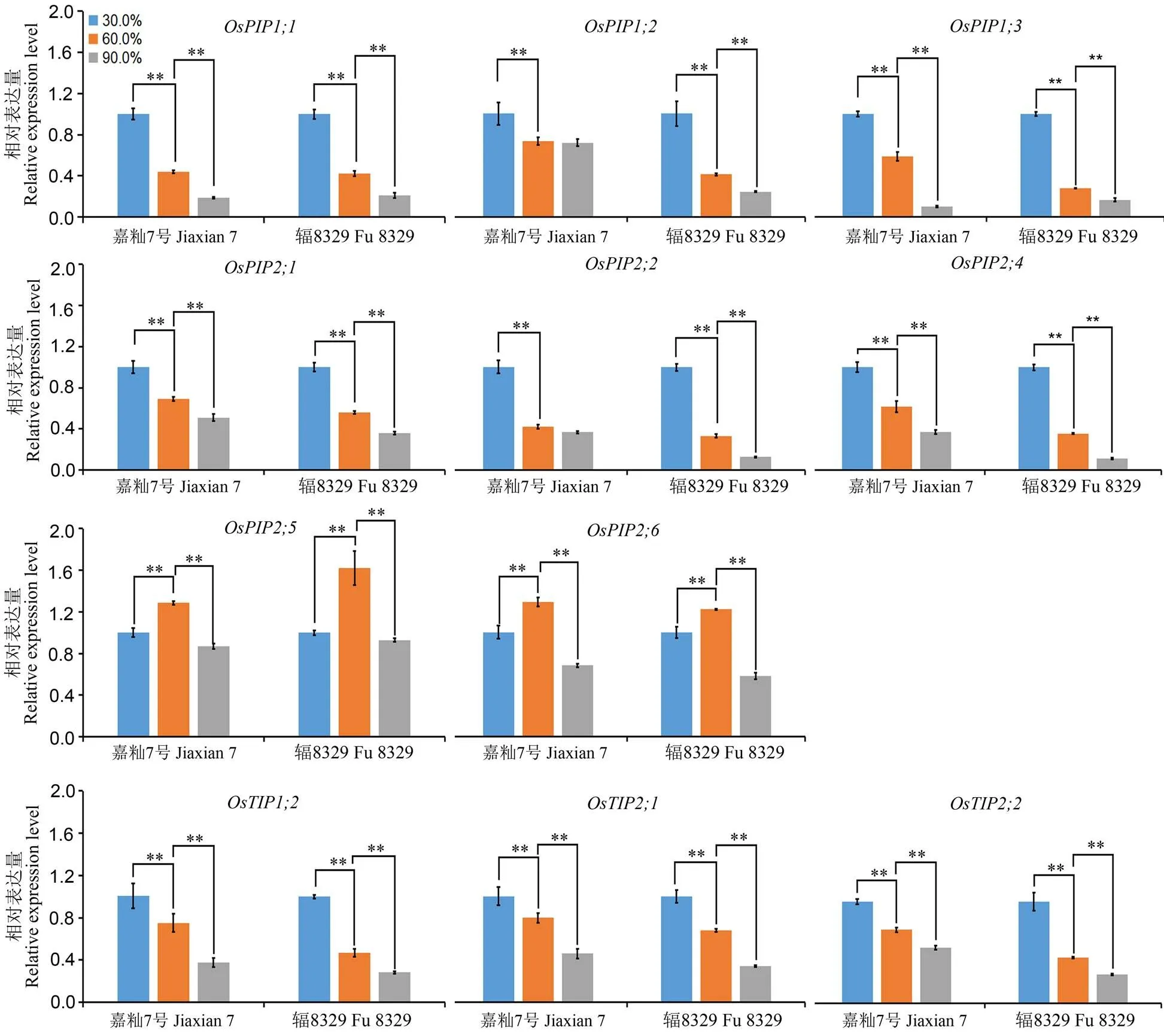
数值表示±SD(n=3)(t-test);**,表示极显著差异P < 0.01。
Fig. 3. Effect of humidity treatments after chilling stress on relative expression levels of aquaporin-related genes in roots of Jiaxian 7 and Fu 8329.

表1 嘉籼7号和辐8329三个不同湿度处理5 d后的根系活力
数值表示平均数±标准差(=3),表格中不同的小写字母表示两品种间的差异达0.05显著水平。
Data were means ± standard deviation (SD) from three replicated experiments (= 3). Different lowercase letters represent significant differences (< 0.05).
2.2.2 不同湿度处理下水孔蛋白相关基因表达量分析
在不同湿度(30%、60%和90%)恢复处理下,对根系的水孔蛋白相关基因表达量进行分析(图3),结果显示,11个水孔蛋白相关基因;1,;2,;3,;1,;2,;4,;5,;6,;1,;1,;2)在嘉籼7号和辐8329根系中的表达变化趋势相同。与30%湿度梯度相比,9个基因的表达量随着湿度梯度的增加呈极显著降低趋势(<0.01)。但在60%湿度下,;5和;6基因表达量极显著上调,其中;5基因的表达量在30%湿度和90%湿度之间无显著性差异,;6基因的表达量在90%湿度下又呈降低趋势。此外,在60%湿度条件下,辐8329根系中;5的表达量要高于嘉籼7号;而;6基因的表达量在两个品种中无显著差异。结果表明,;5和;6基因在水孔蛋白调控水分运输途径和水稻低温耐性中起作用,其中;5基因起主要作用。
2.3 低温胁迫后快速回温处理(实验II)
2.3.1 表型和存活率分析
对嘉籼7号和辐8329两个品种进行快速回温实验处理(图4),结果显示在常温恢复5 h后,对照组(CK)中嘉籼7号的叶片开始卷曲,而该品种快速回温组(QR)叶尖出现卷曲枯黄;但辐8329的叶片在两个处理中一直处于正常展开状态。常温培养3 d后,在CK组中,嘉籼7号和辐8329叶片的叶尖均出现不同程度的发黄枯萎,但嘉籼7号中的叶片枯萎程度显著高于辐8329;在快速回温组中,嘉籼7号的植株均出现不同程度的枯萎和死亡,而辐8329植株仅叶尖枯萎,但整个植株的表型还处于正常生长状态。研究结果显示,在低温胁迫处理后,进行土壤快速回温处理会加剧水稻植株的发黄枯萎,甚至死亡。表明在遭受低温伤害后进行水分灌溉可能会加剧水稻幼苗的枯萎死亡,最终导致产量降低。

A-对照组(CK);B-快速回温组(QR)处理5 h后;C,常温恢复3 d后的表型;D,快速回温处理后沙子温度变化;E,快速回温处理后的幼苗存活率。数值表示平均值±标准差(n=3),不同的小写字母表示水稻幼苗率在处理之间的显著性差异(P < 0.05)。
Fig. 4. Phenotype, sand temperature and survival rate of Jiaxian 7 and Fu 8329 after quick rewarming.

表2 快速回温和常温恢复对低温胁迫处理后的嘉籼7号和辐8329根系活力的影响
数值表示±标准差(=3)。数字后不同小写字母表示差异达显著水平(<0.05)。
Data were Mean±SD from three replicated experiments(=3). Different lowercase letters represent significant differences(<0.05).

CK表示对照,QR表示快速回温处理,数值表示±SD(n=3),柱形图上不同的小写字母表示P < 0.05。A和B表示地上部和根系的水分含量(g);C和D表示地上部和根系的含水量(%)。
Fig. 5. Moisturecontent and water content in shoots and roots of Jiaxian 7 and Fu 8329 after 0, 4 and 8 h of treatment.
同时检测沙子温度变化结果发现(图4-D),处理0.5~3 h,快速回温组(QR)中两个水稻品种沙子温度恢复至常温的速度快于CK,且在常温培养4 h后两个处理的沙子温度均趋于常温。两个处理的水稻幼苗存活率结果显示(图4-E),嘉籼7号对照组和快速回温组水稻幼苗存活率分别约为88.45%和37.07%;而辐8329对照组和快速回温组的幼苗存活率则在96.91%以上。表明低温敏感水稻材料嘉籼7号快速回温组的幼苗存活率低于对照组,低温耐性水稻材料辐8329的幼苗存活率在两个处理下无显著差异。
2.3.2 植株水分含量动态变化和根系活性分析
水稻植株根系与地下部水分质量(g)和含水量(%)在0、4、8 h内呈现动态变化(图5)。无论地上部还是根系组织水分质量都随着时间增加而降低,且根系水分质量整体低于地上部(水分质量按植株组织鲜重减去干质量计算)。在常温处理0 h到8 h期间,嘉籼7号和辐8329的根系水分质量在对照组中分别降低近38.15%和49.92%,在快速回温组中两者也均呈显著降低趋势,约26.93%和43.15%。与根系相似,在地上部的水分质量中均显著降低。在对照组和快速回温组中嘉籼7号的地上部水分质量分别显著降低约27.88%和27.27%,辐8329的水分质量则分别降低近9.00%和7.75%。同时地上部和根系的含水量(%)的变化趋势与水稻植株的水分含量的变化趋势相似(含水量用水分含量占鲜重的百分比来表示)。结果表明在低温胁迫后常温恢复过程中水稻植株(根系和地上部)的水分质量和含水量均会呈降低趋势,尤其是地上部的水分质量下降的更为明显;此外辐8329(低温耐受型水稻品种)具有更好的水分保持能力。
同时检测两者的根系活力结果显示(表2),在低温胁迫处理后进行对照和快速回温处理的0 h时,快速回温组中的嘉籼7号和辐8329的根系活力极显著高于对照组,分别增加约100.31%和35.24%,且低温耐受材料辐8329中的根系活力在对照组和快速回温组中均低于低温敏感材料嘉籼7号。即低温胁迫快速回温处理后,辐8329恢复根系活力较嘉籼7号弱,表明辐8329具有更适宜低温刺激的应答机制。在常温继续培养3 d后,在两个处理下嘉籼7号和辐8329的根系活力均有显著提高;但与培养3 d后CK相比,嘉籼7号和辐8329快速回温处理下的根系活力均极显著降低约76.26%和71.74%,且辐8329的根系活力在CK和QR处理下均极显著高于嘉籼7号。表明低温胁迫对植株的根系活力有显著影响,正常自然缓慢恢复的生存环境更加有利于植株根系活力的恢复和生长发育,且辐8329具有较高的低温耐受能力。
3 讨论
低温对水稻的生长发育、光合作用和生理生化等过程有显著影响,尤其是苗期的低温冷害,对水稻的存活率、产量和品质有显著相关性[2, 24]。低温胁迫导致水稻在幼苗时期生命力较弱,叶片卷曲且萎蔫[25],导致后期重要的生育期出现死苗情况,说明低温冷害对水稻的产量将会有较大影响。环境湿度是影响植物生长发育的重要因子之一,调节低温冷害对水稻生长环境湿度与幼苗的抗寒性密切相关。因此,采用对温度耐受性存在差异的水稻品种嘉籼7号与辐8329进行不同湿度梯度实验,对低温的适应机制具有一定的理论和实际应用价值。实验结果表明,与较低湿度相比,较高的湿度环境可以有效缓解水稻幼苗遭受的低温冷害,具有更好的抗失水能力,有效保证了水稻幼苗的存活率。高湿度(90%)能增加水稻幼苗的持水能力,原因可能在于高湿度可以减缓环境水气对植物表面的压力,降低由于蒸腾作用导致的气孔失水[5]。此外,不同湿度对水稻幼苗的根系活力影响较大,在60%的湿度条件下,嘉籼7号和辐8329的根系活力显著高于其他湿度。水孔蛋白在植物体抵御低温冷害胁迫方面起重要作用[26]。在拟南芥中,基因的过表达可以显著提高植株的低温耐性[27]。在水稻中,根系特异性水通道蛋白OsPIP2;5控调根系对水分吸收和渗透应对低温冷害胁迫[1, 18, 19]。在本研究中发现,水孔蛋白基因和的表达水平与根系活力密切相关,其在调控根系吸收和运输水分的途径中起重要作用,对水稻的抗寒和低温耐性具有显著的调控作用。因此,低温冷害导致根系活力降低,抑制根系对水分吸收和运输,植物体进而诱导启动相关的应答机制(提高水孔蛋白相关基因的表达水平等);同时外界较高的湿度环境可以有效地缓解低温冷害对水稻幼苗胁迫,有利于植物体水分的保持和后期的生长发育,保证水稻产量。
植株体保持水分主要通过两种途径:1)根系从土壤中的水分吸收增加,进而提高其向地上部的输送;2)地上部减少水分需求(主要表现为蒸腾作用)从而控制植株的含水量。因此,植物根系和地上部在水分吸收方面起着重要作用,且与根系的水分传导和地上部叶片的蒸腾作用息息相关[28]。土壤低温会显著抑制根系对水分的吸收和运输[29]。在长期低温胁迫后环境气温迅速升高,水稻幼苗易青枯发黄。这主要是由于幼苗在长期低温后,根系活力较弱;而当外界环境气温骤升时,幼苗地上部对水分需求增加,而土壤温度上升缓慢,较低的根系活力并不能满足叶片对水分的需求,导致叶片迅速失水、青枯,进而死亡。因此,低温对水稻幼苗的伤害可能是由于植株地上部的水分亏缺引起的[3, 8]。在自然温度恢复条件下和快速回温恢复处理后嘉籼7号和辐8329幼苗的存活率和根系活力均存在显著差异。表明短时间内土壤的升温有助于提升根系活力,但植株地上部还处于低温胁迫没有完全适应土壤环境温度的变化,抑制了植物根系的水分吸收和运输,导致快速回温常温恢复后的根系活力显著低于正常恢复条件。
低温胁迫对植株的含水量和根系活力有显著影响,较高的湿度环境和正常自然缓慢恢复的生存环境更加有利于植株生长发育。研究表明在低温冷害出现前,对农作物进行田间灌水/淹水可以起到增温保湿的作用,有效的减轻低温对其的胁迫伤害,降低幼苗死亡率[30-32],但低温胁迫后短时间的田间灌水则会加重水稻的低温冷害,原因在于骤升的外界环境会破坏水稻胞质间的水分稳态,导致植物体无法通过自我调控(降低根系活力和维持植株含水量等)以应对外界环境的冷害刺激。
[1] 王亚男, 范思静. 低温胁迫对水稻幼苗叶片生理生化特性的影响[J]. 安徽农业科学, 2017, 45(5): 8-9.
Wang Y N, Fang S J. Effects of low-temperature stress on the physiological and biochemical characteristics of rice seedling leaves[J]., 2017, 45(5): 8-9. (in Chinese with English abstract)
[2] 庞蓝青, 陈晨, 侯婉婷. 不同时期低温对水稻产量的影响[J]. 现代农业科技, 2020, 22: 14-15, 20.
Pang L Q, Chen C, Hou W T. Effects of low temperature at different stages on rice yield[J]., 2020, 22: 14-15, 20. (in Chinese)
[3] 易子豪. 水分亏缺对水稻秧苗生长的影响及调控[D]. 北京: 中国农业科学院, 2020.
Yi Z H. Effect of water deficit on rice seedling growth and its regulation[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020. (in Chinese with English abstract)
[4] 江福英, 李延, 翁伯琦. 植物低温胁迫及其抗性生理[J]. 福建农业学报, 2002, 17(3): 190-195.
Jiang F Y, Li Y, Weng B Q. Review on physiology of chilling stress and chilling resistance of plants[J]., 2002, 17(3): 190-195. (in Chinese with English abstract)
[5] 张进忠, 韦华芳, 林贵美, 李小泉, 韦绍龙. 不同湿度环境下香蕉苗对低温胁迫响应[J]. 农学学报, 2011(9): 7-12.
Zhang J, Wei H, Lin G, Li X, Wei S. Effect of low temperature stress on banana seedlings under different humidity environment[J]., 2011(9): 7-12. (in Chinese with English abstract)
[6] 李响珍. 水稻发芽期亚干旱对苗期、孕穗期与开花期耐冷性的影响[D]. 长沙: 湖南师范大学, 2019.
Li X Z. Effects of sub-drought at germination stage on cold tolerance at seedling stage, booting stage and flowering stage in rice[D]. Changsha: Hunan Normal University, 2019. (in Chinese with English abstract)
[7] 胡涛. 低温对水稻根系生理特性及其基因表达的影响[D]. 沈阳: 沈阳农业大学, 2019.
Hu T. Effects of low temperature on physiological characteristics and gene expression of rice roots[D]. Shenyang: Shenyang Agricultural University, 2019. (in Chinese with English abstract)
[8] 向丹. 水稻苗期低温耐性差异及其调控研究[D]. 北京: 中国农业科学院, 2013.
Xiang D. The difference in low temperature tolerance of Rice Seedlings and its regulation[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013. (in Chinese with English abstract)
[9] 李健陵, 霍治国, 吴丽姬, 朱庆华, 胡飞. 孕穗期低温对水稻产量的影响及其生理机制[J]. 中国水稻科学, 2014, 28(3): 277-288.
Li J L, Huo Z G, Wu L J, Zhu Q H, Hu F. Effects of low temperature on grain yield of rice and its physiological mechanism at the booting stage[J]., 2014, 28(3): 277-288. (in Chinese with English abstract)
[10] Tyerman S D, Bohnert H J, Maurel C, Steudle E, Smith J A C. Plant aquaporins: Their molecular biology, biophysics and significance for plant water relations[J]., 1999, 50: 1055-1071.
[11] Ahamed A, Murai-Hatano M, Ishikawa-Sakurai J, Hayashi H, Kawamura Y, Uemura M. Cold stress-induced acclimation in rice is mediated by root-specific aquaporins[J]., 2012, 53(8): 1445-1456.
[12] Jang J Y, Kim D G, Kim Y O, Kim J S, Kang H. An expression analysis of a gene family encoding plasma membrane aquaporins in response to abiotic stresses in[J]., 2004, 54(5):713-25.
[13] Danielson J A H, Johanson U. Unexpected complexity of the aquaporin gene family in the moss Physcomitrella patens[J]., 2008, 8: 45.
[14] Forrest K L, Bhave M. Major intrinsic proteins (MIPs) in plants: A complex gene family with major impacts on plant phenotype[J]., 2007, 7(4): 263-289.
[15] Li L G, Li SF, Tao Y, Kitagawa Y. Molecular cloning of a novel water channel from rice: Its products expression inoocytes and involvement in chilling tolerance[J]., 2000, 154: 43-51.
[16] Yu X, Peng Y H, Zhang M H, Shao Y J, Su W A, Tang Z C. Water relations and an expression analysis of plasma membrane intrinsic proteins in sensitive and tolerant rice during chilling and recovery[J]., 2006, 16: 599-608.
[17] Matsumoto T, Lian H L, Su W A, Tanaka D, Liu C, Iwasaki I, Kitagawa Y. Role of the aquaporin PIP1 subfamily in the chilling tolerance of rice[J]., 2009, 50: 216-229.
[18] Kuwagata T, Ishikawa-Sakurai J, Hayashi H, Nagasuga K, Fukushi K, Ahamed A, Takasugi K, Katsuhara M, Murai-Hatano M. Influence of low air humidity and low root temperature on water uptake, growth and aquaporin expression in rice plants[J]., 2012, 53(8): 1418-1431.
[19] Sakurai J, Ishikawa F, Yamaguchi T, Uemura M, Maeshima M. Identification of 33 rice aquaporin genes and analysis of their expression and function[J].2005, 46(9): 1568-1577.
[20] 孙天旭, 李玉花, 张旸. 逆境条件下水孔蛋白PIPs作用的研究进展[J]. 植物生理学报, 2014, 50(6): 749-757.
Sun T X, Li Y H, Zhang Y. Advance in a role of PIP aquaporins under adversity condition[J]., 2014, 50 (6): 749-757. (in Chinese with English abstract)
[21] 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002.
Zhao S J, Shi G A, Dong X C. Plant Physiology Experiment Guide[M]. Beijing: Chinese Agricultural Science and Technology Press, 2002. (in Chinese)
[22] Sakurai-Ishikawa J, Murai-Hatano M, Hayashi H, Ahamed A, Fukushi K, Matsumoto T, Kitagawa Y. Transpiration from shoots triggers diurnal changes in root aquaporin expression[J]., 2011, 34(7): 1150-1163.
[23] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real time quantitative PCR and the 2method[J]., 2001, 25: 402-408.
[24] 曾研华, 张玉屏, 潘晓华, 朱德峰, 向镜, 陈惠哲, 张义凯, 曾勇军. 花后不同时段低温对籼粳杂交稻稻米品质性状的影响[J]. 中国水稻科学, 2017, 31(2): 166-174.
Zeng Y, Zhang Y, Pan X, Zhu D, Xiang J, Chen H, Zhang Y, Zeng Y. Effect of low temperature after flowering on grain quality of indica-japonica hybrid rice[J]., 2017, 31(2): 166-174. (in Chinese with English abstract)
[25] 王文霞, 陈丽明, 王海霞, 刘有清, 吴自明, 曾勇军, 谭雪明, 潘晓华, 石庆华, 曾研华. 淹水缓解直播早籼稻苗期低温冷害的生理特性研究[J]. 中国水稻科学, 2021, 35(2): 166-176.
Wang W, Chen L, Wang H, Liu Y, Wu Z, Zeng Y, Tan X, Pan X, Shi Q, Zeng Y. Study on physiological characteristics behind mitigative effects of flooding on low temperature-caused chilling damage to direct seeded early indica rice at the seedling Stage[J]., 2021, 35(2): 166-176. (in Chinese with English abstract)
[26] Uemura M, Tominaga Y, Nakagawara C, Shigematsu S, Minami A, Kawamura Y. Responses of the plasma membrane to low temperatures[J]., 2006, 126: 81-89.
[27] Lee S H, Chung G C, Jang J Y, Ahn S J, Zwiazek J J. Overexpression ofaquaporin alleviates effects of low root temperature on cell hydraulic conductivity and growth in[J]., 2012, 159(1): 479-488.
[28] Javot H, Maurel C. The role of aquaporins in root water uptake[J]., 2002, 90: 301-313.
[29] Kramer P J, Boyer J S//Water Relations of Plants and Soils[J]. California: Academic Press, 1995.
[30] 向镜, 陈惠哲, 张玉屏, 张义凯, 朱德峰. 淹涝条件下水温对水稻幼苗形态和生理的影响[J]. 中国水稻科学, 2016, 30(5): 525-531.
Xiang J, Chen H Z, Zhang Y P, Zhang Y K, Zhu D F. Effects of on morphological and physiological response of rice seedlings to water temperature under complete submergence[J]., 2016, 30(5): 525-531. (in Chinese with English abstract)
[31] Gunawardena T A, Fukai B. The interaction of nitrogen application and temperature during reproductive stage on spikelet sterility infield-grown rice[J]., 2005, 56: 625-636.
[32] Farrell T C, Fox K M, Williams R L, Fukai S. Genotypic variation for cold tolerance during reproductive development in rice: Screening with cold air and cold water[J]., 2006, 98(2): 178-194.
Effects of Moisture Content on Root Vigor and the Expression of Aquaporin-related Genes in Rice Seedlings Under Low Temperature Stress
HUANG Qina1, #, JIANG Su2, #, WANG Limin2, ZHANG Yan1, YU Linfei1, LI Chunfu1, DING Liqun2, SHAO Guosheng1, *
(1China National Rice Research Institute, Hangzhou 310006,China;2Agriculture and Rural Affairs Bureau of Kaihua County, Zhejiang Province,Kaihua 324300, China;*Corresponding author, E-mail: shaoguosheng@caas.cn)
【Objective】The purpose of this study is to explore the effects of moisture content or humidity on root vigor and water transport of rice seedlings under low temperature stress. 【Method】Two rice cultivars (Jiaxian7 and Fu8329) with different chilling tolerance were used as materials. Experiment I (humidity30%, 60% and 90%) and experiment Ⅱ (quick rewarming experiment) were carried out. 【Result】Compared with lower humidity (30%), higher humidity (60% and 90%) could effectively increase the root vigor, ensure the survival rate of rice seedlings and alleviate the chilling injury.The expression level ofandwere closely related to root vigor, which had a significant regulatory effect on cold tolerance of rice. Compared with normal rewarming treatment (CK), the water content and root vigor of rice seedlings were decreased after quick rewarming treatment. The survival rate in CK was significantly higher than in the quick rewarming experiment. 【Conclusion】 Low temperature stress affects the growth and development of rice seedlings.After chilling injury, high humidity can alleviate thedamageand ensure the rice survival rate.Humidity environment after low temperature stress significantly influenced the water content, root vigor and the expression levels of genes related to aquaporin. The expression levels ofandwere positively correlated with root vigor, and played an important role in resistance to cold injury of rice seedlings.Therefore, compared with large-scale irrigation in the field after low temperature stress, the slow soil temperature rise had less effect on root vigor and can help rice seedlings to restore their life activities.
rice; low temperature stress; gene expression; root vigor; aquaporin; moisturecontent
10.16819/j.1001-7216.2022.210805
2021-08-09;
2021-10-02。
中央级公益性科研院所基本科研业务费专项(CPSIBRF-CNRRI-202121);中国水稻研究所所级重点研发项目(CNRRI-2020-05)。

