先天性心脏病介入治疗术后血清钾、钠、氯水平变化及临床意义
杨启才 任凌 徐闵 李正义
[摘要]目的探討先天性心脏病介入治疗术后血清钾、钠、氯水平变化及临床意义。方法选择四川省宜宾市第一人民医院2014年5月至2020年5月住院或门诊患者100例,根据治疗方法分为治疗组与对照组,每组各50例。治疗组为先天性心脏病介入治疗患者,对照组为不需行介入治疗的其他患者。治疗组介入治疗前1 d 静脉取血查血清钾、钠、氯水平(电解质紊乱需纠正后再复查,水平正常后再行手术),介入治疗后6~24 h 复查血清钾、钠、氯水平,对照组分别于治疗前及治疗后检查血清钾、钠、氯水平。比较两组治疗前、后血清钾、钠、氯水平以及治疗组治疗前不同血钾水平患者治疗后低钾血症发生率。结果①治疗组治疗后血钾水平为(3.86±0.98)mmol/L,低于治疗前,差异有统计学意义( P <0.05);对照组治疗后血钾水平为(4.52±1.06)mmol/L,与治疗前比较,差异无统计学意义( P >0.05);治疗组治疗后血钾水平显著低于对照组,差异有统计学意义( P <0.05)。治疗组低钾血症发生率为20.00%,对照组无低钾血症发生,差异有统计学意义( P <0.05)。②两组治疗前后血钠、氯水平比较,差异无统计学意义( P >0.05);均无低钠血症、低氯血症发生。③治疗组23例(46.00%)患者治疗前血钾水平3.5~3.9 mmol/L,治疗后8例发生低钾血症,发生率为34.78%;27例患者治疗前血钾水平≥4.0 mmol/L,治疗后2例发生低钾血症,发生率为7.41%;两组比较差异有统计学意义( P <0.05)。结论先天性心脏病患者介入治疗后低钾血症发生率较高,术前应将血钾控制在合理水平,术后应常规进行血钾检测并酌情补钾。
[关键词]先天性心脏病;介入治疗;低钾血症;低钠血症
[中图分类号] R541.1 [文献标识码] A [文章编号]2095-0616(2022)09-0188-04
Changes and clinical significance of serum potassium, sodium and chloride levels after interventional therapy for congenital heart disease
YANG Qicai REN Ling XU Min LI Zhengyi
Department of Cardiology, the First People's Hospital of Yibin, Sichuan, Yibin 644000, China
[Abstract] Objective To investigate the changes and clinical significance of serum potassium, sodium and chloride levels after interventional therapy for congenital heart disease. Methods A total of 100 inpatients or outpatients in the First People's Hospital of Yibin from May 2014 to May 2020 were selected and divided into the treatment group and the control group according to the treatment methods, with 50 cases in each group. The treatment group consisted of patients with congenital heart disease undergoing interventional occlusion therapy; the control group consisted of other patients who did not require interventional therapy. In the treatment group, venous blood was sampled 1 day before interventional therapy for examination of serum potassium, sodium, and chloride levels (patients with electrolyte disturbances need to be corrected for disturbances before re-examination, and the surgery should be performed after electrolytes become normal), and serum potassium, sodium, and chloride levels were re-examined 6-24 hours after interventional therapy. In the control group, serum potassium, sodium and chloride levels were examined before and after treatment. The serum potassium, sodium and chloride levels before and after treatment in the two groups were compared, and the incidence of hypokalemia in the treatment group with different serum potassium levels before and after treatment was compared. Results (1) The serum potassium level in the treatment group after treatment was (3.86±0.98) mmol/L, which was lower than that before treatment, and the difference was statistically significant (P <0.05); the serum potassium level in the control group after treatment was (4.52±1.06) mmol/L, Compared with before treatment, the difference was not statistically significant (P >0.05); the serum potassium level in the treatment group was significantly lower than that in the control group after treatment, and the difference was statistically significant (P <0.05). The incidence of hypokalemia in the treatment group was 20.00%, and therewas no hypokalemia in the control group, and the difference was statistically significant (P <0.05).(2) There were no significant differences in blood sodium and blood chloride levels between the two groups before and after treatment (P >0.05); no hyponatremia and hypochloremia occurred.(3)23 patients (46.00%) in the treatment group had serum potassium levels of 3.5-3.9 mmol/L before treatment, and 8 patients developed hypokalemia after treatment, with an incidence rate of 34.78%; the serum potassium level of 27 patients before treatment was ≥4.0 mmol/L, and 2 patients developed hypokalemia after treatment, with an incidence rate of 7.41%; the difference between the two groups was statistically significant (P <0.05). Conclusion The incidence of hypokalemia is high after interventional occlusion therapy for congenital heart disease. The blood potassium should be controlled at a reasonable level before the operation, and be routinely detected and supplemented as appropriate after the operation.
[Key words] Congenital heart disease; Interventional therapy; Hypokalemia; Hyponatremia
先天性心脏病(congenital heart disease,CHD)简称先心病,发病率为0.7%~0.8%,是胎儿时期受环境、感染、遗传等多因素影响,心脏血管发育异常所致的心血管畸形;CHD 是新生儿致死、致残的一个重要原因[1]。先心病分为复杂型和简单病变型,其中室间隔缺损、动脉导管未闭、房间隔缺损、肺动脉瓣狭窄分别占先心病的20%、15%、12%和10%[2]。随着微创手术的发展,先心病介入封堵治疗以创伤小、操作时间短、恢复快等优势在临床上应用越来越广泛。但是介入治疗术后可能会导致血清钾、钠、氯等电解质水平的变化,影响患者病情。本研究对50例接受经皮导管封堵治疗的先心病患者术前和术后血清钾、钠、氯变化与50例未手术者进行分析、比较,以观察先心病经皮导管封堵治疗对于患者血清钾钠氯的影响。
1资料与方法
1.1一般资料
选择四川省宜宾市第一人民医院2014年5月至 2020年5月住院或门诊患者100例,根据治疗方法分为治疗组与对照组,每组各50例。治疗组为接受先心病介入治疗的住院患者,其中男23例,动脉导管未闭7例,房间隔缺损10例,室间隔缺损5例,主动脉窦瘤破裂1例;女27例,动脉导管未闭8例,房间隔缺损12例,室间隔缺损6例,肺动脉瓣狭窄1例;年龄18~36岁,平均(33.1±6.8)岁。对照组为不需行介入治疗的门诊或住院患者,其中男24例,女26例;年龄18~40岁,平均(33.5±8.7)岁。纳入标准:①治疗组确诊为先心病,符合我国先心病介入治疗规范[3-5],具有介入治疗指征;介入治疗前血钾、钠、氯水平正常。②对照组患者为心内科不需介入治疗的其他门诊或住院的患者,治疗前血钾、钠、氯水平正常。排除标准:使用引起电解质紊乱的药物或合并引起电解质紊乱疾病的患者。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1治疗组患者介入治疗前1 d 静脉取血查血钾、钠、氯水平,采用日本 HITACHI 公司生产的LAbOSPECT 008AS 全自动生化分析仪,电解质紊乱者纠正电解质紊乱后再复查,水平恢复正常后再行手术,介入治疗后6~24 h 复查血钾、钠、氯水平。1.2.2对照组分别于治疗前后进行常规电解质检查两次。方法同治疗组。
1.3观察指标
比较两组治疗前后血钾、钠、氯水平以及低钾、低钠、低氯血症发生率以及治疗组治疗前不同血钾、钠、氯水平患者治疗后低钾、低钠、低氯血症发生率。正常血钾、钠、氯水平参考值[6]:血钾3.50~ 5.50 mmol/L;血钠135.0~ 145.0 mmol/L;血氯96.0~110.0 mmol/L。
1.4统计学方法
统计学分析应用 SPSS 13.0统计学软件。计量资料用均数±标准差( x ±s)表示,采用 t 检验。计数资料采用[n(%)]表示,采用χ2检验。以 P <0.05为差异有统计学意义。
2结果
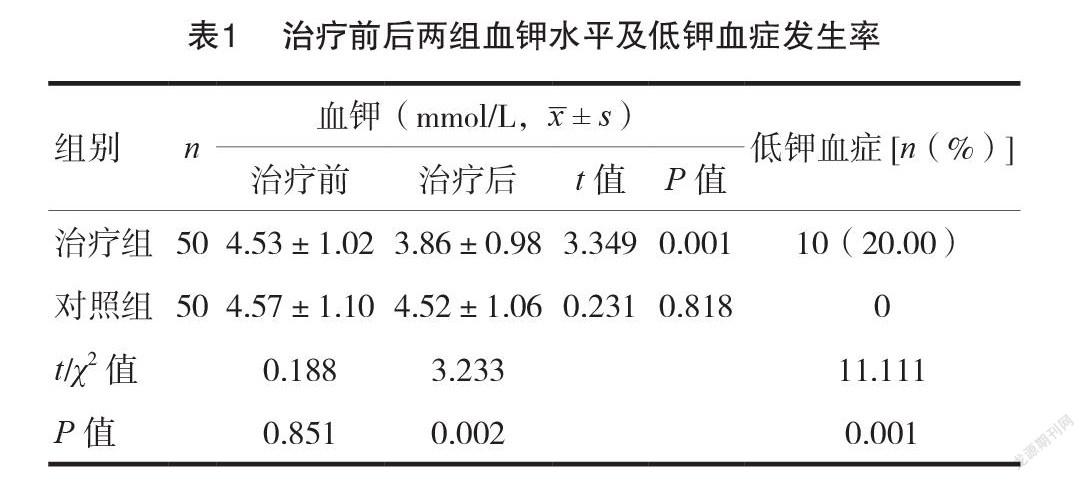
2.1治疗前后两组血钾水平及低钾血症发生率
治疗组治疗后血钾水平为(3.86±0.98)mmol/L,低于治疗前,差异有统计学意义(P <0.05);对照组治疗后血钾水平为(4.52±1.06)mmol/L,与治疗前比较,差异无统计学意义(P >0.05);治疗组治疗后血钾水平显著低于对照组,差异有统计学意义(P<0.05)。治疗组低钾血症发生率为20.00%,对照组无低钾血症发生,差异有统计学意义(P<0.05)。见表1。
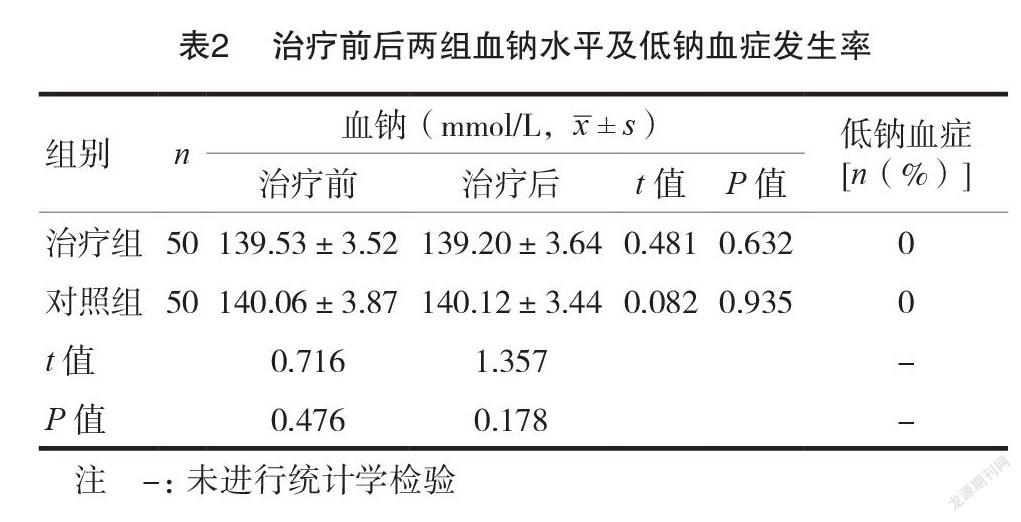
2.2治疗前后两组血钠水平及低钠血症发生率
治疗组治疗后血钠水平为(139.20±3.64)mmol/L,与治疗前比较,差异无统计学意义( P >0.05);对照组治疗后血钠水平为(140.12±3.44)mmol/L,与治疗前比较,差异无统计学意义(P >0.05);两组治疗后血钠水平比较,差异无统计学意义(P >0.05);两组治疗后均无低钠血症发生。见表2。
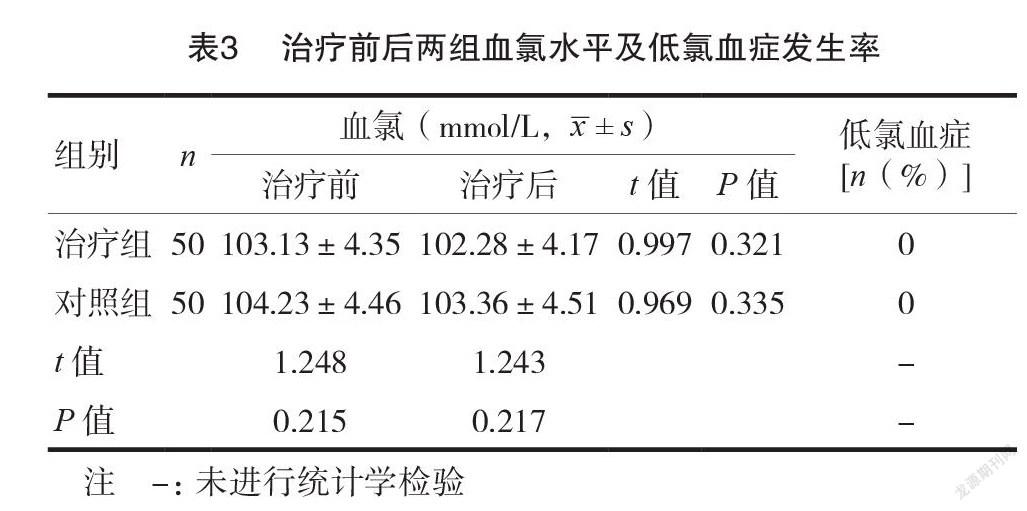
2.3治疗前后两组血氯水平及低氯血症发生率
治疗组治疗后血氯水平为(102.28±4.17)mmol/L,与治疗前比较,差异无统计学意义(P>0.05);对照组治疗后血氯水平为(103.36±4.51)mmol/L,与治疗前比较,差异无统计学意义( P >0.05);两组治疗后血氯水平比较,差异无统计学意义( P >0.05);两组治疗后均无低氯血症发生。见表3。
2.4治疗组治疗前不同血钾水平患者治疗后低钾血症发生率比较
治疗组23例(46.00%)患者治疗前血钾水平3.5~3.9 mmol/L,治疗后8例发生低钾血症,发生率为34.78%;27例患者治疗前血钾水平≥4.0 mmol/L,治疗后2例发生低钾血症,发生率为7.41%;两组发生率比较差异有统计学意义(χ2=5.817,P <0.05)。3 讨论
传统上,外科开胸手术为治疗先心病的主要治疗方式;传统的体外循环手术治疗的疗效可靠,适应证广,治愈率高;但存在因需要体外循环,心脏停搏导致的心脏心肌缺血再灌注损伤,胸骨正中开胸导致的胸骨连续性破坏、失血过多,切口瘢痕明显,影响美觀等问题,也存在因手术创伤大、术后恢复慢、术后并发症多等不足。而伴随着介入材料的不断进步、介入仪器及手术水平的不断提升,多数简单型先心病如室间隔缺损、动脉导管未闭、房间隔缺损、肺动脉瓣狭窄可行经皮导管封堵治疗,疗效肯定[7-9]。先心病患者因心脏结构异常或异常通道存在,容易出现血流动力学改变,引起部分或严重病理生理改变,心肺功能部分或较严重受损,容易出现心力衰竭、心律失常,围手术期需要严密监测患者血流动力学及内环境变化,维持其平衡尤其重要[10-11]。
血清钾离子水平<3.50 mmol/L 时,称为低钾血症(hypokalemia);钾是重要的生命离子,对于维持细胞内液的渗透压、酸碱平衡、细胞代谢、神经肌肉的兴奋性和心脏的自律性、传导性均具有重要作用[12-13]。患者低钾时表现为心肌兴奋性增强,容易出现心律失常,尤其是室性心律失常,出现心脏收缩功能下降、血压下降等症状;急性重症低钾血症(钾离子<2.50 mmol/L)甚至可产生呼吸肌麻痹、严重心律失常如尖端扭转性室速、室颤等,需要紧急处理,否则会造成致死性心律失常或心搏骤停甚至死亡。重度低钾血症可出现严重心律失常,乃至致死性心律失常或心搏骤停甚至死亡[14-15]。
血清钾离子平衡是心脏病介入治疗围手术期心内科介入医生关注的重点之一,本研究先心病患者介入治疗后低钾血症发生率为20.00%,其中成人发生率较低,占30%(3/10),全身麻醉患儿发生率明显高于成人患者,占70%(7/10)。低钾血症更多发生于需要术前禁食的全身麻醉患儿,需要临床医生给予足够重视。发生低钾血症的可能原因有如下几点:①摄入减少。术前不需全身麻醉的患者虽然不需要禁食,但术前由于其情绪改变、紧张等原因,食欲较平时有所下降,钾离子摄入有所减少;而全身麻醉患儿术前需禁食,钾离子摄入明显减少,更容易发生低钾血症;②丢失过多。术中患者多数伴有紧张情绪,出汗较多,钾离子丢失过多;③钾离子分布异常。患者术前、术中常处于相对紧张、焦虑的情绪中,身体处于应激状态,体内应激激素如儿茶酚胺、甲状腺素、胰高糖素等分泌增多,促进钾离子向细胞内转移;④血液稀释。患者术中常规补液使血液稀释,导致钾离子减少,而全身麻醉患儿术后因麻醉后需禁食4 h 以上且需继续补液等原因,其血液稀释更明显。以上诸多因素共同作用造成经皮导管封堵治疗后低钾血症的发生,而全身麻醉患儿因上述因素更明显,低钾血症的发生尤其明显。进一步对术后发生低钾血症患者进行分析,发现发生低钾血症患者中,其中7例患者术前血钾低于4.0 mmol/L;而术前血钾大于4.0 mmol/L,术后发生低钾仅3例。因此,对于先心病介入治疗的患者,术前应常规检测血钾水平.对于血钾<4.0 mmol/L 的患者,建议加强补钾,将血钾控制在较高水平,最好在4.5 mmol/L 以上。低钾血的临床诊断不困难,只要临床医生提高警惕性,及时补钾,低钾血症亦可得到纠正。
综上所述,先心病患者介入治疗后低钾血症发生率较高,术前应将血钾控制于合理水平,术后应常规进行血钾监测并酌情补钾。
[参考文献]
[1] Torres-Cosme JL,Rolón-Porras C,Aguinaga-Ríos M,et al.Mortality from Congenital Heart Disease in Mexico: A Problem on the Rise[J].PloS ONE,2016,11(3):e0150422.
[2]孔祥清,张智伟,陈明龙,等.先天性心脏病介入治疗[M].南京:江苏科技出版社,2003:95-155.
[3] 《中华儿科杂志》编辑委员会,《中华医学杂志英文版》编辑委员会.先天性心脏病经导管介入治疗指南[J].中华儿科杂志,2004,42(3):234-239.
[4]中国医师协会心血管内科分会先心病工作委员会.常见先天性心脏病介入治疗中国专家共识二:室间隔缺损介入治疗[J].介入放射学杂志,2011,20(2):87-92.
[5]中国医师协会儿科医师分会先天性心脏病专家委员会,中华医学会儿科学分会心血管学组,《中华儿科杂志》编辑委员会.儿童常见先天性心脏病介入治疗专家共识[J].中华儿科杂志,2015,53(1):17-24.
[6]万学红,卢雪峰.诊断学[M].8版.北京:人民卫生出版社,2013:382.
[7] 肖家旺,朱鲜阳.中国先天性心脏病介入治疗发展历程[J].协和医学杂志,2021,12(3):303-308.
[8]秦永文,白元.中國先天性心脏病介入治疗器材的研发历程[J].协和医学杂志,2021,12(3):309-312.
[9]姚旭贤,李玉茜,李利,等.军事飞行员先天性心脏病的航空医学鉴定及随访观察[J].军事医学,2021,45(5):397-399.
[10] 何国欢.先天性心脏病介入治疗的新技术进展研究[J].中外医学研究,2018,16(22):186-188.
[11] Ronald DM .米勒麻醉学[M].邓小明,曾因明,译.7版.北京:北京大学医学出版社,2011:1713-1723.
[12] 叶任高,陆再英.内科学[M].6版.北京:人民卫生出版社,2004:848-853.
[13] 何启燕.继发性低钾血症致室性心律失常的心电图特点及治疗策略分析[J].重庆医学,2018,47(20):2742-2743,2746.
[14] 赵世才.急性心肌梗死早期低钾血症的相关因素分析及针对性补钾治疗的临床效果[J].中国当代医药,2020,27(23):65-66,71.
[15]林长煜,吴学周,郭盛锦.早期低钾血症与急性心肌梗死患者近期预后的关系[J].广东医科大学学报,2020,38(3):322-325.
(收稿日期:2021-08-20)

