透射电子显微镜超薄切片批量染色方法的建立
祁荣 郭丽


[摘要]目的建立一种用于透射电子显微镜超薄切片批量染色的方法。方法采用一次性医用注射器作为批量染色工具,在注射器内塞的顶端软橡胶处,用干净刀片划出若干平行的裂隙,裂隙间隔4~5 mm,将铜网依次插入,再小心将内塞插入针管内,在注射器针管内完成染色和清洗步骤。结果一次性医用注射器批量染色法和传统蜡板滴染法都获得了比较理想的镜下图像,其与传统蜡板滴染法比较,一次性医用注射器批量染色法具有染色时间短、染液用量少、污染少、操作更便捷、对铜网机械损伤小,和根据染色铜网数量选择不同规格的注射器等优点。结论一次性医用注射器批量染色法,极大提高了染色效率、大大降低实验成本,是透射电子显微镜超薄切片批量染色的理想方法。
[关键词]透射电子显微镜;超薄切片;批量染色;一次性医用注射器
[中图分类号] R361.2 [文献标识码] A [文章编号]2095-0616(2022)09-0032-04
Establishment of a batch staining method for ultrathin sections for transmission electron microscopy
QI Rong GUO Li
Scientific Experiment Center, Shenyang Medical College, Liaoning, Shenyang 110034, China
[Abstract] Objective To establish a batch staining method for ultrathin sections for transmission electron microscopy (TEM). Methods A disposable medical syringe was used as a batch staining tool, and several parallel slits spaced 4-5 mm apart from each other were scribed with a clean blade at the top of the soft rubber of the inner plug. The copper meshes were inserted into the syringe tube in turn, followed by insertion of the inner plug, and the staining and cleaning procedures for copper meshes were completed in the syringe tube. Results Relatively ideal microscopic images were obtained by both batch staining with disposable medical syringe and traditional drop staining on the wax plate. Compared with the traditional drop staining on the wax plate, batch staining with disposable medical syringe presented the advantages of shorter staining time, less consumption of staining solution, less pollution, more convenient operation, less mechanical damage to the copper meshes, and alternative selection of different specifications of syringes according to the number of stained copper meshes. Conclusion Batch staining with disposable medical syringe greatly improves the staining efficiency and significantly reduces the experimental cost, and is an ideal batch staining method for ultrathin sections for TEM.[Key words] Transmission electron microscopy; Ultrathin sections; Batch staining; Disposable medical syringe
生物樣品制备透射电子显微镜超薄切片,越来越多被应用在教学、科研、临床病理改变分析[1]、疾病诊断[2]、细胞鉴别[3]等方面。透射电子显微镜成像原理:用波长极短的电子束作为照明源,经过加速和聚集,对样品进行高能轰击,使电子与样品中的原子碰撞,发生方向的改变,从而产生不同的电子立体角散射,散射力的大小与样品的密度和厚度相关,电子穿过超薄样品后,形成电镜下明暗不同的灰度反差以及清晰的超微图像[4-6]。由于生物样品本身的反差低,需要进行重金属染色[7],而细胞内各结构对重金属离子的结合力不同,利用这一特点对其进行重金属染色[8]。优质的电镜下图像与制作样本的每一个环节都息息相关[9],超薄切片的重金属染色是关键步骤之一[10],传统蜡板滴染法的染色过程存在诸多不足,为此,本实验室设计出一种批量染色方法,实现批量染色,使铜网边缘不被反复夹持破坏、节约人力和染液、缩短染色时间、减少污染,同时获得满意的透射电子显微镜超薄切片染色效果。
1材料与方法
1.1材料
1.1.1实验材料采用一次性医用注射器,规格是2.5、5、10、20 ml 四种(沈阳市北华医材有限公司),铜网(北京新兴百瑞公司),电镜专用消磁镊子(北京新兴百瑞公司),单面刀片(上海吉列有限公司),黑色避光纸,正常大鼠海马组织。
1.1.2实验试剂2.5%戊二醛(沈阳瑞丰精细化学品有限公司),1%锇酸(美国 PI 公司),氢氧化钠颗粒(国药集团化学试剂有限公司),醋酸双氧铀-柠檬酸铅双染色法[11]:常用的染色液有两种,2%醋酸乙醇双氧铀染液(美国 PI 公司)和0.1%柠檬酸铅染液(北京新兴百瑞公司)。
1.1.3仪器日立 H-7650型透射电镜(日本)。
1.2方法
1.2.1制作超薄切片样品制备流程包括:固定、梯度脱水、浸透、包埋、聚合、修块、切片和染色等操作步骤[12],首先大鼠海马组织经多聚甲醛-戊二醛灌流作固定处理,在海马 CA1区取1 mm3大小组织,放入已预冷的2.5%戊二醛固定液中,此为前固定,因戊二醛对细胞精细结构具有很强的亲和力,必须经过充分漂洗后才能进入1%的锇酸固定液中,因锇酸对氮原子具有较强亲和力,能固定细胞中的蛋白质成分,此为后固定[13]。固定之后,按照常规步骤操作,制作连续切片,每片厚度控制在60~90 nm 为宜,捞片,载片的铜网放在37℃温箱中,干燥48 h 以上待用。
1.2.2固定载片铜网根据需要染色的铜网数量,选取适合规格的一次性医用注射器,在注射器内塞的顶端软橡胶处,用干净刀片划出若干平行的裂隙,长约3~4 mm,裂隙间隔4~5 mm,同时在软橡胶的边缘做标记,用来区分铜网排列方向和顺序,在垂直方向用手挤压,使裂隙微张开,小心夹取带有切片的铜网,依次插入1~2 mm 深,停止挤压动作,裂隙自然闭合后将铜网夹持住,将注射器内塞倒转过来,检查一下铜网夹持是否牢固,确定没有铜网松脱,再将内塞小心插入针管内(图1)。 1.2.3铀染色将内塞推至距离注射器顶端1 cm 左右的位置,用另外一個新的一次性注射器取适量铀染液,加入染色针管里,针管垂直向上轻推至染液上方没有空气为止,盖上针头帽,用黑色遮光纸避光处理,染色时针管水平或垂直放置都可以,室温染色20 min。染色结束,推动内塞将染液排出(图2~3)。
1.2.4清洗载片铜网先将注射器内塞拉出至外1/3处,用另一个新的一次性注射器取超纯水,加至染色针管一半的位置,上下颠倒针管清洗铜网,清洗完毕,推动内塞将废液排出,如此重复5次完成清洗。
1.2.5铅染色,清洗铜网用另一新注射器取0.1%柠檬酸铅染液加入针管里,同样向上轻推内塞杆,至染液上方没有空气为止,将装好铅染液的针管用黑色避光纸避光处理,然后竖直放进装有氢氧化钠颗粒的棕色瓶中,将棕色瓶盖盖好,避免接触空气,室温染色10 min(图4),进行超纯水清洗铜网,步骤同上。清洗完毕将针管内塞完全拔出,依次取下铜网,用干燥的滤纸条逐一吸去多余水分,小心将铜网水平放置在铺好滤纸的平皿内,37℃干燥48 h 后待镜检。
2结果
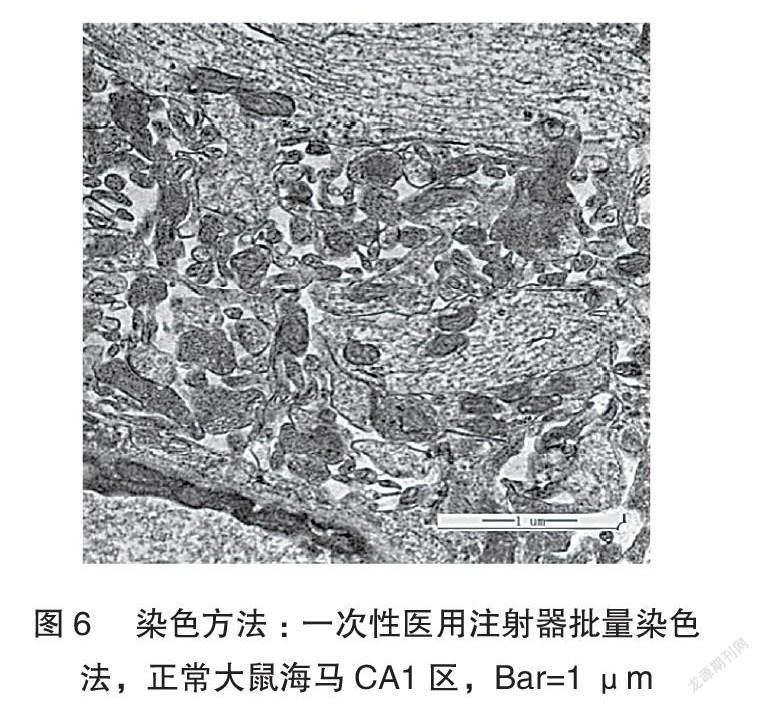
通过镜下观察比较,采用一次性医用注射器批量染色法和以往的传统蜡板滴染法均获得了比较理想的图像,脑组织海马 CA1区神经突触的超微结构清晰可见(图5~6)。通过染色操作过程、时间和染液量比较,一次性医用注射器批量染色法均优于传统蜡板滴染法。
3讨论
3.1批量染色法与传统蜡板滴染法比较
多数实验室在透射电子显微镜超薄切片染色方法上采用的是传统蜡板滴染法,染色过程是预先将准备好的蜡板放在干净的平皿里,用吸管取适量铀染液在蜡板上滴一滴,然后用电镜专用消磁镊子夹取贴有超薄切片的铜网,进染液前要仔细分辨一下正反面,正面朝上45°角插入铀染液里,染色结束后再夹取铜网在超纯水里点洗数下,用干燥滤纸条小心吸干铜网周围水分,再经过同样的步骤进入铅染液染色,点洗、吸干水分,最后水平放在铺好滤纸的平皿里,37℃48 h 以上干燥待镜检,此法不足的是:染色操作时间长,所需的染液多,由于染液滴有一定张力,在插入染液时偶尔会出现铜网插入不利的现象,就需要重新插入,染色过程中反复用镊子夹持铜网的边缘,增加了劳动量,还极易破坏铜网和铜网边缘的超薄贴片,夹持铜网的深度每次都要试探,夹持过深会破坏贴片的完整性。夹持时间长容易导致动作僵硬,经常出现铜网松脱甚至丢失的现象。每次染色的铜网数量要尽量限制在8片以内,否则过多会使头尾两张铜网染色时间差距加大,同一批次的染色时间前后不一致,分析污染原因时,常不能从时间长短上调整染色的条件,进而无法考量最优染色条件,同时还易造成顺序混乱。染液暴露在空气中的时间相对较长,一旦造成污染,将会因重新切片给工作增加负担,而对于极其稀少的结构,重切可能无法再重现该结构,更是重大损失。而采用一次性医用注射器进行批量染色克服了不足并优于传统蜡板滴染法。
3.2批量染色法的注意事项
采用一次性医用注射器批量染色法,透射电镜超薄切片贴片时,超薄切片尽量集中在铜网一侧,另一侧用来夹持,夹好铜网后小心调整插入的深度,使贴片部分完整暴露,夹好铜网的内塞在进入针管的瞬间,动作一定要慢,不要触碰铜网造成折损。铜网间隔不能太近,否则易形成气泡,造成染色不完全或者不均匀。由于铜网较干燥和染液的张力作用,染色液刚接触铜网时偶尔会出现气泡,则应轻轻弹拨或下拉内塞杆并倒转针管使染液离开铜网,再将针管竖直向上,让染液重新接触铜网,反复几次操作使气泡消除;加入铀染液后,及时安装上注射器针头帽,因铀染液具有挥发性和易分解性,长时间暴露空气中易形成灰尘样结晶污染,即铀污染。加入铅染液后不需安装注射器帽,只需要把棕色瓶盖及时盖好,因为棕色瓶里已预先放置好氢氧化钠颗粒,用来中和瓶子里的二氧化碳,减少了碳酸铅的生成,避免了铅染液[14],必要时更换新的一次性注射器外筒。染色和清洗铜网的过程中动作要轻柔,染色结束用滤纸条彻底吸干铜网周围多余水分。另外,透射电子显微镜的制样、超薄切片制作和染色工作,对环境的要求也很重要,室温25℃为宜,室内整洁无尘,避免人员走动,无空气流通[15]、尽量在平整的专用实验台上进行;铀染液要提前取出,室温静置20 min 或者离心后取上1/3澄清染液使用。铅染液最好现用现配,能有效杜绝碳酸铅污染。实验人员戴口罩和无尘手套操作,使用过的注射器不能随意丢弃,应放在指定的实验垃圾回收处,实验废液要严格集中回收处理。
3.3批量染色法的优点
一次性医用注射器是医疗用品,其内塞构造适宜作为批量染色工具,省去了制备和清理染色装置的繁琐。根据染色铜网的数量决定注射器的规格,节约时间、节省染液。黑色避光纸能反复使用,节约材料。铜网是夹插在注射器内塞顶部的,在染色过程中不会出现刮擦侧壁的情况,对铜网有一定程度的保护。铀染液在针管里相对密闭,套上针头塑料帽,与空气不接触,减少污染机会。铅染液不需安装注射器帽,放在预先准备好的氢氧化钠颗粒瓶中,整个染色和清洗过程不用镊子反复夹持,铜网保持完好,铜网边缘贴片无脱落和损坏。夹插铜网不必区分正反面,第一片和最后一片铜网的染色时间一致,不存在时间差,特别在预实验时有利于准确调整染色时间,批量染色工具的应用极大节省操作者的工作量。
综上所述,一次性医用注射器批量染色法值得推广及应用。
[参考文献]
[1]张芳成,刘乐,肖艺,等.Fabry 病肾病合并膜性肾病的临床病理分析[J].诊断病理学杂志,2019,26(5):308-313.
[2]陶长路,张兴,韩华,等.前沿生物医学电子显微技术的发展态势与战略分析[J].中国科学:生命科学,2020,50(11):1176-1191.
[3]鲍丽娟,颜慕霞,顾晓琼,等.5例儿童急性巨核细胞白血病的实验室检测[J].热带医学杂志,2018,18(7):877-880.
[4]唐旭,李金华.透射电子显微镜技术新进展及其在地球和行星科学研究中的应用 [J]. 地球科学,2021,46(4):1374-1415.
[5] 彭辉平,刘锋,朱怀诚 . 透射电子显微镜(TEM)技术在大孢子化石超微结构研究中的应用 [J]. 古生物学报,2020,50(2):238-249.
[6] 李叶,黄华平,张新春,等 . 浅析透射电子显微镜在生物学科中的应用 [J]. 热带农业科学,2019,39(12):58-67.
[7] 王博,关旸,王林燕 . 制样方法改进下的肾组织微结构成像方法研究 [J]. 电子显微学报,2021,40(3):301-306.
[8] 蔺萌,王亚婷,朱美霖,等 . 小鼠脑组织制样过程中不同染色时间对结果的影响 [J]. 河南医学研究,2019,28(22):4033-4036.
[9] 刘湘花,张俊霞,王会丽,等 . 提高生物样品电镜图像反差的几点体会 [J]. 实验室研究与探索,2018,37(3):8-9.
[10]王貝贝,尹伟,刘双双,等 . 电镜超薄切片批量染色的新方法 [J]. 电子显微学报,2016,35(5):462-465.
[11]朱艳,周晨明,闫静,等 . 碳黑颗粒致肺损伤透射电镜染色方法的探讨 [J]. 电子显微学报,2019,38(3):281-283.
[12]王贝贝,平泽朋 . 一种电镜生物样品批量制备的装置及方法 [J]. 电子显微学报,2019,38(1):78-81.
[13]黄静,彭彬 . 常规透射电镜生物样品制样条件的摸索总结 [J]. 川北医学院学报,2021,36(1):119-121.
[14]金英锦,崔林,张杰 . 透射电子显微镜样品制备中染色方法的改良 [M]. 北京:中国解剖学会第六届全国解剖学技术学术会议论文汇编,2017:28.
[15]王响,姚兴凤,何乐健 . 电镜超薄切片染色装置及方法的应用 [J]. 临床与实验病理学杂志,2019,35(8):987-988.
(收稿日期:2021-10-26)

