芪地明目颗粒对糖尿病大鼠视网膜损伤的保护作用
赵越,周雷,余旭,吴豪,贲梅杰,黄莉吉,安晓飞,余江毅,周希乔
(南京中医药大学附属医院,江苏 南京 210029)
糖尿病视网膜病变(Diabetic retinopathy,DR)是糖尿病(Diabetes mellitus,DM)的主要微血管并发症之一,也是全球中老年人视力丧失的主要原因[1]。目前DR的发病机制仍未完全阐明,而以控制血糖、血压等危险因素为主的治疗手段对DR的干预效果有限,积极探索DR发病机制及针对性干预手段对DR防治有着非常重要的意义。
研究显示,高糖诱导视网膜中转化生长因子β1(Transforming growth factor-beta 1,TGF-β1)/微小核糖核酸-200b(micro-RNA-200b,miR-200b)/血管内皮生长因子(Vascular endothelial growth factor,VEGF)信号通路激活,是导致血-视网膜屏障(Blood-retinal barrier,BRB)破坏及DR发生的重要机制[2-3]。而相关文献提示,某些中药可通过改善氧化应激和炎症状态发挥干预DR的作用[4],如黄芪、三七可通过抑制视网膜组织中TGF-β1、IL-1β、NF-κB等炎症因子的过表达改善DR[5-6]。同时我们在前期研究中也发现,六味地黄丸加银杏叶片组合可明显缓解DR的进展且降低患者血清羧甲基赖氨酸水平[7-8];黄蜀葵花可显著改善非增殖期DR,减轻黄斑区水肿并降低VEGF水平[9]。在此基础上,我们结合既往研究结果及文献提示,拟定芪地明目颗粒来干预DR大鼠,评估其对DR大鼠视网膜损伤的保护作用;同时观察芪地明目颗粒对DR大鼠视网膜中TGF-β1/miR-200b/VEGF的影响,探索其干预DR的可能作用机制。
1 材料
1.1 动物
SPF级健康雄性SD大鼠,6周龄,体质量180 g左右,购买于南京市江宁区青龙山动物繁殖场,生产许可证号:SCXK(苏)2017-0011。本研究通过南京中医药大学附属医院实验动物研究伦理审查(批件号:2020DW-21-02)。
1.2 主要药品与试剂
芪地明目颗粒:黄芪、生地黄、石斛、黄蜀葵花、丹皮、丹参、三七粉、密蒙花,按固定组成配制中药配方颗粒,购自江阴天江药业有限公司(批号:201210613);羟苯磺酸钙(Calcium dobesilate,CD),购自江苏万高药业股份有限公司;链脲佐菌素(Streptozotocin,STZ),货号:V900890,购自Sigma-Aldrich公司;羧甲基纤维素钠,货号:R008134,购自Rhawn公司。苏木素-伊红染色液、荧光定量PCR试剂盒(2×SYBR Green qPCR Mix),货号:BL-700A/BL705A,购自Biosharp公司;胰蛋白酶消化液、高碘酸-雪夫(PAS)染色液,货号:G5030/G1008,购自Servicebio公司;BCA蛋白定量试剂,货号:ZJ101,购自EpiZyme公司;TGF-β1一抗、内参抗体(β-actin)、HRP标记二抗,货号:3709S/3700S/7074P2,购自CST公司;VEGF一抗,货号:sc-7269,购自Santa Cruz公司;FITC标记二抗,货号:GMS40007,购自杰美基因公司;RNA提取试剂(Trizol),货号:15596-018,购自ThermoFisher公司;逆转录试剂盒,货号:4368814,购自Invitrogen公司;TGF-β1及VEGF的qPCR引物,购自上海生工;miR-200b的Hairpin-it miRNAs qPCR引物套装,货号:E01011,购自吉玛公司。
1.3 主要仪器
ELX800 Perkin Elmer酶标仪(BioTek公司);1658033垂直电泳转印系统(BIO-RAD公司);Image Quant LAS4000mini检测仪器(GE Healthcare公司);6131-26843核酸蛋白分析仪(Eppendorf公司);AG22332 PCR自动系列化分析仪(Eppendorf公司);7500实时荧光定量PCR仪(ABI公司);CKX31倒置相差显微镜(Olympus公司);血糖检测仪(倍稳®倍捷型)。
2 方法
2.1 动物模型建立
从40只雄性SD大鼠中,随机选取8只作为正常对照组,另外32只大鼠制备DR模型,方法如下:SD大鼠适应性喂养1周+高脂饲料喂养3周后,禁食12 h,用pH4.5的0.01 mol·L-1柠檬酸钠缓冲液溶解STZ,配成1%溶液,按25 mg·kg-1剂量经腹腔注射,间隔2 d后再以同等剂量注射1次,正常对照组SD大鼠予腹腔注射等体积的柠檬酸钠缓冲液。模型组STZ注射完成后72 h测随机血糖,大鼠血糖水平>16.7 mmol·L-1,则DM大鼠建模成功。DM模型组及正常组大鼠均自由进食饮水,定期测量血糖及体质量,观察形态改变。继续喂养8周后,在DM大鼠中随机抽取2只,正常对照组随机抽取1只,处死后取双侧眼球,用眼科剪沿角巩膜缘剪去角膜,去除前节和玻璃体,制成视杯。一侧视杯制作石蜡切片及HE染色;另一侧视杯分离出视网膜组织做血管消化铺片,以共同确定DR大鼠造模成功。
2.2 分组给药及取材
DR大鼠建模成功后随机分配到以下4组:DR组、DR+芪地明目颗粒低剂量组(DR+FFE-L)、DR+芪地明目颗粒高剂量组(DR+FFE-H)、DR+羟苯磺酸钙组(DR+CD)。DR+FFE-L组及DR+FFE-H组分别将芪地明目颗粒按1.0、3.0 g·kg-1·d-1剂量以0.5%羧甲基纤维素钠溶液配制后给大鼠灌胃。DR+CD组将羟苯磺酸钙按照135 mg·kg-1·d-1剂量与0.5%羧甲基纤维素钠溶液配制后给大鼠灌胃。正常对照组及DR组每日给予等量0.5%羧甲基纤维素钠溶液灌胃。各组均正常饮食、进水、灌胃,持续8周后,用3%戊巴比妥钠过量麻醉处死所有大鼠,迅速摘除双侧眼球,用眼科剪沿角巩膜缘剪去角膜,去除前节和玻璃体,制成视杯。各组随机抽取3只大鼠的双侧视杯,一侧行HE染色,另一侧行消化铺片。其余视杯全部分离视网膜组织,冷冻于液氮中备用。
2.3 检测指标
2.3.1 常规指标 在造模前后多个时点采大鼠尾静脉血,检测血糖,并记录同时点体质量。
2.3.2 视网膜组织HE染色 取各组新鲜制作的视杯,4%多聚甲醛固定24 h后,在通风橱内用手术刀将目的部位组织修平整,将修切好的组织放于脱水盒内采用梯度浓度酒精脱水,二甲苯处理透明,之后进行石蜡包埋。使用切片机将蜡块切为4 μm厚度组织切片,烘干后使用二甲苯及梯度浓度酒精常规脱蜡复水,使用苏木素及伊红染色液对切片进行染色,再次用梯度浓度酒精脱水、透明、封片,显微镜下观察各组视网膜组织的病理改变。
2.3.3 视网膜微血管消化铺片 将视杯在预冷的4%多聚甲醛中固定48 h后取出,流水冲洗,以眼杯-视盘为中心剪成橘瓣样,分离出内壁的视网膜层,PBS漂洗,0.15 mol·L-1pH7.4的甘氨酸缓冲液浸泡过夜。3%胰蛋白酶37 ℃消化2 h。视网膜溶解后移入蒸馏水中轻轻振荡,洗掉内界膜及残留的视网膜神经组织,仅剩一层透明的视网膜血管网,将其漂取并移至载玻片上展平,自然晾干,PAS染色。显微镜下观察各组视网膜毛细血管的改变,计算每高倍视野直径长度的血管数目及内皮细胞/周细胞(E/P)比值。镜下血管数目计算方法:200倍镜下,每视网膜标本随机取5个部位,每部位计算经过高倍视野中心横径及垂直径两径线的微血管数目,取其平均数作为该视野每径线上血管数目,并取5个部位算出平均数代表该样本高倍视野下血管数目。E/P比值计算方法:显微镜连接照相机,200倍镜下对消化铺片样本进行拍照,随机截取5个小范围,在图像分析软件ImagePro Plus下进行内皮细胞和周细胞计数,计算E/P比值。
2.3.4 视网膜组织免疫荧光 取各组大鼠视网膜组织,同上方法制备组织切片,3%双氧水孵育后依次进行抗原修复及山羊血清封闭,使用TGF-β1一抗4 ℃孵育过夜,洗涤,FITC标记的二抗37 ℃孵育30 min,洗涤、封闭,荧光显微镜下观察并拍照,比较各组视网膜组织中TGF-β1表达的差异。VEGF检测使用相应一抗及二抗,其余步骤同上。
2.3.5 定量qPCR检测 取各组大鼠视网膜组织,使用RNA提取试剂(Trizol)提取各组样本总RNA,经逆转录试剂逆转录为cDNA样本后,用特异引物在DNA聚合酶(2×SYBR Green qPCR Mix)作用下进行扩增,在荧光定量PCR仪中分析miR-200b及TGF-β1、VEGF的mRNA表达水平。miR-200b以U6为内参,TGF-β1及VEGF以β-actin为内参。引物序列:miR-200b上游5'-ATCGTACGTGGGTAATACTGCCTGGTAA-3',下游5'-GCAGGGTCCGAGGTATTC-3';U6上游5'-CTCGCTTCGGCAGCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3';TGF-β1上游5'-AACAATTCCTGGCGTTACCTT-3',下游5'-GCCCTGTATTCCGTCTCCTT-3';VEGF上游5'-GAAGTGGTGAAGTTCATGGA-3',下游5'-TTGTCACATCTGCAAGTACG-3';β-actin上游5'-CACAGCTGAGAGGGAAATC-3',下游5'-TCAGCAATGCCTGGGTAC-3'。记录荧光值达到阈值时所经历的循环数(Ct值),用2-ΔΔCt进行相对定量分析。
2.3.6 Western blot检测 取各组大鼠视网膜组织,加入RIPA裂解液后提取总蛋白,BCA法测定蛋白浓度后进行SDS-PAGE电泳,经转膜仪电转印至PVDF膜后,以5%脱脂奶粉封闭2 h。加入稀释后的TGF-β1一抗4 ℃过夜孵育,HRP标记二抗37 ℃孵育1 h。用ECL底物发光试剂对PVDF膜进行孵育,曝光显影后扫描各组条带灰度值,以β-actin为内参,用Image J软件分析TGF-β1蛋白相对表达水平。VEGF检测使用相应一抗及二抗,其余同上。
2.4 统计学方法

3 结果
3.1 一般情况
对照组大鼠正常生长,体质量逐渐增加,毛色光泽,进食正常;DM大鼠建模成功后,其食量、饮水量、尿量明显增加,但体质量相较于对照组增长缓慢,毛色萎黄;建模8周后,DR组大鼠行动缓慢,晶体混浊,明显消瘦,个别大鼠出现腹胀;给药组大鼠情况相对较好,轻中度消瘦,毛色尚有光泽,多伴有晶体混浊。
大鼠数量:评估DR模型时对照组处死1只,模型组随机处死2只;在造模及后续给药过程中,DR组大鼠死亡2只,对照组死亡1只,其余DR+给药组各死亡1只。最终大鼠数量:对照组6只,DR组6只,DR+FFE-L组6只,DR+FFE-H组6只,DR+CD组7只。
3.2 各组大鼠体质量及血糖情况
造模前4周时,各组大鼠体质量及空腹血糖比较均无显著差异。DM造模后,模型组大鼠体质量逐渐减低,血糖显著升高(P<0.01)。在造模后8周及16周时,所有模型组体质量较对照组均显著下降(P<0.01),空腹血糖较对照组均显著升高(P<0.01);而DR+FFE-L组、DR+FFE-H组及DR+CD组体质量及血糖较DR组均未见显著差异(表1)。

表1 各组大鼠不同时点体质量及空腹血糖比较Table 1 The comparisons of body mass and FBG of rats in all groups at different times
3.3 DR大鼠模型评价
对照组大鼠视网膜结构正常,节细胞层细胞较为整齐,内核以及外核层细胞排列紧密;模型组大鼠节细胞层细胞排列紊乱,内核层与外核层排列较空白组相比稀疏,排列不紧密(图1A),提示DR大鼠模型制备成功。
对照组大鼠视网膜毛细血管分布规则,血管管径粗细均匀一致,走向较直。模型组大鼠毛细血管网排列紊乱,管径粗细不均,扭曲扩张,管壁边缘不规则,多根毛细血管扭聚成丛;内皮细胞明显增生(图1B),同样提示DR大鼠模型制备成功。
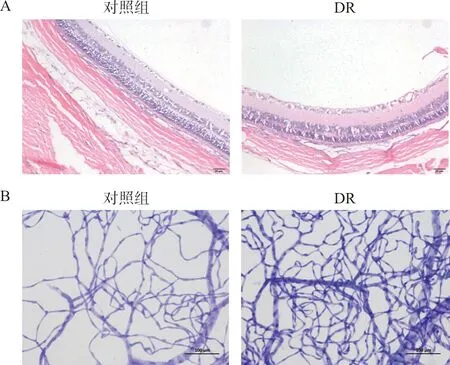
图1 正常大鼠及DR模型大鼠视网膜组织HE染色(A)及视网膜微血管PAS染色(B)比较(×200)Fig.1 The comparisons of retinal tissue HE (A) and retinal capillary PAS (B) of rats between normal and DR groups (×200)
3.4 各组大鼠视网膜组织病理改变
HE结果显示:对照组大鼠视网膜结构正常,节细胞层细胞较为整齐,内核以及外核层细胞排列紧密;DR组大鼠节细胞层细胞排列较为紊乱,内核层与外核层排列较空白组相比稀疏,排列不紧密。DR+FFE-L组节细胞紊乱有所减轻,内核以及外核层细胞排列较DR组紧密。而DR+FFE-H组及DR+CD组的病理改变有进一步减轻(图2)。

图2 各组大鼠视网膜组织HE染色结果比较(×200)Fig.2 The comparisons of retinal tissue HE of rats in all groups (×200)
3.5 各组视网膜毛细血管改变
血管消化铺片显示:对照组大鼠视网膜毛细血管分布规则,血管管径粗细均匀一致,走向较直,可见极少数无细胞毛细血管,未见周细胞鬼影;微血管数目:14.83±2.04,E/P比值:1.03±0.12。DR组大鼠视网膜毛细血管网明显变密,行走紊乱,管径粗细不均,扭曲扩张,管壁边缘不规则,多根毛细血管扭聚成丛,可见较多无细胞毛细血管、周细胞鬼影,内皮细胞明显增生;微血管数目(30.33±3.83)和E/P比值(2.43±0.22)较对照组均显著升高(P<0.001)。DR+FFE-L组的微血管改变较DR组有所减轻,微血管数目(25.33±2.81)和E/P比值(1.50±0.14)较DR组均显著下降(P<0.01,P<0.001)。而DR+FFE-H组及DR+CD组微血管改变有进一步改善,微血管数目及E/P比值较DR组均显著下降(P<0.001)(图3,表2)。

图3 各组大鼠视网膜血管消化铺片结果比较(×200)Fig.3 The comparisons of retinal capillary trypsin digest of rats in all groups (×200)
表2 各组视网膜血管消化铺片微血管数目及E/P比值比较Table 2 The comparisons of retinal vascular quantity and E/P of retinal capillaries in all groups
3.6 各组视网膜组织中TGF-β1及VEGF蛋白表达情况比较
视网膜组织免疫荧光显示:DR组TGF-β1以及VEGF较对照组表达明显升高(P<0.01),DR+FFE-L组、DR+FFE-H组较DR组显著降低(P<0.05,P<0.01),DR+CD组降低最明显(P<0.01)(图4)。
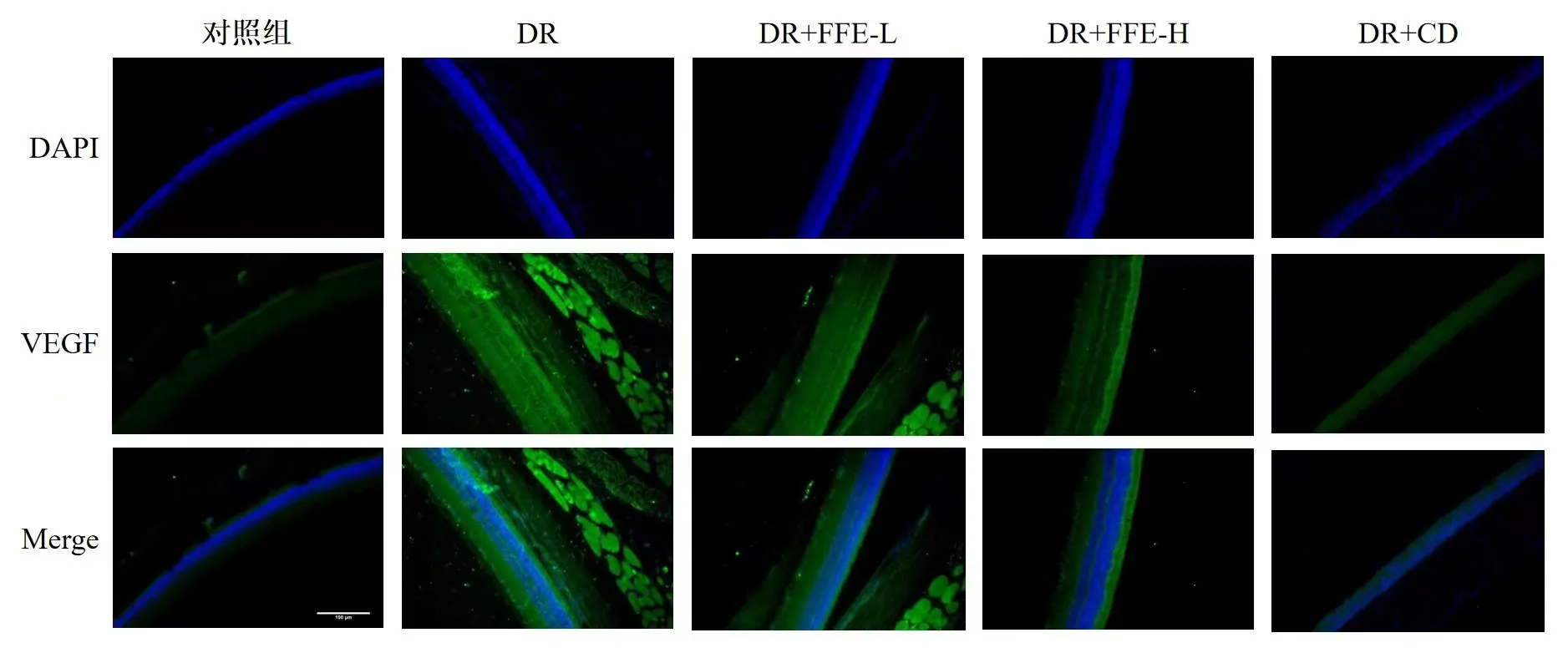
图4 各组大鼠视网膜组织中TGF-β1及VEGF蛋白免疫荧光比较(×200)Fig.4 The comparisons of TGF-β1 and VEGF immunofluorescence of retinal tissues in all groups(×200)
视网膜组织Western blot检测显示:DR组TGF-β1及VEGF蛋白表达较对照组明显升高(P<0.01),DR+FFE-L组较DR组有显著下降(P<0.05),DR+FFE-H组VEGF较DR+FFE-L组有显著下降(P<0.05),DR+CD组TGF-β1及VEGF较DR组均有显著下降(P<0.01)(图5)。
3.7 各组视网膜组织中miR-200b及TGF-β1、VEGF mRNA表达情况比较
视网膜组织qPCR检测显示:DR组TGF-β1及VEGF mRNA表达较对照组显著升高(P<0.01),miR-200b表达较对照组显著降低(P<0.01)。DR+FFE-L组TGF-β1及VEGF mRNA表达较DR组明显下降(P<0.01),miR-200b较DR组显著上升(P<0.05)。DR+FFE-H组VEGF mRNA表达较DR+FFE-L组有进一步下降(P<0.01),miR-200b较DR+FFE-L组有进一步上升(P<0.01)。DR+CD组TGF-β1及VEGF mRNA表达较DR组均明显下降(P<0.01),miR-200b较DR组表达显著升高(P<0.01)(图6)。

注:与对照组比较,##P<0.01;与DR组比较,*P<0.05,**P<0.01;与DR+FFE-H组比较,△P<0.05。图5 各组大鼠视网膜组织中TGF-β1及VEGF蛋白表达情况比较Fig.5 The comparisons of TGF-β1 and VEGF protein expressions in retinal tissue of rats in all groups
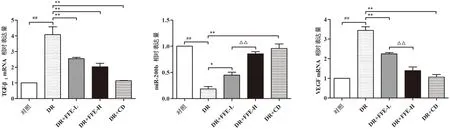
注:与对照组比较,##P<0.01;与DR组比较,*P<0.05,**P<0.01;与DR+FFE-H组比较,△△P<0.01。图6 各组大鼠视网膜组织中TGF-β1、miR-200b、VEGF mRNA表达情况比较Fig.6 The comparisons of TGF-β1, miR-200b and VEGF mRNA expressions in retinal tissue of rats in all groups
4 讨论
祖国医学认为DR属“消渴目病”范畴,其病机相对复杂,但病性总属本虚标实,本虚以阴虚、气虚为主,标实以湿浊、血瘀为主[10],“在气阴亏虚基础上,湿、瘀逐渐形成并贯穿DR始终”可视为DR的基本病机[11],因此,益气养阴、化湿活血法可作为DR的基本治则。芪地明目颗粒由黄芪、生地黄、石斛、黄蜀葵花、丹皮、丹参、三七粉、密蒙花组成,方中黄芪味甘,性微温,可益气兼利湿通滞;生地黄味甘,性寒,可养阴生津;石斛味甘,性微寒,可滋阴生津,此三者相伍,为益气养阴之主药;黄蜀葵花味甘,性寒,可清利湿热;丹皮苦、辛,性微寒,有凉血活血之功;丹参味苦,微寒,有祛瘀凉血之功;三七味甘、微苦,性温,可化瘀止血,此四者相伍,为化湿活血之主药;密蒙花味甘,微寒,有清热养肝明目之功。全方温凉配合、补清并用,共奏益气养阴、化湿活血之功效。
BRB是介于视网膜神经细胞与毛细血管之间的选择性通透结构,负责调节视网膜微环境并维持其稳态。高糖环境下糖基化终末产物(Advanced glycation end products,AGEs)增多可使视网膜周细胞(Retinal pericytes,RPCs)凋亡增加,视网膜内皮细胞(Retinal endothelial cells,RECs)异常迁移和增殖,同时细胞间的紧密连接(Tight junctions,TJs)结构受到破坏,细胞间隙扩大,视网膜毛细血管通透性显著增加,BRB功能异常及损伤逐步出现[12],这也是DR早期的基本病理改变。在高糖诱导BRB损伤的分子机制中,TGF-β1/miR-200b/VEGF通路的激活被认为扮演了重要的角色。
高糖及AGEs可使淋巴细胞、单核细胞、内皮细胞及上皮细胞等表达TGF-β1的水平及活性明显上升[13]。被激活的TGF-β1与细胞表面特异性受体结合后,可将信号传递给胞内分子Smads蛋白[14],Smads蛋白将信号继续跨膜传入细胞核内可抑制miR-200b启动子的活性使其表达显著下降[15]。而miR-200b是一种能特异性与VEGF mRNA的3'非编码区相结合,进而发挥抑制VEGF mRNA翻译及蛋白合成的非编码RNA[16]。miR-200b水平的下降,可使VEGF的表达显著上升。高表达的VEGF与其受体结合后可对视网膜组织产生多种效应,如加速RPCs凋亡;促进RECs异常增殖;破坏细胞间的TJs蛋白Occludin和Claudin;诱导细胞间黏附因子-1表达;抑制色素上皮源性因子对VEGF的拮抗作用;促进细胞吞饮及内皮细胞穿孔等[17],最终使BRB损伤导致出血、渗出、水肿等典型的DR早期改变。
本实验中大鼠视网膜血管消化铺片结果显示DR组E/P比值及微血管数目显著高于正常对照组,提示DR组RPCs凋亡、RECs增殖及血管新生均明显增加;视网膜组织HE染色显示DR组节细胞层排列紊乱,内核层与外核层排列较稀疏,提示DR组损伤相对较重,已突破BRB,波及至视神经细胞。而芪地明目颗粒干预组,无论是视网膜E/P比值、微血管数目还是HE染色,较DR组均有显著改善,且这种改善作用随药物剂量的增加而越发明显。由此提示,芪地明目颗粒对DR大鼠的视网膜损伤确实具有保护作用。
而进一步的实验结果显示,DR组大鼠视网膜中TGF-β1、VEGF的表达显著高于对照组,miR-200b的表达显著低于对照组,这与之前文献提示的高糖可激活TGF-β1/miR-200b/VEGF通路引发DR的描述一致。而芪地明目颗粒干预组大鼠视网膜中TGF-β1、VEGF的表达显著低于DR组,miR-200b的表达显著高于DR组,提示该中药复方可明显抑制DR大鼠视网膜中TGF-β1/miR-200b/VEGF通路的激活,且该抑制效应在高剂量芪地明目颗粒组表现得更为明显。此外,DR组、DR+FFE-L组、DR+FFE-H组各时段的血糖均无显著差异,提示芪地明目颗粒干预DR的疗效并非通过降低血糖的途径获得,这与既往某些研究的结果不完全一致。如周赫等[18]发现,含黄连、黄芪中药复方可显著降低DR小鼠血糖,同时对视网膜微血管损伤具有明显的保护作用;欧阳黄迪[19]也发现,参芪护网汤能改善DR患者血糖,同时可减轻黄斑水肿,促进视网膜出血、渗出的吸收。然而需要引起重视的是,由于长期高血糖引发了“代谢记忆”效应,许多患者会出现血糖虽获得显著改善却仍无法阻止DR进展的尴尬局面[20]。因此,探寻独立于血糖控制之外的DR干预手段,显得尤为重要。本研究的结果向我们展示了芪地明目颗粒通过抑制TGF-β1/miR-200b/VEGF通路而非通过降低血糖达到干预DR的作用,其可被视作一种潜在的独立于血糖控制之外的有效干预DR的补充和替代治疗。
综上,本研究通过相关体内实验初步证实了芪地明目颗粒对DR大鼠视网膜损伤的保护作用,并对其可能通过抑制TGF-β1/miR-200b/VEGF通路而达到相应疗效的作用机制作出了初步探索,后期将进一步完善相关研究以期获得更为有力的证据。

