精神分裂症患者肠道菌群失调对认知功能受损的影响
王晓莹 ,赵 青 ,陈大春 ,2
(1.北京大学医学部,北京 100191;2.北京大学回龙观临床医学院·北京回龙观医院,北京 100096)
精神分裂症是一种重型精神疾病,对患者及其家庭造成了严重的心理和经济负担。全球精神分裂症的终身患病率为3.8‰~8.4‰[1]。精神分裂症是一种在遗传及环境因素的共同作用下大脑发育障碍所引起的复杂疾病,其确切病因尚不清楚[2]。研究表明,肠道微生物对人体的免疫系统、大脑发育和行为具有重要作用,可能影响精神分裂症的发生发展过程[3]。研究显示,大多数精神分裂症患者存在认知功能受损,严重影响其社会功能和生活质量,阻碍了患者回归社会[4]。目前,对精神分裂症的治疗主要采用抗精神病药物,尤其是第二代抗精神病药物(Second generation antipsychotics,SGA),但尚无足够的证据支持SGA对认知功能改善有效。近年来,随着高通量测序技术的发展以及肠道菌群-肠-脑轴概念的提出,肠道菌群在人体中发挥的作用逐渐被发现并进一步研究,肠道菌群与神经精神疾病的关系也成为研究的热点[5]。Wang等[3]和Rosenblat等[6]研究表明,肠道微生物菌群群落的紊乱会影响机体的中枢神经系统和免疫系统,从而对认知和行为等方面产生影响。当前,对一些神经精神疾病的探索热点,已逐步从靶向中枢神经系统转移到靶向肠道微生物的变化、肠道菌群-肠-脑轴的研究上,但相关文献较少,故本研究对精神分裂症患者肠道菌群失调对认知功能受损影响的相关文献进行综述,为改善其认知功能受损情况提供参考。
1 资料与方法
1.1 资料来源与检索策略
于2021年9月1日在PubMed、中国知网和万方数据知识服务平台进行检索,检索时限为建库至2021年9月1日。检索关键词:精神分裂症(Schizo⁃phrenia)、肠道菌群(Gut microbiome/Intestinal flora)、认知功能受损(Impaired cognitive function)、菌群失调(Dysbacterias);中文检索式:(精神分裂症)AND(肠道菌群),(精神分裂症)AND(认知功能受损),(精神分裂症)AND(菌群失调),(认知功能受损)AND(肠道菌群)。英文检索式:((Gut microbiome)OR(Intestinal flora))AND(Schizophrenia),((Impaired cognitive function)AND(Schizophrenia))AND(Gut microbiome),(Schizophrenia)AND(Dysbacterias),((Gut microbiome)OR(Intestinal flora))AND(Impaired cognitive function)。
1.2 文献纳入与排除标准
纳入标准:①研究对象为符合《精神障碍诊断与统计手册(第4版)》(Diagnostic and Statistical Manual of Mental Disorders,fourth edition,DSM-IV)精神分裂症诊断标准的患者;②研究内容涉及精神分裂症患者肠道菌群的变化、认知功能受损与肠道菌群关系的文献;③公开发表的中英文文献;④文献观点准确详实,具有前瞻性、创新性、科学性。排除标准:①证据等级较低的文献;②重复发表或重复检出的文献;③无法获得全文的文献。
1.3 文献筛选与质量评估
第一作者严格按照文献纳入和排除标准进行文献筛选。排除重复文献后,通过阅读文献题目和摘要进行初步筛选,再阅读全文进行二次筛选,由第二作者对筛选获得的文献进行主题相关性复核。纳入文献整体质量较好,目的明确,方法与结论清楚,但同质性较差,不适合用于Meta分析,故作定性描述。
2 结 果
2.1 文献纳入的基本情况
初步检索共获取文献762篇。其中最早的文献发表于2008年,最新文献发表于2021年。发表于2011年-2021年的文献共545篇。通过对标题、摘要及全文进行阅读,最终选出符合纳入标准且不符合排除标准的文献共36篇。文献筛选流程见图1。
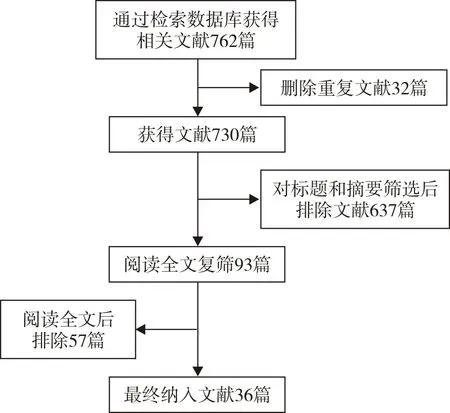
图1 文献筛选流程图Figure 1 Flow chart of literatures screening
2.2 肠道菌群及肠道菌群-肠-脑轴
肠道菌群是肠道微生物组的主要组成部分,约重2 kg[7],包含200万至 2 000万个独特基因[8-9]。肠道菌群是一种动态的生态系统,可以与机体进行物质交换与信息交流,互惠共生,通过营养竞争并产生抗微生物物质来抵御病原体的定植,增强肠上皮屏障以限制细菌进入组织以及代谢不消化的膳食化合物以促进营养吸收。研究表明,肠道菌群可以促进宿主免疫系统的成熟和发挥作用[10]。肠道菌群-肠-脑轴是由中枢神经系统、神经内分泌系统、神经免疫系统、自主神经系统、肠神经系统和肠道菌群组成的一种双向信息调节通路[11]。中枢神经系统可以通过对食物摄入量的控制和饮食模式的变化来影响肠道微生物的营养供应,从而影响它们的组成,也可直接或间接地通过神经和内分泌途径影响肠道菌群,例如联络中枢神经系统和内脏的自主神经系统及下丘脑-垂体-肾上腺(HPA)轴,调节胃肠运动、肠上皮细胞活性物质的分泌、肠上皮通透性以及全身激素水平,继而影响微生物的生态环境以及黏膜的宿主-微生物相互作用[11]。另外,中枢神经系统通过直接或间接命令神经元、肠内分泌细胞、免疫细胞和Paneth细胞,向肠腔释放信号分子、细胞因子和抗微生物肽,可能会立即对肠道微生物产生影响[10]。肠道生态失调和认知功能障碍相关的可能机制有四种:①神经通路,对小鼠化学结肠炎诱导的焦虑样行为的观察显示,迷走神经参与了焦虑样行为和认知功能障碍相关行为(如注意力下降)的发病机制,其作用似乎独立于炎症和脑源性神经营养因子的产生[12];②炎症途径,Saiyasit等[13]研究表明,肠道生态失调是两周高脂饮食后小鼠发生的初始病理生理过程,解剖可见神经元细胞凋亡和脑线粒体功能障碍增加,海马氧化应激水平升高,海马突触可塑性降低,海马CA1区树突棘密度减小,海马小胶质细胞过度激活,淀粉样蛋白沉积增加,而恢复肠道微生物群组成的治疗方法能够减轻炎症状态,对认知功能产生有益的影响;③神经内分泌途径,肠内分泌细胞即散布在肠上皮中的肠嗜铬细胞,可以分泌神经递质,也可以作为感受细胞感知信号肽对管腔的刺激,故肠内分泌细胞可充当中枢神经系统的内脏感受器[10,14];④机体代谢,由肠道菌群产生的代谢物(如短链脂肪酸等)和促炎细胞因子(如IL-6、IL-10、TNF-α)可以通过循环系统血脑屏障影响中枢神经系统[10,14]。肠道菌群失调可能影响脑部功能,使认知功能受损。与健康人群相比,精神分裂症患者的肠道菌群的细菌种类、丰度发生了改变[15-16,18],提示研究者,对肠道菌群的干预可能有助于改善认知功能受损情况,因此,未来可通过对肠道菌群失调的干预,探讨其对改善精神分裂症患者认知功能受损情况的效果。
2.3 精神分裂症患者肠道菌群改变
精神分裂症患者的肠道菌群与健康人群存在差异。Nguyen等[15]研究显示,在门的水平上,与健康对照组相比,慢性精神分裂症患者的变形菌的丰度更低;在属的水平上,慢性精神分裂症患者的厌氧菌的丰度更高,而嗜血杆菌、萨特氏菌和梭状芽孢杆菌的丰度更低。这一结果为慢性精神分裂症患者肠道菌群组成的改变提供了证据。然而,Shen等[16]研究表明,在门的水平上,精神分裂症患者较健康人群的变形菌的丰度更高。变形菌门的富集被认为是一种肠道菌群紊乱的标志[17]。Zheng等[18]的研究显示,与健康人群相比,精神分裂症患者微生物群落α多样性指数更低,肠道微生物组成明显紊乱;研究者将精神分裂症患者和健康人群的粪便微生物群移植到无菌小鼠体内,结果显示,接受精神分裂症患者粪便微生物群移植的无菌小鼠海马谷氨酸含量更低,而谷氨酰胺和γ-氨基丁酸含量较高,表现出与精神分裂症相关的行为,谷氨酸能功能低下。张言武等[19]比较了发作期与缓解期精神分裂症患者肠道菌群的差异,结果显示,发作期患者较缓解期患者的菌群丰富度更低,拟杆菌属的丰度高于缓解期患者,普氏菌属的丰度低于缓解期患者。一项对未用药的老年首发精神分裂症患者与健康人群肠道菌群差异进行比较的研究表明,与健康人群相比,首发精神分裂症患者的拟杆菌属的丰度更高,双歧杆菌属的丰度更低[20]。上述研究表明,精神分裂症患者与健康人群的肠道菌群种类和丰度存在差异,提示精神分裂症患者可能存在肠道菌群失调。
2.4 精神分裂症患者肠道菌群失调对认知功能受损的影响
2.4.1 犬尿氨酸途径异常导致认知功能受损
Gao等[21]研究显示,拟杆菌属的丰度与大脑皮质中IL-6水平呈正相关,与认知功能水平呈负相关。师永齐等[22]研究显示,精神分裂症患者的血清IL-6、IL-10及TNF-α水平升高与肠道菌群失调密切相关。有研究表明,IL-6水平升高激活犬尿氨酸通路,导致N-甲基-D-天冬氨酸(NMDA)受体拮抗剂犬尿烯酸(Kyna)合成增加,影响脑内谷氨酸能/多巴胺能神经传递。Kyna是由犬尿氨酸氨基转移酶对犬尿氨酸进行氨基转移产生的色氨酸代谢产物,主要在神经胶质细胞中合成[23]。精神分裂症患者大脑中Kyna水平更高[24]。研究显示,Kyna在神经可塑性和认知功能的调节中起着重要作用[25]。Zhu等[26]研究显示,将精神分裂症患者的粪便微生物群移植到服用抗生素的小鼠体内,会导致小鼠出现行为异常,如精神运动过度活跃、学习和记忆受损等,与接受健康对照组粪便微生物群移植的小鼠相比,这些小鼠的外周和大脑中色氨酸降解的犬尿氨酸-犬尿喹啉酸(kynurenine-kynurenic acid)通路升高,Kyna合成增加。提示精神分裂症样行为与认知能力受损可能与色氨酸降解的犬尿氨酸通路有关。NMDA受体是一类谷氨酸受体,可调节记忆相关的突触形成。NMDA受体激动剂可以减轻动物模型中的阳性和阴性症状并改善认知功能受损情况[27]。故Kyna作为NMDA受体的拮抗剂可能与认知功能受损有关,基于此,可假设精神分裂症患者可以通过调整饮食结构来改善认知功能受损情况,如减少色氨酸摄入等,未来需要进一步的研究证实。
2.4.2 短链脂肪酸减少导致认知功能受损
肠道菌群中的拟杆菌属、双歧杆菌属等能够利用肠道中难以消化的碳水化合物进行无氧发酵,产生短链脂肪酸(Short-chain fatty acids,SCFAs)[28-29]。SCFAs主要包括乙酸、丙酸和丁酸,能够通过血脑屏障,影响中枢神经系统功能。一项关于轻度认知功能障碍患者肠道菌群特征分析的研究显示,肠道内变形菌门、乳酸杆菌等细菌富集,且乳酸杆菌高丰度与轻度认知障碍显著相关,肠道内乳酸杆菌丰度升高可以导致短链脂肪酸水平降低,这有可能是导致轻度认知功能损害的潜在机制[30]。另有研究表明,精神分裂症患者体内脂肪酸代谢和丙酮酸代谢途径与健康对照组存在差异[31]。自闭症谱系障碍患者粪便总游离脂肪酸含量高于健康人群[32],而总游离脂肪酸含量常与认知功能障碍相关。Hoffman等[33]研究显示,用益生元治疗阿尔茨海默病基因高危险因素小鼠(APOE4小鼠模型)后,小鼠主要SCFAs水平的增加与神经炎症减少有关。Furusawa等[34]和Smith等[35]的研究也表明,丁酸和丙酸对肠黏膜炎症过程的有益作用,可预防结肠炎小鼠发展为全身炎症和认知功能障碍。以上研究表明,短链脂肪酸减少可能导致认知功能受损;而精神分裂症患者相比于健康对照组,短链脂肪酸含量更低。但目前相关研究较少,未来可对精神分裂症患者短链脂肪酸减少与认知功能受损的关系进行深入研究。
2.4.3 肠道免疫紊乱导致认知功能受损
Wang等[36]研究显示,在阿尔茨海默症进程中,肠道菌群的改变与脑内浸润的免疫细胞具有相关性,而低分子酸性寡糖化合物甘露特钠可通过重塑肠道菌群平衡,降低外周组织相关代谢产物苯丙氨酸与异亮氨酸的积累,减轻脑内神经炎症,进而改善认知功能受损情况。目前,甘露特钠在我国已经被批准临床使用,主要用于治疗轻中度阿尔茨海默症。精神分裂症患者肠道菌群及其代谢产物异常,并与认知功能受损密切相关,即异常的代谢产物刺激外周免疫炎症,促使外周炎性免疫细胞向大脑浸润,使相关神经炎症发生,最终导致认知功能受损。由此可见,精神分裂症患者同样存在肠道免疫紊乱。新型药物甘露特钠能够重塑肠道菌群,减少异常代谢产物,阻止外周炎性免疫细胞向大脑的浸润,抑制神经炎症,从而改善认知功能受损情况,但甘露特钠是否可应用于改善精神分裂症患者认知功能受损情况的治疗中,需进一步研究证实。
3 小结和展望
精神分裂症患者存在肠道菌群失调,且研究表明,其肠道菌群失调与认知功能受损有关[3]。肠道菌群失调可能通过犬尿氨酸通路异常、短链脂肪酸减少以及肠道免疫紊乱三方面使精神分裂症患者认知功能受损,同时,这也为改善精神分裂症患者认知功能受损情况提供了思路。精神分裂症患者认知功能障碍与肠道菌群密切相关。在未来的研究中,可以借助甘露特钠的作用原理,靶向肠道菌群治疗,为寻找改善精神分裂症患者认知功能受损情况的新方法提供参考。

