微生物菌肥部分替代化肥对设施黄瓜产量和土壤细菌群落结构的影响
岳宏忠,张东琴,侯 栋,李亚莉,姚 拓,黄书超
(1 甘肃省农业科学院 蔬菜研究所,甘肃 兰州 730070;2 甘肃农业大学 a 草业学院/草业生态系统教育部重点实验室, b 园艺学院,甘肃 兰州 730070)
化肥是我国目前使用量最大的农业化学用品,其对增加土壤肥力和提高作物产量起着相当重要的作用,但同时也带来一系列问题,如农业生态系统被破坏、环境污染严重、作物果实品质下降以及食品安全性降低等[1-2]。同时,由于化肥滥用现象十分普遍,由此引发的土壤质量下降问题也引起了越来越多的关注[3]。随着最近几年国家农业农村部农药和化肥“双减”项目的推动,缓解黄瓜连作障碍和替代或部分替代化肥的绿色栽培方案也越来越多,其中微生物菌肥作为一种绿色环保的新型肥料,其部分替代化肥的试验已在诸多作物上开展,结果显示效果显著[4-6]。
土壤是一个复杂而又完整的微生态系统,其中物质能量转化、动植物残体分解等生化过程主要由细菌和真菌完成,可见土壤微生物对植株的生长发育至关重要[7-10]。一般而言,稳定性较好的土壤,微生物抵抗环境恶化的能力较强,微生物多样性和丰富度也较高。细菌作为土壤中数量最多、分布最广的微生物,其数量占土壤微生物总数的70%~90%,干质量约占土壤有机质的1%[11]。传统的微生物研究依赖于实验室培养,而16S rRNA基因高通量测序技术的兴起,填补了对在传统实验室中无法培养的微生物的研究空白,扩展了对微生物资源的利用空间,为研究微生物相互作用提供了有效工具[11-12]。
黄瓜是最常见的瓜类蔬菜之一,随着日光温室的发展,全国大部分地区均有种植。在我国北方地区,黄瓜种植多集中在日光温室和塑料大棚中,由于栽培技术、种植习惯等原因,连作问题十分常见,尤其在种植10年以上的设施菜田中,土壤养分失衡、病原菌增多、有益菌减少以及土壤板结等问题普遍存在,致使黄瓜严重减产,甚至有绝收的可能,这严重制约了黄瓜种植业的发展[13-15]。目前关于微生物菌肥替代化肥后对黄瓜产量和根际土壤细菌多样性影响的研究甚少,且微生物菌肥如何影响土壤质量以及其作用机理尚不清楚。故本试验以日光温室黄瓜种植地不同施肥处理土壤为研究对象,采用高通量测序技术分析各处理土壤细菌类群的组成特征,明确化肥、微生物肥料及土壤细菌类群间的互作关系,旨在为进一步探明微生物肥料的作用机理及生产中化肥减量、提质增效提供理论指导。
1 材料与方法
1.1 试验地概况
试验于2018年在甘肃省庆阳市华池县悦乐镇鸭洼村(N 35°39′,E 107°51′,海拔1 297 m)进行。该区属典型的黄土高原西部雨养农业区,年均降雨量573 mm,主要集中在7-9月份。试验所用日光温室长40 m、宽7.5 m,已种植蔬菜10 年以上,其中黄瓜已连续种植3年。本试验供试黄瓜采用嫁接栽培,砧木为黑籽南瓜,2018年10月5日播种育苗,15 d后嫁接, 11月8日定植于日光温室,第2年7月25日拉秧,全生育期290 d。温室内平均气温19 ℃,极端最低气温4 ℃,最高气温40 ℃。温室内耕作层土壤全盐含量1.55 g/kg,pH值8.23,土壤体积质量2.62 g/m3,有机质含量8.72 g/kg,全氮含量0.68 g/kg,全磷含量1.02 g/kg,全钾含量23.59 g/kg,碱解氮含量63.49 mg/kg,有效磷含量20.03 mg/kg,速效钾含量182 mg/kg,肥力水平中等。
1.2 试验材料
试验中微生物肥料为依托国家重点研发计划“露地蔬菜化肥农药减施技术集成研究与示范”项目研发、生产的成熟产品(含4种PGPR菌株,有效活菌数≥108CFU/g),以木炭粉和玉米芯按一定比例混合作为介质,已在燕麦、玉米、莴笋上进行了应用,生产单位为甘肃鸿远生物科技有限公司,技术支持单位为甘肃农业大学草业学院与甘肃省农业科学院蔬菜研究所。执行标准:NY/T 798-2015(农业部登记证号:微生物肥(2012)准字0887号)[4]。
供试黄瓜品种为“甘丰袖玉”,由甘肃省农业科学院蔬菜研究所培育。
试验所用化肥是由甘肃省农业科学院土壤肥料与节水灌溉农业研究所研制的蔬菜硫基长效复合肥,其N、P2O5、K2O含量之和≥48%,m(N)∶m(P2O5)∶m(K2O)=18∶16∶14。
1.3 试验设计
采用垄作栽培,垄行宽度80 cm,垄沟宽度40 cm,以垄行作为处理小区,以垄沟作为小区隔离,温室两端各设置保护行4垄。试验设6个处理:T1.100%化肥(2 400 kg/hm2);T2.60 kg/hm2微生物菌肥+80%化肥;T3.60 kg/hm2微生物菌肥+60%化肥;T4.60 kg/hm2微生物菌肥+40%化肥;T5.对照(CK,不施任何肥料);T6.单施60 kg/hm2微生物菌肥。每处理1个小区,小区面积0.8 m×7 m,随机区组排列,重复3次。各处理所用化肥在整地起垄时作为底肥撒施在相应垄面下,所用微生物菌肥在黄瓜定植时均分施入相应定植穴。其他田间管理措施与当地统一。
1.4 黄瓜产量测定与土壤样品采集
1.4.1 黄瓜产量测定 在黄瓜收获期,对每个小区分别采收黄瓜果实并称取质量,换算为每平方米产量,并计算各处理与对照(T5)相比的增产率。
1.4.2 土壤样品采集与处理 待黄瓜拉秧后,在试验小区0~20 cm土层处,采用5点取样法取样[16]。采样器先用酒精消毒,待酒精挥发后再取样,每个样点重复取3份土样用于土壤微生物DNA提取及后续相关指标测定。
1.5 土壤微生物总DNA提取和16S rRNA测序流程
将土样送往上海生工生物科技公司,利用OMEGA土壤DNA提取试剂盒提取土壤微生物总DNA。对提取到的基因组DNA进行琼脂糖凝胶电泳检测,查看基因组DNA的完整度与浓度,同时采用紫外分光光度计对DNA进行定量分析。采用16S rRNA基因高通量测序技术对各处理土样中细菌群落在门、纲、目、科、属水平上的组成、相对丰度及优势菌进行分析。16S rRNA基因的通用引物为314F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′),具体测序流程参考梁志婷等[17]的方法进行。
1.6 数据分析
获得原始的土壤细菌基因序列数据后,采用QIIME 1.8.0分析序列质量和OTUs数量[14];使用Qiime软件(Version 1.9.1)进行各处理土壤细菌Alpha多样性比较,其中包括Shannon指数、Simpson指数、Chao1指数和ACE指数;各处理土壤基于细菌属水平上相对丰度的主成分分析(PCA)采用Graphpad Prism 7.0软件,基于细菌门水平上相对丰度的聚类分析采用Mothur软件;用Excel 2007软件对各处理黄瓜产量数据进行整理,用SPSS 16.0进行Duncan’s多重比较分析(P<0.05)。
2 结果与分析
2.1 不同施肥处理土壤样品测序结果
土壤细菌群落高质量目标序列数和OTUs数见表1。由表1可知, 6种不同施肥处理共获得高质量目标序列474 639条。各样品经优化处理后,得到的高质量序列比例均高于80%,说明测序结果可靠,可进行下一步序列分析。

表1 不同施肥处理土壤细菌序列读数及OTUs数
2.2 不同施肥处理土壤细菌群落的Alpha多样性
Alpha多样性指数能够反映细菌群落的丰富度和均匀度。Shannon指数代表样品的多样性程度,其值越高表明群落物种的多样性越高;Simpson指数主要体现物种的优势度;Chao1和ACE指数主要反映细菌群落丰富度,其值越高表明群落物种的丰富度越高。如表2所示,由Shannon指数可知,不同施肥处理土壤细菌群落多样性表现为T1>T2>T4>T5>T6>T3;由ACE指数可知,群落丰富度为T4>T5>T6>T1>T3>T2。6个处理中, 仅T4处理土壤细菌群落的Shannon、Simpson、Chao1和ACE指数均高于对照(T5),分别较对照提高了2.83%,0.52%,3.63%和1.40%,说明微生物菌肥与适宜用量化肥配施能够明显提高土壤细菌群落的丰富度和多样性。

表2 不同施肥处理土壤细菌群落Alpha多样性比较
2.3 不同施肥处理土壤细菌的组成
图1~5是不同处理土壤细菌群落相对丰度在门、纲、目、科、属水平上的比较。由图1~5可以看出,在门水平上,优势细菌是变形菌门(Proteobacteria,平均相对丰度为25.69%)、放线菌门(Actinobacteria,22.29%)和厚壁菌门(Firmicutes,21.45%);在纲水平上,占优势的细菌是芽孢杆菌纲(Bacilli,21.33%)、Unidentified_Actinobacteria(11.42%)、α-变形菌纲(Alphaproteobacteria,11.13%)、嗜热菌纲(Thermoleophilia,7.05%)和β-变形菌纲(Betaproteobacteria,5.66%)等;在目水平上,占优势的细菌是乳杆菌目(Lactobacillales,20.09%)、土壤红杆菌目(Solirubrobacterales,4.64%)、鞘脂单胞菌目(Sphingomonadales,4.91%)、黄色单胞菌目(Xanthomonadales,3.30%)、根瘤菌目(Rhizobiales,3.37%);在科水平上,优势细菌是链球菌科(Streptococcaceae,19.23%)、芽单胞菌科(Gemmatimonadaceae,3.21%)、亚硝化单胞菌科(Nitrosomonadaceae,3.06%)、鞘酯菌科(Sphingomonadaceae,2.78%);优势细菌属是乳球菌属(Lactococcus,18.65%)、鞘脂单胞菌属(Sphingomonas,2.31%)、鞘氨醇单胞菌(Pseudarthrobacter,1.41%)。随着微生物菌肥施用比例的增加,厚壁菌门、芽孢杆菌纲、乳杆菌目、链球菌科、乳球菌属相对丰度均呈先升高后降低的趋势,其中T3处理以上优势菌相对丰度占比较高。

图1 不同施肥处理土壤细菌门水平上相对丰度的比较

图2 不同施肥处理土壤细菌纲水平上相对丰度的比较
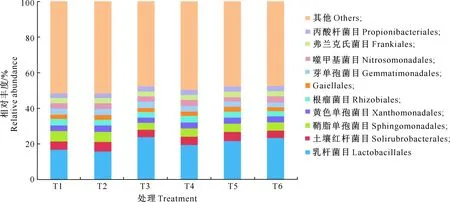
图3 不同施肥处理土壤细菌目水平上相对丰度的比较
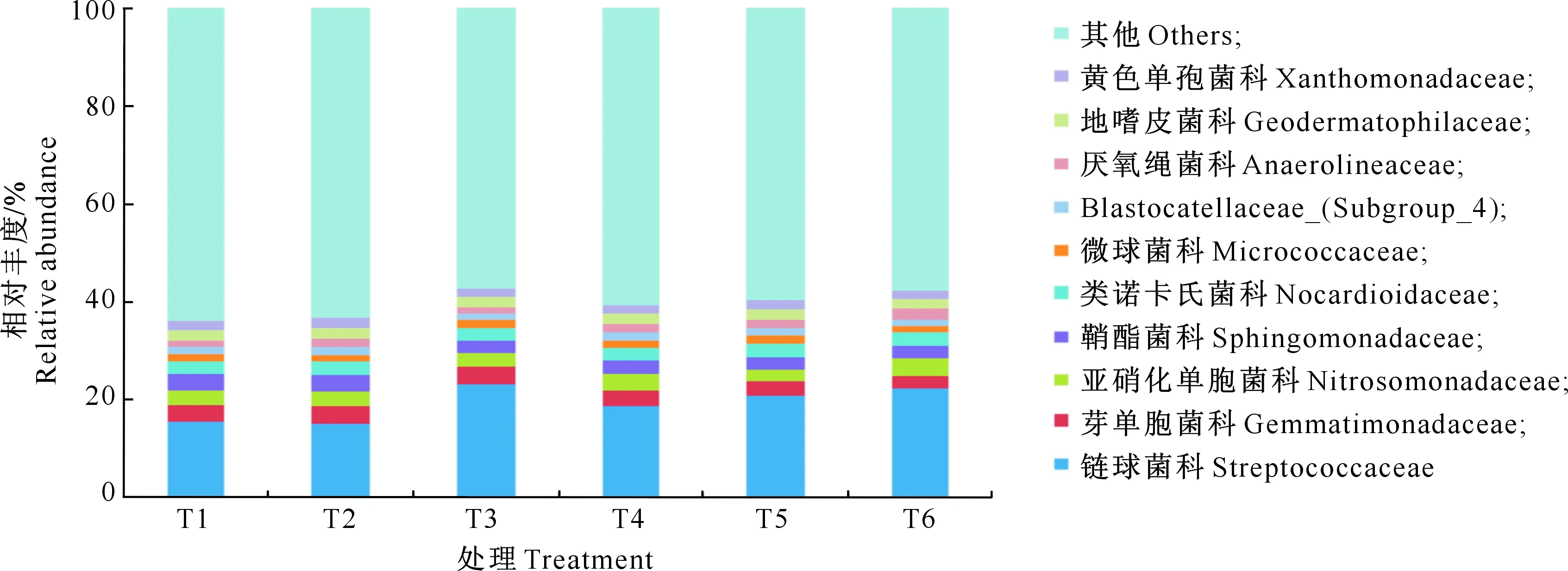
图4 不同施肥处理土壤细菌科水平上相对丰度的比较

图5 不同施肥处理土壤细菌属水平上相对丰度的比较
2.4 不同施肥处理土壤细菌属水平相对丰度的主成分分析
主成分分析结果(图6)显示,不同施肥处理属水平上土壤细菌物种相对丰度共提取到5个主成分,其中第1主成分(PC1) 和第2主成分(PC2)的贡献率分别为20.18%和18.00%,二者累积贡献率为38.18%。
由图6还可知,施用化肥和微生物菌肥的各处理与不施任何肥料的处理,土壤细菌主要组成有比较明显的差别,其中T1、T2、T4及T3处理土壤细菌种类分布在第二和第四象限; T6和对照T5处理分布在第一象限。可知微生物菌肥与化肥配施能够显著改变土壤细菌群落属水平的组成,但不同用量化肥与微生物菌肥配施效果差异较大。
2.5 不同施肥处理土壤细菌组成门水平的聚类分析
如图7 所示,在门水平上,不同施肥处理土壤细菌的组成可聚为3大类,其中T1和T5处理聚为一类,T2和T3处理聚为一类,T4和T6处理聚为一类。三大类相比,T4和T6处理土壤各细菌门水平相对丰度与其他两类差别较大。同时,不同施肥处理土壤细菌门水平相对丰度不同,但是基本组成种类保持稳定,都是以厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、奇古菌门(Thaumarchaeota)等为主。
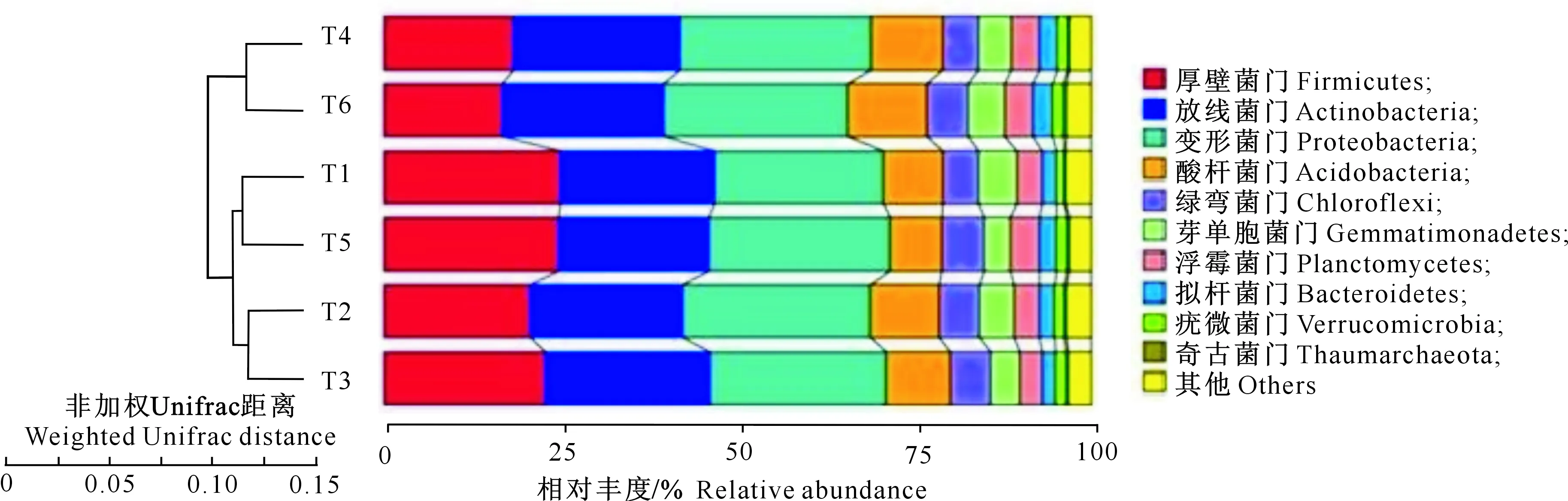
图7 不同施肥处理土壤细菌组成门水平聚类分析
2.6 不同施肥处理对黄瓜产量的影响
表3显示,各处理产量由大到小依次为T2>T3>T4>T1>T6>T5,T2、T3、T4、T1、T6较对照T5分别增产15.33%,14.25%,9.90%,8.67%和8.01%,其中T2、T3增产达显著水平;在施用相同微生物菌肥水平下,随着化肥施用量的减少,黄瓜产量逐渐降低,但各处理间差异不显著;说明施用微生物菌肥(60 kg/hm2)可以替代20%~40%的化肥,且能够达到一定的增产效果。
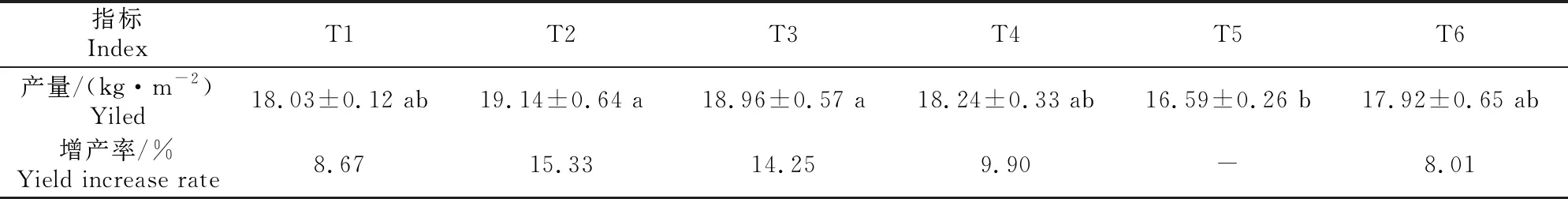
表3 不同施肥处理对黄瓜产量的影响
3 讨 论
土壤生物多样性是土壤健康和农业可持续发展的重要影响因素。 微生物多样性是反映微生物与土壤环境间相互关系的指标,不同施肥方式均能改变土壤微环境[18]。研究表明,施用微生物菌肥可显著提高土壤微生物群落多样性,促进有益菌的增殖[19-20]。本研究发现,微生物菌肥与适宜用量化肥配施能影响土壤细菌群落的丰富度和多样性,其中T4处理土壤细菌群落Alpha多样性指数总体较高。丰富的微生物多样性和丰富度会维持稳定的土壤微生态环境,是土壤健康的标志之一[21]。研究发现,在细菌多样性较高的土壤中病原菌难以生长繁殖,并且微生物还能够分泌生长活性物质、释放土壤酶、催化氧化还原反应、促进有机质矿化和污染物降解等[22-23]。微生物菌肥与化肥配施,会改善土壤环境,这可能是由于PGPR微生物菌肥对病原菌具有重寄生作用,并且会在代谢过程中产生具有抑菌活性的抗生物质[24-27],从而抑制土壤中病原菌的生长繁殖,促进有益菌占据更多的生态位点。如本研究中,PGPR微生物菌肥与60%化肥配施(T3)处理后,与植物共生的有益菌芽孢杆菌纲的相对丰度较对照显著增加,促进了土壤健康发展,最终有利于作物生长。
本试验中,在门水平上,PGPR微生物菌肥与不同用量化肥配施对土壤细菌群落结构的影响并不相同,虽然各处理间有相似的优势菌群,例如变形菌门、放线菌门和厚壁菌门,但各处理间厚壁菌门相对丰度差异较大。李海云等[28]发现,东祁连山不同退化程度高寒草地土壤中细菌优势菌群为酸杆菌门、变形菌门、厚壁菌门及放线菌门,与本研究优势菌群十分接近,表明变形菌门、放线菌门、厚壁菌门可能是不同生态系统常见的土壤细菌优势门类[29]。本研究中,微生物菌肥与化肥配施处理细菌群落结构虽存在差异,但优势菌群组成基本相同,说明微生物菌肥和化肥配施未达到引起微生物群落结构显著变化的阈值,这与游偲等[30]施用枯草芽孢杆菌菌肥对烟草根际土壤细菌群落结构及多样性的影响结果类似。
本研究发现,微生物菌肥与60%化肥配施后,土壤中有益菌(厚壁菌门、芽孢杆菌纲、乳杆菌目、链球菌科、乳球菌属)的相对丰度均有所提高,菌群结构得以改善,这为解决连作障碍问题提供了参考。在设施生产过程中,栽培管理不当、农药和化肥的不合理施用等易造成连作障碍,尤其化肥的盲目施用,抑制了有益微生物的繁殖[31],使连作障碍几乎无法避免[32]。近年来运用PGPR解决连作障碍问题已经成为研究热点并且成效显著[25-27,31]。有研究表明,施用微生物菌肥不仅会促进黄瓜营养生长,而且还可提高产量和果实中维生素C、可溶性糖含量等[33]。王归鹏等[5]研究发现,施用微生物菌肥不仅可以提高基质中的养分含量和基质酶活性,还可显著提高番茄产量。此外,PGPR微生物菌肥对辣椒、番茄的生长和产量也有明显的促进作用[34]。本研究结果表明,80%~60%化肥与PGPR微生物菌肥配施后,黄瓜产量较对照(T5)显著增加,且效果优于单施化肥(T1)或单施微生物菌肥(T6)的处理。究其原因,一方面是由于微生物菌肥代谢产生的一系列酶或有机酸可对土壤中难溶性的磷、钾肥进行分解,从而将其转化为植物所能吸收的磷、钾肥;另一方面,尽管化肥肥效快、养分含量高,但是化肥利用率低,易挥发和流失,并造成土壤板结;而微生物菌肥与化肥配施后,延长了土壤中有效养分的供给,保证了养分释放周期与作物生育周期的协调性,有利于黄瓜根系对养分的吸收,从而促进干物质的积累。
综上可知,在减施20%~40%化肥时施用适量微生物菌肥,不仅能够提高土壤细菌多样性,还能增加土壤有益菌的相对丰度,同时也能达到一定的增产效果。

