同源盒基因10调控胰岛素样生长因子结合蛋白3与肠癌细胞5-氟尿嘧啶抵抗的关系研究
张言言,韩 刚,曹 羽,张 云,张 旭,胡 建,龚航军
(上海中医药大学附属曙光医院胃肠外科,上海 200021)
结直肠癌为全球病死率第四癌症,约占全球因肿瘤或肿瘤相关疾病死亡人数的10%[1]。对于进展期的结直肠癌,根治效果较差。以5-氟尿嘧啶(5-Fu)为主的化疗对于预防肿瘤复发转移和提高患者生存率具有一定的作用,但是由于耐药问题而出现化疗失败[2-5]。因此,开展分子靶点研究有助于增强化疗药物疗效,提高患者生存率。
同源盒基因(Homeobox gene,HOXD)家族近年来报道为靶向致癌相关蛋白的重要转录因子[6-10],其中HOXD10被认为是负调节结直肠癌转移的主要效应物,其表达受DNA甲基化的调控,在结直肠癌中出现高甲基化低mRNA表达的情况[11-15]。此外,有文献报道胰岛素样生长因子结合蛋白3(Insulin-like growth factor binding protein 3,IGFBP3)是HOXD10的转录靶点,而IGFBP3作为胰岛素样生长因子通路的主要结合分子,在结直肠癌的发生发展中也发挥着重要的作用[16-17]。尽管HOXD10-IGFBP3调控轴在结直肠癌进展中起到关键作用,但是否与化疗药物抵抗有关,目前报道较少。
本研究拟分析HOXD10和IGFBP3在原代肠癌细胞及耐药株细胞中表达情况,证实HOXD10和IGFBP3在肠癌中的调控关系,明确HOXD10- IGFBP3调控轴对肠癌耐药表型的影响,为肠癌患者精准化疗提供干预靶点。
1 材料与方法
1.1 实验材料 人结直肠癌细胞SW480购自中国科学院上海生命科学院细胞资源中心;DMEM高糖培养基购自美国Hyclone公司;胎牛血清、胰酶购自美国Gibco公司;细胞用青霉素和链霉素购自上海碧云天生物技术有限公司;总RNA分离提取试剂TRIzol购自美国Invitrogen公司; siRNA转染试剂Lipofectamine TM 3000试剂购自美国Invitrogen公司;逆转录-实时荧光定量PCR检测试剂盒购自日本TaKaRa公司;RIPA裂解液、BCA蛋白定量检测试剂盒、鼠抗人GAPDH单克隆抗体及辣根过氧化物酶(HRP)标记的抗鼠及抗兔二抗购自上海碧云天生物技术有限公司;ECL化学发光试剂盒购自Millipore公司;HOXD10、IGFBP3蛋白一抗购自CST公司;引物、siRNA及HOXD10过表达质粒由上海吉玛制药技术有限公司合成;5-Fu购自美国Sigma-Aldrich公司。
1.2 实验方法
1.2.1 细胞培养及5-Fu耐药株获得:人结直肠癌细胞SW480购自中国科学院上海生命科学院细胞资源中心。用含10%胎牛血清、100 μg/ml 链霉素和 100 U/ml青霉素的DMEM高糖培养液,置于27 ℃、5% CO2的培养箱中培养。收集对数生长期的细胞用于后续实验。5-Fu用DMSO配成母液后分装冻存。候选试验将母液用DMEM稀释配制。本实验室采用较大剂量间歇诱导法进行筛选,再采用浓度梯度递增法作用,至SW480细胞可长期在5-Fu浓度为2.0 mg/L的细胞培养液中稳定生长。
1.2.2 实验分组:根据SW480肠癌细胞对5-Fu是否耐药,分为5-Fu耐药细胞组和5-Fu原代细胞组。对于靶基因敲减实验:①HOXD10敲减,分为对照组(NC)即siRNA阴性对照,以及2条HOXD10 siRNA敲减组分别为siHOXD10-1和siHOXD10-2。②IGFBP3的敲减,分为对照组(NC)即siRNA阴性对照,以及2条IGFBP3 siRNA敲减组分别为siIGFBP3-1和siIGFBP3-2。对于靶基因过表达试验,分为空载转染(EV)及HOXD10过表达(pCMV-HOXD10)组。
1.2.3 siRNA、过表达质粒构建及细胞转染:siRNA阴性对照序列为5’-UUCUCCGAACGUGUCACGU-3’。HOXD10的2条特异siRNA序列分别为siHOXD10-1:5’-CCGAACAGAUCUUGUCGAATT-3’;siHOXD10-2:5’-GAUAAGCGCAACAAACUCATT-3’。IGFBP3的2条特异siRNA序列分别为siIGFBP3-1:5’-GCACAGAUACCCAGAACUUUU-3’;siIGFBP3-2:5’-GCACAGAUACCCAGAACUU-3’。空载质粒为pcDNA3.1,并在此质粒上构建HOXD10过表达载体。siRNA及所有载体转染肠癌细胞株按脂质体转染试剂Lipofectamine 3000说明书进行操作。
1.2.4 实时荧光定量PCR:总RNA提取、逆转录及荧光定量PCR按试剂盒说明书操作。Real-time定量PCR条件为95 °C 10 min后,95 °C 15 s,60 °C 1 min,40 循环。Real-time定量PCR使用ABI 7500仪器进行。根据待测标本的Ct值,以GAPDH作为内参照,采用2-△△Ct法计算相对表达倍数变化。其中各基因引物为HOXD10:F:5’-GACATGGGGACCTATGGAATGC-3’,R:5’-TGGTGGTTCACTTCTCTTTTGG-3’;IGFBP3:F:5’-GGCAGATGAAGCAGGATGTA-3’,R:5’-GACAGCAGTGTCTTGTTGTTG-3’;GAPDH:F:5’-GACCTGACCTGCCGTCTA-3’,R:5’-AGGAGTGGGTGTCGCTGT-3’。
1.2.5 蛋白免疫印迹(WB):采用RIPA裂解每组样品抽提总蛋白,根据BCA试剂盒说明书进行蛋白定量。每组细胞取50 μg蛋白上样,在10%的SDS-PAGE中进行电泳2 h,然后将蛋白转膜至甲醇预处理的PVDF膜1 h,以5%脱脂奶粉在室温下封闭1 h,加入1∶1000稀释的一抗,4 ℃孵育过夜,次日PBST漂洗3次,每次10 min,加入1∶5000稀释的HRP标记的二抗室温孵育2 h,PBST漂洗3次,每次10 min后,用ECL化学发光液曝光显色。
1.2.6 CCK-8实验:对照组及处理组胰腺癌细胞以1×105细胞接种96孔板,加入CCK-8溶液(10 μl/孔),继续培养4 h。通过酶标仪测量该样品在450 nm处的吸光度值。
1.2.7 细胞克隆形成实验:取对数生长期细胞以500个/孔细胞接种与6孔板,培养7~14 d,待有单克隆生长进行4%多聚甲醛固定,0.2%结晶紫染色,用水洗涤,晾干,照片计数。

2 结 果
2.1 耐药细胞组与原代细胞组对5-Fu敏感性比较 利用CCK-8实验,发现SW480耐药株在各5-Fu浓度下(2.5、5、10 μg/ml)的增殖活性,与0 μg/ml的5-Fu增殖活性无统计学差异(均P>0.05)。而原代SW480细胞在5 μg/ml的增殖活性出现下降,与0 μg/ml的5-Fu增殖活性相比有统计学差异(均P<0.01)。见表1。

表1 原代及耐药细胞组在不同5-Fu浓度下细胞增殖活性比较
2.2 HOXD10及其靶基因IGFBP3在耐药细胞组及原代细胞组中表达的比较 qPCR结果表明耐药细胞组HOXD10的相对表达倍数(0.51±0.096)与原代细胞组(1.00±0.091)比较下调,两组表达比较有统计学差异(t=6.486,P=0.0029);而耐药细胞组的IGFBP3相对表达倍数(4.21±0.32)显著高于原代细胞组(1.00±0.22),两组表达比较有统计学差异(t=14.12,P=0.0001)。WB也证实了耐药细胞组较原代细胞组有较低的HOXD10和更高的IGFBP3表达水平(图1)。

图1 原代及耐药细胞组HOXD10、IGFBP3表达
2.3 过表达或敲减HOXD10水平对IGFBP3表达的影响 我们成功在原代细胞组中进行HOXD10的敲减,2条siRNA均减低HOXD10表达水平,同时IGFBP3的表达水平较对照组增高(图2)。此外,我们在耐药细胞组中过表达HOXD10,IGFBP3的表达水平较对照组显著减低(图3)。
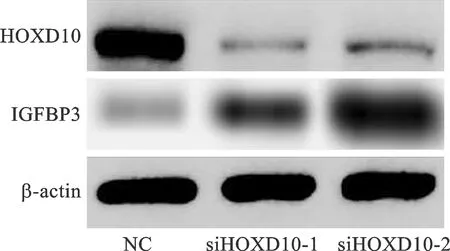
图2 原代细胞组敲减后IGFBP3表达变化

图3 耐药细胞组过表达后IGFBP3表达变化
2.4 敲减IGFBP3对5-Fu诱导作用耐药细胞组增殖活性的影响 如图4所示,IGFBP3两条特异性siRNA转染耐药组细胞,并成功敲减IGFBP3的表达水平。我们将对照组及两个敲减组细胞进行各浓度的5-Fu处理,利用CCK-8发现:NC组各浓度处理下的细胞增殖活性比较无统计学差异(均P>0.05),siIGFBP3-1组细胞在5 μg/ml浓度下出现细胞增殖活性下降,与0 μg/ml浓度比较有统计学差异(P<0.05),siIGFBP3-2组细胞在2.5 μg/ml浓度下出现细胞增殖活性下降,与0 μg/ml浓度比较有统计学差异(P<0.05),见表2。细胞克隆试验表明:siIGFBP3-1组细胞(克隆形成数:12.00±2.00个)及在siIGFBP3-2组细胞(克隆形成数:9.00±2.00个)在5 μg/ml的5-Fu浓度下的克隆形成数,与对照组(克隆形成数:45.00±3.00个)比较,显著减少(siIGFBP3-1组细胞与对照组比较,t=21.53,P<0.0001;siIGFBP3-1组细胞与对照组比较t=23.45,P<0.0001),见图5。

图4 在耐药组中转染IGFBP3两条siRNA后IGFBP3的表达变化

表2 对照组、siIGFBP3-1及siIGFBP3-2组耐药细胞在不同5-Fu浓度下细胞增殖活性比较

图5 对照组、siIGFBP3-1及siIGFBP3-2组耐药细胞在5 μg/ml的5-Fu浓度下的克隆形成数比较(结晶紫染色,×4)
2.5 过表达HOXD10对5-Fu诱导作用耐药肠癌细胞株增殖活性的影响 如表3所示,空载转染耐药细胞株在各药物5-Fu浓度下与0 μg/ml细胞增殖活性比较无统计学差异(P>0.05),HOXD10过表达耐药细胞株在5~10 μg/ml浓度下细胞增殖活性下降,与0 μg/ml细胞增殖活性比较有统计学差异(P<0.0001)。细胞克隆试验表明(图6),在耐药细胞中过表达HOXD10后,耐药细胞组在5 μg/ml细胞克隆数(6.00±1.00个)显著减低,与空载转染耐药细胞组克隆形成数(45.00±2.00个)相比显著较少,比较有统计学差异(t=30.21,P<0.0001)。

表3 空载转染及HOXD10过表达耐药细胞组在不同5-Fu浓度下细胞增殖活性的比较

图6 空载转染及HOXD10过表达耐药细胞在5 μg/ml的5-Fu浓度下的克隆形成数比较(结晶紫染色,×4)
3 讨 论
结直肠癌耐药抵抗是临床亟待解决问题,本研究揭示了HOXD10及其靶基因IGBPF3在肠癌5-Fu耐药株中的重要作用。本实验室前期成功获得了5-Fu耐药的肠癌细胞株SW480。此耐药株在5-Fu各药物浓度(5~20 μg/ml)下与0 μg/ml的5-Fu增殖活性无显著变化,而原代细胞则显著下降,表明本研究耐药组诱导成功,可用于候选研究。近年研究发现,HOXD10在包括肠癌在内的如肾癌、宫颈癌、子宫内膜癌、消化道等多种实体肿瘤中表达失活[11-17],并且过表达HOXD10可发挥如细胞增殖抑制、转移和侵袭减低等抑癌活性。本研究揭示HOXD10表达在肠癌耐药株细胞比原代细胞更低;同时在耐药株中过表达HOXD10后,耐药株对5-Fu敏感性增强,细胞克隆形成能力显著减低,表明HOXD10与肠癌5-Fu抵抗有着密切联系。
既然HOXD10与肠癌细胞5-Fu敏感性有关,那么HOXD10作为转录因子可能通过调控其靶基因发挥生物学作用。近年有文献报道,HOXD10可在肿瘤细胞内结合IGFBP3启动子,抑制其转录表达[15-16]。高水平IGFBP-3被广泛认为与肿瘤转移和侵袭有关[18-20],但在肠癌5-Fu报道研究较少。本研究发现IGFBP-3在耐药组中表达较原代细胞表达更高,提示IGFBP3在耐药抵抗起到关键作用。为确认HOXD10在肠癌耐药株中对IGFBP3的调控作用,我们在耐药组细胞中过表达HOXD10,结果发现IGFBP3表达水平被显著抑制;而我们在原代细胞中敲减HOXD10后,IGFBP3的表达水平明显增加,上述结果证实了HOXD10-IGFBP3调控轴的确在肠癌耐药株中存在。
那么IGFBP3是否与肠癌耐药表型有关呢?我们在耐药组中进行IGFBP3敲减,结果发现耐药组对5-Fu敏感性增强,细胞增殖活性显著减弱,细胞克隆形成能力下降,表明IGFBP3高水平与维持肠癌耐药表型有紧密联系,而高水平IGFBP3由于失去低水平表达HOXD10调控有关。
综上所述,肠癌耐药株与原代细胞相比具有低水平的HOXD10及更高表达的IGFBP3。在肠癌原代细胞及耐药细胞中调节HOXD10表达可显著影响IGFBP3的表达。肠癌耐药株中过表达HOXD10或敲减IGFBP3可增强耐药株对5-Fu的敏感性,靶向作用HOXD10-IGFBP3调控轴可能在减缓肠癌5-Fu化疗抵抗及增强治疗效果中具有临床转化价值。

