代森锌及其代谢物在芒果中的残留与膳食风险评估
朱富伟,叶 倩,黄聪灵,孟华岳,唐雪妹,万 凯
(广东省农业科学院 农业质量标准与监测技术研究所,农业农村部农产品质量安全风险评估实验室(广州),农业农村部农产品质量安全检测与评价重点实验室,广东 广州 510640)
芒果(MangiferaindicaL.)原产于印度,属于漆树科(Anacardiaceae)芒果属(MangiferaLinn.)常绿大乔木。其果实富含维生素 C、类胡萝卜素、矿物盐和碳水化合物等,果肉多汁,美味可口,还兼具治疗晕眩、镇咳、预防心血管疾病、有效降低甘油三酯和胆固醇含量、抗养化、提高视力和延缓细胞衰老等功效[1-3],目前已成为世界上最受欢迎、消费量最大的水果之一,在全球水果产量中排名第五[4]。我国作为世界第二大芒果产区, 2018年种植面积约26.7万hm2,年产值超过100 亿元,已成为我国部分地区的支柱产业[5]。然而,随着种植面积的不断增加,病虫危害也日趋严重,芒果种植过程中农药的不合理使用导致农药残留问题日益凸显[6]。
乙撑双二硫代氨基甲酸盐(ethylene-bisdithiocarbamates,EBDCs)类农药具有强金属鳌合性,在农业生产中作为一类重要的保护性杀菌剂已应用于果树、蔬菜等农作物[7-10],具有高效、低毒、对人畜和植物安全、不易诱发病原物抗药性及防治植物病害广谱等优点,对多种真菌性植物病害(如霜霉病菌、晚疫病菌、叶斑病菌及炭疽病菌等)有较强触杀作用[11]。EBDCs的出现标志着杀菌剂从无机到有机的重要发展[12-13]。近年来,EBDCs类农药在全球的使用量逐渐增加,对其在环境中的主要代谢产物乙撑硫脲(etylenethiourea,ETU)的毒理学进行深入研究后发现,其能够破坏大鼠体液活性,诱导甲状腺形态改变[14],并且具有致畸、致癌、致突变的作用[15-16]。EBDCs类农药的使用不仅严重破坏了生态环境,还会通过食物链对人及动物的健康造成危害[17]。因此,评估其在相关作物上的残留对人类带来的健康风险,制定相应的残留限量标准,可为科学合理地确定其使用量和使用频率提供依据。
代森锌作为EBDCs类杀菌剂的代表,依据GB/T 2763-2019,对其残留物的定义是二硫代氨基甲酸盐(或酯),以二硫化碳(CS2)表示。而依据农药残留联合专家会议(JMPR)报告,代森锌的残留物被定义为二硫代氨基甲酸盐(或酯),以CS2和ETU之和表示[18-20]。目前代森锌在食品特别是农产品中的残留量常以酸解产生的CS2来表示[21],即以CS2的检测量折算代森锌残留量,而缺少对其代谢物ETU的检测。在进行风险评估时,代森锌残留量也只采用CS2的检测量,而缺少结合代谢物ETU的综合评估。另外,我国尚未确定代森锌在芒果中的最大残留限量值。因此,本研究基于代森锌酸解可生成CS2的原理,分别采用气相色谱(GC)、液相色谱-串联质谱(LC-MS/MS)及优化的样品前处理技术,建立芒果中代森锌(以CS2表示)及其代谢物ETU的检测方法,并在海南海口、广西南宁、云南玉溪、福建宁德、广东肇庆和广东惠州等6个芒果主栽区进行65.0%代森锌可湿性粉剂残留试验,研究代森锌及其代谢物ETU在芒果中的残留动态,评估其通过膳食途径摄入的风险,为生产中指导科学用药和初步制定芒果中代森锌最大残留限量提供参考。
1 材料与方法
1.1 仪器与试剂
气相色谱仪(GC-2010 Plus)、液相色谱-串联质谱联用仪(LCMS-8050三重四级杆串联质谱仪),日本岛津公司;Milli-Q超纯水器,美国Millipore公司;Multi Reax自动涡旋仪,德国Heidolph公司;高速离心机,湖南湘仪实验室仪器开发有限公司;代森锌标准品(200 mg,纯度≥75%)、二硫化碳标准品(500 mg/mL,纯度≥99.1%)、ETU标准品(100 mg/L,纯度≥99.1%),农业部环境质检中心(天津)提供;乙腈、正己烷、甲酸,均为色谱纯,Merk公司;无水MgSO4、NaCl,均为分析纯,广州化学试剂厂;石墨化碳黑吸附剂(GCB),北京恩加壹科技有限公司。
1.2 田间试验
田间试验设计参考《农药残留试验准则(NY/T 788-2004)》和《农药登记残留田间试验标准操作规程》[22-23]。2017年6-12月,在海南海口(台农)、广西南宁(桂七)、云南玉溪(金凤凰)、福建宁德(本地芒)、广东肇庆(本地芒)、广东惠州(本地芒)进行试验;供试药剂为65.0%代森锌可湿性粉剂(深圳诺普信农化股份有限公司),芒果炭疽病发生期施药。
1.2.1 代森锌消解动态试验 该试验只在云南玉溪和广东肇庆进行。供试芒果树共有9株,每3株为1个重复。于芒果生长至成熟个体近50%时,对芒果整株一次性喷施剂量为1 600 mg/kg的65.0%代森锌可湿性粉剂,施药时注意全株均匀着药,喷药量以药液即将从树叶下滴为度。另设清水空白对照。药后间隔2 h及1,3,5,7,10,14,21,28 d时分别采集芒果样本。
1.2.2 代森锌最终残留试验 分别设置65.0%代森锌可湿性粉剂1 143和1 600 mg/kg 2个剂量,每个剂量设2次和3次施药,共计4个处理。试验设置4个小区,每个小区9株芒果树,每3株为1个重复,且每个小区内芒果树采用同一种处理方式,4个处理小区之间设隔离保护区,另设清水空白对照。于芒果收获期前35 d开始第1次施药,施药间隔期7 d,每次施药量以药液即将从树叶下滴为度。末次施药后间隔10,14和21 d采集芒果样本。
1.2.3 样本采集与制备 按照试验设计中的采样时间,在试验小区每株芒果树的不同方向及上、中、下、里、外等不同部位随机采集6~12个(总质量不少于2 kg)生长正常、无病害、成熟的芒果果实,带回实验室采用四分法缩分后取样,放入植物组织捣碎机中捣碎匀浆,最终分取150~200 g样品装入封口容器中,于-18 ℃冷冻保存备用。
1.3 分析方法
1.3.1 GC检测样品的前处理 准确称取匀浆的芒果样品5.0 g于50 mL顶空瓶中,依次加入0.05 g抗坏血酸、5 mL蒸馏水、20 mL SnCl2-HCl 溶液(5 mol/L)和5 mL正己烷,迅速用聚四氟乙烯和硅胶垫密封,放入80 ℃水浴中反应2 h,每隔15 min振荡1 min,反应完成后冷却至室温,吸取上层有机相过0.22 μm微孔尼龙滤膜,待测。
1.3.2 LC-MS/MS检测样品的前处理 准确称取匀浆的芒果样品10 g于50 mL具塞离心管中,加入10 mL氨水/乙腈混合液(2%,10 mL乙腈+200 μL氨水),涡旋5 min,4 500 r/min离心5 min,取上清液,残渣使用上述方法复提一次,合并上清液。上清液中加入1 g NaCl、2 g MgSO4干燥,涡旋1 min,4 500 r/min离心5 min,取上清液1.5 mL于2 mL离心管(内含20 mg GCB净化)中涡旋1 min,静置2 min,上清液过0.22 μm微孔尼龙滤膜,待测。
1.3.3 GC条件(用于CS2检测) 色谱柱:Agilent DB-1色谱柱(50 m×0.32 mm×1.05 μm);进样口150 ℃,柱温50 ℃,检测器200 ℃;氢气60 mL/min,空气90 mL/min;进样量1 μL,分流进样,分流比5.0;总流量21.0 mL/min,柱流量3.0 mL/min。
1.3.4 LC-MS/MS条件(用于ETU检测) 色谱柱:岛津Shim-pack XR-ODSⅢ(2.0 mm×150 mm,1.6 μm);柱温40 ℃;流速0.20 mL/min,进样量1 μL,流动相为乙腈(B)和0.1%甲酸水(A);洗脱梯度:0~1.0 min.98% A,1.0~5.0 min.98%~5%A,5.0~8.5 min.5%~98% A;离子源:电喷雾离子源ESI;扫描方式:正离子源;加热模块400 ℃;脱溶剂温度250 ℃;雾化器气流量3 L/min;干燥气流量10 L/min;检测方式:多重反应检测。ETU质谱检测参数如表1所示。

表1 ETU质谱检测参数
1.3.5 标准溶液配制及标准曲线制作 (1)CS2。用芒果(全果和果肉)基质将500 mg/mL的CS2标准溶液配制成0.027 5,0.05,0.1,0.2,0.5,1.0和2.0 mg/L的系列标准溶液,在1.3.3节所述GC条件下进行测定,以CS2质量浓度对数为横坐标(x)、对应色谱峰面积对数为纵坐标(y)制作标准曲线。
(2)ETU。用芒果(全果和果肉)基质将100 mg/L的ETU标准溶液配制成0.001,0.005,0.01,0.05,0.1,0.2,0.5和1.0 mg/L的系列标准溶液,在1.3.4节所述LC-MS/MS条件下进行测定,以ETU标准溶液质量浓度为横坐标(x)、监测离子峰面积为纵坐标(y)制作标准曲线。
1.3.6 添加回收试验 (1)代森锌(以CS2表示)。分别在空白芒果(全果和果肉)样品中添加代森锌标准溶液,使其含量分别为0.1,0.5和2.0 mg/kg,每个添加水平设置5个重复,用1.3.3节所述分析方法测定回收率,并计算相对标准偏差。
(2)ETU。分别在空白芒果(全果和果肉)样品中添加ETU标准溶液,使其含量分别为0.01,0.1和0.5 mg/kg,每个添加水平设置5个重复,用1.3.4节所述分析方法测定回收率,并计算相对标准偏差。
1.4 代森锌膳食风险评估
1.4.1 残留量计算与表述 1933年,农药残留联合专家会议(JMPR)规定了EBDCs类农药(代森锰锌、代森锰、代森联和代森锌)的每日允许摄入量(ADI值)为0.03 mg/kg,其代谢物ETU的ADI值为0.004 mg/kg,并定义母体(EBDCs类农药)及ETU的残留量以毒性对等的原则按照ADI值的比例(7.5)用于膳食评估[20]。
代森锌残留量=CS2×1.81+ETU×7.5,其中1.81=代森锌的分子质量/CS2的分子质量。
1.4.2 膳食风险评估 参考简秋等[24]的风险评估指南,计算代森锌和ETU在芒果中的国家估算每日摄入量(national estimated daily intake,NEDI,mg)和风险概率(risk probability,RP,%),具体计算公式如下:
NEDI=∑(STMRi×Fi);
(1)
RP=[NEDI/(ADI×BW)]×100%。
(2)
式中:STMRi(supervised trials median residue,mg/kg)表示农药在某一食品中的规范残留试验中值;Fi(kg)表示一般人群对某一食品的消费量;ADI(acceptable daily intake,mg/kg)表示某种农药每日允许摄入量;BW(kg)表示人体质量,本研究取63[24-25]。
1.5 数据统计与分析
采用Excel 7.0和Origin 8.0软件对试验数据进行分析和绘图。
2 结果与分析
2.1 代森锌(CS2)和乙撑硫脲(ETU)在芒果中的线性范围及检出限
2.1.1 代森锌(CS2) 按照1.3.3节中的检测方法,以CS2的质量浓度对数为横坐标(x)、对应色谱峰面积对数为纵坐标(y), 得到CS2的双对数标准曲线。结果表明,CS2质量浓度为0.027 5~2.0 mg/L时,其质量浓度对数(x)与对应色谱峰面积对数(y)的线性关系良好,线性回归方程为y=1.287 7x+14.222 9(r=0.996 3,芒果全果)和y=1.295 9x+14.582 8(r=0.995 7,芒果果肉),检出限LOD(3倍信噪比)均为0.027 5 ng。
2.1.2 乙撑硫脲(ETU) 按照1.3.4节中的检测方法,以ETU的质量浓度与对应离子峰面积制作标准曲线。结果表明ETU的质量浓度为0.001~1.0 mg/L时,其质量浓度(x)与监测离子峰面积(y)的线性关系良好,线性回归方程为y=1 767 657.877 2x-21 858.199 9(r=0.998 7,芒果全果)和y=2 742 925.085 2x-5 006.651 1(r=0.999 9,芒果果肉),检出限LOD(3倍信噪比)均为0.001 ng。
2.2 代森锌在芒果中的转化率
由于代森锌难溶于水,也不溶于大多数有机溶剂,因此本试验将代森锌酸解为CS2来间接测定其含量。为评估该方法的可适用性,需要对代森锌的转化率进行测定,具体计算公式如下:
转化率=[(CS2实测值×1.81)/代森锌添加质量浓度]×100%。
(3)
由表2可知,在空白芒果样品中添加代森锌,使其水平为1.8 mg/kg,在1.3.3节条件下重复测定3次,经式(3)计算得出代森锌在芒果全果和果肉中的平均转化率分别为94%和97%,该转化率可满足本试验后续建立的检测方法的要求。

表2 代森锌在芒果中的转化率
2.3 代森锌和ETU在芒果中的添加回收率
由表3可知,代森锌在芒果全果和果肉中的添加水平为0.1~2.0 mg/kg时,其平均回收率分别为92.2%~102.3%和91.2%~100.0%,相对标准偏差分别为3.2%~6.3%和0.6%~3.9%;ETU在芒果全果和果肉中的添加水平为0.01~0.5 mg/kg时,其平均回收率分别为93.4%~97.9%和92.3%~99.2%, 相对标准偏差分别为5.9%~8.3%和2.1%~5.7%。表明代森锌和ETU的定量限(LOQ)均是其最低添加水平,即分别为0.1和0.01 mg/kg。
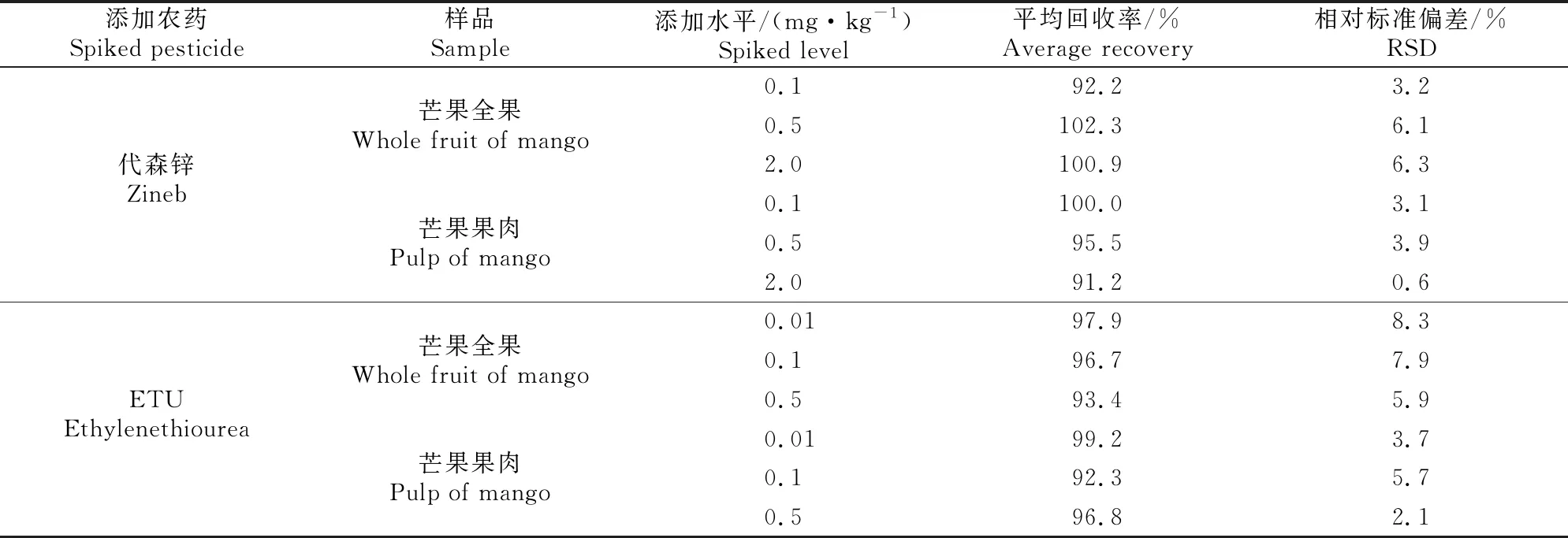
表3 代森锌和ETU在芒果中的添加回收率及相对标准偏差(n=5)
2.4 代森锌在芒果中的消解动态
代森锌在芒果中的消解动态曲线如图1所示。
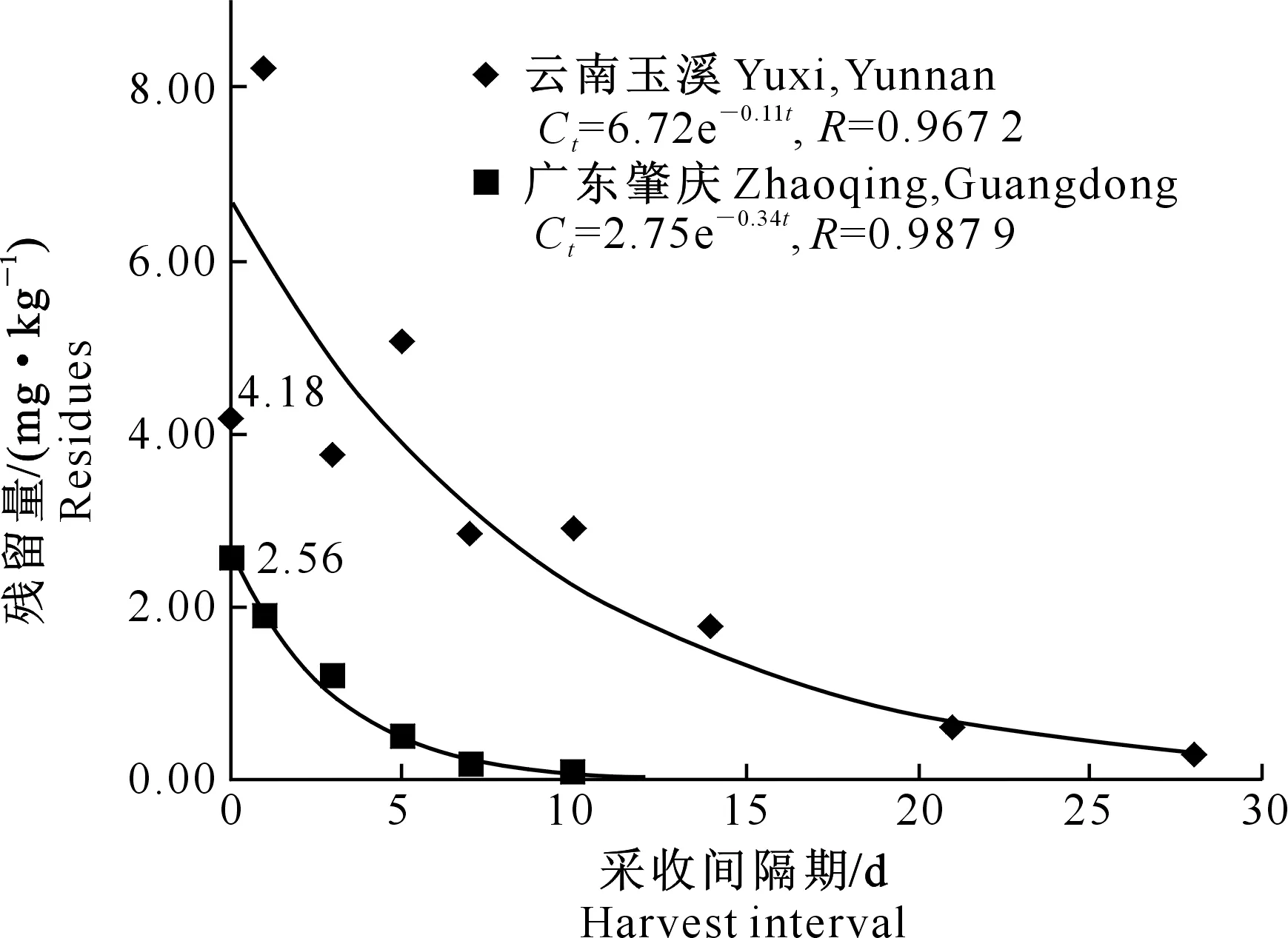
图1 代森锌在云南玉溪和广东肇庆芒果上的消解动态曲线
由图1可知,代森锌在云南玉溪和广东肇庆芒果全果中的初始沉积量分别为4.18和2.56 mg/kg。消解动态曲线分别为Ct=6.72 e-0.11t和Ct=2.75 e-0.34t(Ct为代森锌的残留量,t为消解时间),相关系数分别为0.967 2和0.987 9,消解半衰期分别为6.30和2.04 d,符合一级动力学方程。
2.5 代森锌在芒果中的最终残留量
由表4可知,ETU在芒果全果中的残留量整体小于CS2在芒果全果中的残留量,二者相对应的残留中值和残留最大值也是以ETU更小。施药后10 d,芒果全果中CS2和ETU的残留量分别为<0.10~1.51和<0.010~0.024 mg/kg;施药后14 d,芒果全果中二者的残留量分别为<0.10~1.55和<0.010~0.012 mg/kg;施药后21 d,芒果全果中二者的残留量分别为<0.10~0.29和<0.010 mg/kg。CS2在芒果果肉中的残留值均<0.10 mg/kg,ETU在芒果果肉中的残留值均<0.010 mg/kg,即二者在芒果果肉中均未检出。

表4 代森锌在6个种植区芒果全果和果肉中的最终残留量
2.6 代森锌在芒果中的膳食风险评估
参考代森锌在我国农作物上的残留量等登记情况[26],基于我国居民人均膳食结构特点(表5),按照残留风险最大化原则,将本规范试验14 d时芒果果肉中CS2和ETU的残留中值折算成代森锌的残留值(0.20 mg/kg)进行评估。根据表5中各类食物的国家估算每日摄入量计算得出,代森锌在芒果果肉中的国家估算每日摄入量允许为1.56~3.14 mg,风险概率为82.3%~166.0%,该风险概率的大小主要取决于每日摄取的浅色蔬菜中黄瓜(9.05 mg/kg)、芦笋(3.62 mg/kg)以及植物油花生(0.181 mg/kg)、油菜(18.1 mg/kg)的代入值。按安全间隔期时全果最大残留值(1.55 mg/kg)的2倍取整原则,本研究推荐代森锌(以CS2表示)在芒果中的最大残留限量值为5 mg/kg。

表5 代森锌在芒果中的风险评估结果
3 结论与讨论
由于代森锌在有机溶剂中溶解度较低,其在芒果中的残留量间接取决于酸解转化的CS2和代谢物ETU,因此本研究基于气相色谱(GC)和高效液相色谱-串联质谱(LC-MS/MS)技术,并结合优化的样品前处理方式,建立了芒果中CS2和ETU的检测方法。在添加回收试验之前,对代森锌在前处理过程中的转化率进行了评估,其在芒果全果和果肉中的平均转化率分别为94%和97%,表明在该试验条件下代森锌基本转化为CS2。代森锌添加水平为0.1~2.0 mg/kg时,其在芒果全果和果肉中的平均回收率分别为92.2%~102.3%和91.2%~100.0%,相对标准偏差分别为3.2%~6.3%和0.6%~3.9%;ETU添加水平为0.01~0.5 mg/kg时,其在芒果全果和果肉中的平均回收率分别为93.4%~97.9%和92.3%~99.2%,相对标准偏差分别为5.9%~8.3%和2.1%~5.7%。表明代森锌和ETU的定量限均是其最低添加水平,分别为0.1和0.01 mg/kg。该方法操作简便,重现性好,且回收率、精密度及定量限均符合国家相关行业准则[28]要求,可用于芒果中代森锌和ETU的检测。
据报道,代森锌在湖南、安徽小白菜上的降解半衰期为2.4~1.8 d[29],在山东、安徽萝卜植株和豌豆荚中的降解半衰期为4.1~8.5 d和3.9~4.5 d[30],在广西、湖南和福建柑橘中的降解半衰期为1.8~2.5 d[31],消解较快;但在北京和安徽苹果上的降解半衰期为20.4~36.5 d[32],降解周期较长。本研究在云南玉溪和广东肇庆进行代森锌在芒果中的消解动态试验,结果显示其降解半衰期为2.04~6.30 d,与前人研究结果基本一致,但远小于其在苹果上的半衰期,这可能是受气候条件的影响。
目前我国尚未制定代森锌在芒果上的最大残留限量值。根据《食品中农药残留风险评估指南》、《食品中农药最大残留限量制定指南》(农业农村部公告第2308号)及农药残留联合专家会议(JMPR)报告,本研究对代森锌在芒果中的膳食风险进行了评估,选取规范试验14 d时芒果果肉中CS2和ETU的残留中值折算成代森锌的残留值(0.20 mg/kg)进行评估,即以测得的CS2残留中值的1.81倍、ETU残留中值的7.5倍之和计算。根据风险最大化原则,将浅色蔬菜中黄瓜的代森锌MRL值9.05 mg/kg以及植物油中油菜的代森锌MRL值18.1 mg/kg代入表5计算,得到代森锌国家估算每日摄入量为3.14 mg,风险概率为166.0%,大于100%;若将浅色蔬菜中芦笋的代森锌MRL值3.62 mg/kg及植物油中花生的代森锌MRL值0.181 mg/kg代入表5计算,得到代森锌国家估算每日摄入量为1.56 mg,风险概率为82.3%。由此可见,本试验中芒果的代森锌残留中值在膳食摄入结构中的贡献比例较小,油菜和黄瓜的代森锌MRL值占有很大贡献比例,影响到了风险概率。依据风险概率大于100%时存在对一般人群健康产生不可接受风险的原则,在实际膳食中,应综合考虑膳食结构以避免影响身体健康。按安全间隔期时最大残留值(1.55 mg/kg)的2倍取整原则,本研究推荐代森锌(以CS2表示)在芒果中的最大残留限量值为5 mg/kg。

