微氧化改性制备自支撑Ti3C2/TiO2超级电容器薄膜电极
*何宗杰 樊璞 李玲 刘晓光
(湖北大学化学化工学院 湖北 430062)
引言
传统的超级电容器电极材料存在着比电容不高、循环性能差等缺点,因此需要开发高比电容、良好的倍率性能和优良的循环寿命的超级电容器电极材料。MXene是由过渡金属碳化物、氮化物或碳氮化物构成。其化学通式为Mn+1XnTx,其中,n=1、2或3;M代表前过渡金属元素;X代表碳或氮/碳和氮;Tx代表合成过程中不可避免出现在其表面上的官能团,如-OH、-F、-Cl等。其中Ti3C2由于具有高电导率、大比表面积且可以通过简单的真空抽滤形成柔性膜等优点,被广泛应用于储能、催化、传感、抗菌、电磁屏蔽等领域。然而在实际应用中,Ti3C2纳米片层与层之间会重新堆叠,减少了离子传输通道导致比电容下降,目前通过将Ti3C2与其他电活性材料进行复合是一种解决方案。Zhang等人[1]通过自组装工艺制备Co3O4/MXene复合材料,该电极在0.5A/g的电流密度下具有1081F/g的优异性能。Wang Fei等人[2]以聚乙烯亚胺(PEI)和Ti3C2Tx为前驱体,合成了氮掺杂碳修饰的TiO2/Ti3C2Tx,该电极在2A/g的电流密度下具有157.5mAh/g的比容量。Reddy B.S等人[3]采用简单的水热法制备了TiO2/Ti3C2用作钠硫电池电极材料具有255.196mAh/g的比容量。在Ti3C2纳米片上有暴露的金属原子,导致其在空气或水相中性质不稳定容易被氧气所氧化生成二氧化钛[4]。通过研究发现少量的原位生成TiO2不仅不会使Ti3C2的电化学性能降低,反而因为氧化在Ti3C2纳米片上造成一些空洞缺陷,提供了更多的离子通道,以及原位生成的TiO2留在了Ti3C2中间,使得层间距增大。
本研究将Ti3C2纳米片进行微氧化,再通过真空抽滤的方法成功的制备了具有一定柔性的自支撑Ti3C2/TiO2薄膜电极。对Ti3C2/TiO2薄膜电极进行循环伏安法测试、电化学阻抗测试、恒电流充放电测试进行性能表征并对电极的储能机理进行了研究。
1.实验部分
(1)实验原料
钛粉(Ti,99.95%,≥300目)、氟化锂(LiF,99%,AR)、硝酸银(AgNO3,AR)和石墨粉(C,99.95%,≥325目)购于上海阿拉丁生化科技有限公司;硝酸(HNO3,AR)和盐酸(HCl,AR)购于国药集团化学试剂有限公司。铝粉(Al,98.5%)购于天山化工厂。
(2)Ti3AlC2 MAX相的制备
按3:1.2:2的摩尔比依次称取Ti粉、Al粉和C粉在玛瑙研钵中混合研磨1h,待混合粉末研磨均匀后,将之装入铝坩埚中并放置于管式炉内。通氩气30min(30ml/min)后开始加热,以10℃/min升温到1400℃,然后以5℃/min加热到1450℃,保持2h,降至室温后取出样品,研磨得到所需的Ti3AlC2粉末。
(3)Ti3C2 MXene纳米片的制备
将1g LiF加入到30ml 9mol/L盐酸中,然后在35℃下将1g研磨好的Ti3AlC2粉末加入到盐酸-氟化锂溶液中,反应24h。将反应后产物离心5min(3500rpm)后再用去离子水洗涤至中性。将25ml超纯水加入到所得沉淀中,吹氩以除去悬浮液中的氧气。将悬浮液超声处理1h并离心1h(3500rpm)以获得为单层或少层Ti3C2MXene悬浮液[5]。
(4)Ti3C2/TiO2复合膜的制备
配置0.01M的稀硝酸酸化的硝酸银溶液,然后取一定量的上述溶液加入到10ml Ti3C2分散液(固含量为0.5%)中,室温磁力搅拌6h,将得到的分散液进行真空抽滤,干燥得到Ti3C2/TiO2复合膜。作为对比,将未进行氧化的Ti3C2分散液同样也进行抽滤干燥制备出未改性的Ti3C2薄膜。
(5)复合材料的表征
采用X射线衍射仪(XRD,BRUKER D8 ADVANCE)分析样品的晶体结构;采用场发射扫描电子显微镜(FESEM,Zeiss Sigma 500)表征样品的形貌;采用X射线光电子能谱(XPS,Escalab 250Xi)表征样品的元素和化学价态;采用CHI760E电化学工作站表征样品的电化学性能。将纯Ti3C2薄膜以及Ti3C2/TiO2复合膜裁剪成2mg薄膜用作超级电容器测量工作电极。测试是先通入氮气以除氧,电解质为1M H2SO4水溶液,将石墨电极作为对电极,甘汞电极为参比电极。电化学阻抗测试范围为0.01~10kHz。
2.结果与讨论
(1)Ti3C2/TiO2复合薄膜的合成
Ti3C2/TiO2薄膜制备过程如图1所示。将一定量酸化的硝酸银滴加到单层或少层的Ti3C2分散液中,磁力搅拌6h使其充分微氧化,得到Ti3C2/TiO2分散液。将得到的Ti3C2/TiO2分散液使用50ml去离子水洗涤多次以除去分散液中为反应的银离子和硝酸根离子、然后抽滤和干燥得到Ti3C2/TiO2薄膜。通过调控酸化的硝酸银加量(0.1ml、0.2ml、0.3ml和0.4ml)制备出Ti3C2/TiO2薄膜进行测试。作为对比,将未氧化的Ti3C2分散液同样也进行抽滤、干燥制备出一张纯Ti3C2薄膜,记作酸化的硝酸银加量0ml。在经过酸化的硝酸银氧化的过程中,Ti3C2表面被逐渐的氧化为二氧化钛纳米粒子,而二氧化钛纳米粒子在Ti3C2纳米片上表面原位生成,在一定程度上缓解了Ti3C2纳米片自堆叠的缺陷,提供了更多的离子通道[6]。此外在因氧化而生成的二氧化钛纳米粒子同样也可以提供一部分的电容能力。在随着氧化剂的加量不断增加,Ti3C2/TiO2复合膜的成膜性能不断降低,到加量为0.8ml时则完全不能成膜。
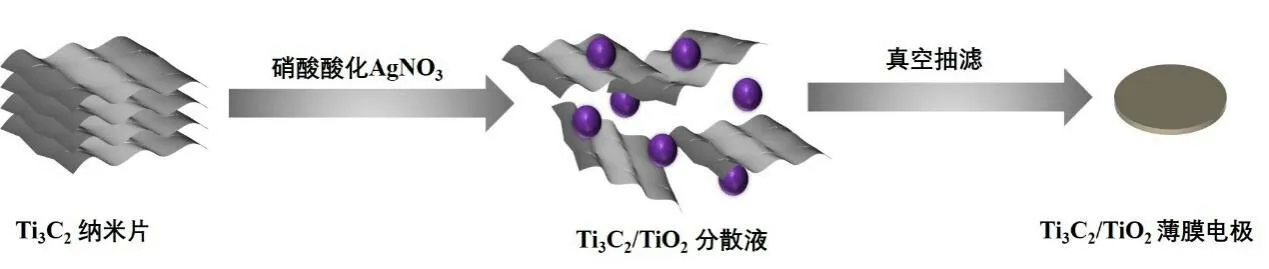
图1 Ti3C2/TiO2薄膜电极的制备流程图
(2)Ti3C2/TiO2的形貌表征
如图2所示,将未添加氧化剂的Ti3C2分散液和添加0.2ml酸化硝酸银的Ti3C2/TiO2分散液通过冷冻干燥得到粉末,再使用FE-SEM进行形貌观察。通过对比两图可以清晰的观察到,未添加氧化剂的Ti3C2纳米片的表面比较整洁,这可能是因为在MXene纳米片在制备的过程中被轻微氧化所导致的,而氧化的Ti3C2表面比较粗糙。

图2 (a)(b)未添加氧化剂的Ti3C2;(c)(d)添加0.2ml酸化硝酸银的Ti3C2/TiO2
(3)Ti3C2/TiO2薄膜XRD分析
如图3所示,通过对比上下两条XRD谱图,Ti3C2/TiO2中的TiO2在2θ角25.1°和30°的峰非常明显,而在Ti3C2中TiO2主峰处仍有微微隆起,这可能是在合成或者转移的过程中被轻微的氧化了。Ti3C2中的峰(002)的2θ角为7.52°,Ti3C2/TiO2膜中的峰(002)向左移动到6.8°,Δ(2θ)为0.72°。通过布拉格方程计算表明层间距从1.17nm提高到1.30nm,这是因为氧化而生成的TiO2纳米颗粒增加了Ti3C2的层间距[7-8]。

图3 Ti3C2/TiO2薄膜的XRD对比图
(4)Ti3C2/TiO2薄膜XPS分析
在图4(a)中,可以清晰的看到Ti3C2/TiO2复合膜中含有F、O、Ti、C和Cl元素,令人惊奇的是在Ti3C2/TiO2复合膜发现存在有N(399eV)元素,这可能是由于酸化的硝酸银中的硝酸根离子取代了部分Ti3C2纳米片上负离子,例如氟离子、氯离子等。根据以往的经验表明,N元素的加入有利于增加Ti3C2纳米片上的活性位点,有利于提升Ti3C2/TiO2复合膜的电化学性能[9]。在图4(b)中Ti的被分为三个Ti 2p1/2和Ti 2p3/2轨道,其中Ti-C 2p1/2和Ti-C 2p3/2对应的是在Ti3C2骨架上的Ti-C键、Ti3+/Ti2+2p1/2和Ti3+/Ti2+2p3/2代表的是Ti3C2表面和边缘的Ti(与F离子、-OH离子、氯离子等形成化合键)以及被氧化后的Ti(Ti-O键)[10]。值得注意的是,Ti-O的峰比较强,这是由于Ti3C2纳米片被氧化剂氧化生成二氧化钛的结果,这也和XRD图一起证明了TiO2粒子的生成。根据XPS表面元素含量计算,Ti元素原子含量为25.28%,其中Ti-O键在Ti元素的比例中占20.95%,被氧化为二氧化钛的质量为12.8%。在图4(c)中C的单峰拟合分为四个峰,分别对应于Ti3C2纳米片骨架上的C-Ti键、C-Ti-Tx键以及C-C键,还有在Ti3C2纳米片边缘上的C原子。在图4(d)中O的单峰拟合分为2个峰,被归结于C-O和Ti-O键。

图4 (a)Ti3C2/TiO2的XPS图;(b)Ti 2p;(c)C 1s;(d)O1s
(5)Ti3C2/TiO2薄膜电极电化学性能
图5(a)比较了不同氧化剂加量的条件下Ti3C2/TiO2薄膜在2mv/s扫描速率下的循环伏安图。可以观察到,加入氧化剂的Ti3C2/TiO2复合电极的CV曲线积分面积明显高于纯Ti3C2,由于TiO2和Ti3C2的协同作用,使得比电容升高。可以看到纯Ti3C2的CV曲线表明其电化学性能主要来源于双电层电容,而制备的Ti3C2/TiO2复合薄膜电极在CV曲线中具有氧化还原峰。还可以从图中观察到氧化剂的加量为0.2ml时CV曲线的积分面积最大,初步确定了Ti3C2/TiO2的最佳比例。图5(b)显示了不同氧化剂加量的Ti3C2/TiO2复合电极的EIS图。可以清楚地看到,Ti3C2/TiO2复合电极的等效串联电阻(高频区准半圆弧与实轴的截距)低于纯Ti3C2电极,其中氧化剂加量为0.2ml的Ti3C2/TiO2的复合膜电极等效串联电阻最低。从上述现象可以看出,氧化剂加量为0.2ml的Ti3C2/TiO2合电极由于等效串联电阻最小,更有利于电解质在电极表面的快速转移和扩散。图5(c)显示了Ti3C2/TiO2复合薄膜在不同氧化剂加量时的GCD曲线。Ti3C2/TiO2薄膜电极在不同比例下都为基本对称的曲线,表明Ti3C2/TiO2具有双电层电容特性。当氧化剂加量为0.2ml时,放电时间明显长于其他加量的Ti3C2/TiO2电极。图5(d)是根据计算得出的Ti3C2/TiO2薄膜电极在1A/g不同氧化剂加量下的比电容,从图中可以看出,纯Ti3C2薄膜的比电容为265F/g而Ti3C2/TiO2复合薄膜具有较高的比电容。这主要是因为原位生成的TiO2增加了纳米片层间的层间距,阻止了Ti3C2纳米片的堆叠,从而提高了电化学性能。然而,随着氧化剂加量的增加,Ti3C2/TiO2薄膜的比电容从545F/g降低到366F/g。可以看到Ti3C2和TiO2表现出很强的协同效应,但由于Ti3C2纳米片之间的重新堆叠和TiO2纳米粒子本身的低比电容,氧化剂加量为0.2ml为最佳氧化剂加量。安图,可以清楚地看到2mv/s时(图5a)有氧化还原峰,并且在增加到10mv/s的过程中氧化峰往右移,还原峰往左移,这是因为在扫速增加的过程中时滞效应和电荷转移电阻的存在。在低扫描速率下,它反映了快速的H+插入/提取和伴随的法拉第反应。Ti3C2/TiO2复合膜电极的GCD如图6(b)所示,比电容直方图如图6(c)所示,Ti3C2/TiO2在1A/g、2A/g、3A/g、4A/g和5A/g时的比电容分别为544.8F/g、481.8F/g、462F/g、444F/g和429F/g呈逐渐减小的趋势。图6(d)表明Ti3C2/TiO2复合电极在经过1000次循环后剩余92%的电容保持率,且循环前5次与循环最后5次都保持相似的形状,这表明Ti3C2/TiO2复合电极具有比较好的循环稳定性。

图5 (a)Ti3C2/TiO2在不同氧化剂加量条件下2mV/s下的CV曲线;(b)不同氧化剂加量条件下Ti3C2/TiO2复合电极的EIS图;(c)Ti3C2/TiO2在1A/g时的GCD曲线;(d)Ti3C2/TiO2复合电极在1A/g时的比电容柱状图

图6 (a)氧化剂加量为0.2ml的Ti3C2/TiO2薄膜电极CV图;(b)GCD;(c)比电容柱状图;(d)循环稳定性图图6(a)显示了Ti3C2/TiO2从2mv/s到10mv/s的循环伏
(6)Ti3C2/TiO2薄膜电极动力学
图7(a)是Ti3C2/TiO2抽滤干燥后的光学影像图,可以看到Ti3C2/TiO2薄膜能够弯曲180°而不发生断裂说明其具有一定的柔性,具有制备柔性电子器件的潜力。同时为了研究Ti3C2/TiO2薄膜电极的容量贡献比例,一般可通过计算峰电流与扫速之间的关系来分析氢离子嵌入动力学过程[11-12]。我们利用在不同扫描速度(2~10mV/s)下的CV曲线的变化来分析Ti3C2/TiO2薄膜电极的储氢动力学过程,通过计算阳极和阴极的b值为0.8972和0.8416,介于0.5和1.0之间。这表明在循环过程中,Ti3C2/TiO2复合膜中同时发生了电容控制和扩散控制过程。图7c是通过电容拟合(R2>0.95)再通过插值和外推重建完整曲线得到的2mV/s的CV曲线,从2mV/s增加到10mV/s过程中电容控制占比从76.03%增加到95.05%。这说明相比于Ti3C2的双电层电容,Ti3C2/TiO2复合材料更偏向于一个赝电容电极材料,在Ti3C2纳米片之间生成二氧化钛的方法改变了整个体系的储能方式。

图7 (a)Ti3C2/TiO2抽滤干燥后的光学影像图;(b)Ti3C2 TiO2的电流对数与扫速对数曲线;(c)Ti3C2/TiO2薄膜电极在2mV/s下的电容控制占比(阴影部分);(d)电容贡献率图
3.结论
通过将剥离的单层或少层Ti3C2纳米片使用少量的氧化剂对其进行改性,使得在Ti3C2纳米片表面生成更多的TiO2颗粒,成功的制备了具有柔性的Ti3C2/TiO2薄膜电极。与纯Ti3C2薄膜电极相比,Ti3C2/TiO2薄膜电极具有544F/g的高比电容、在1000次循环充放电之后电容保持率剩余92%。其次通过电极动力学分析计算,在扫描速率为2mV/s时赝电容控制占比为76%(10mV/s为96%)。

