瘤胃液、血浆及牛奶中奇链支链脂肪酸含量与其前体物含量的相关性
孙玲玲 高胜涛 马 露,2 沈旖帆 温 万 卜登攀,2*
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.中国农业科学院与世界农用林业中心农用林业与可持续畜牧业联合实验室,北京 100193;3.宁夏畜牧工作站,银川 750001)
奇链支链脂肪酸(odd- and branched-chain fatty acids,OBCFA)是一类在植物中含量很少[1],普遍存在于牛、羊的乳脂和脂肪组织中的脂肪酸[2]。牛奶中OBCFA主要来自于离开瘤胃的微生物的膜脂[3],其含量常被用来预测瘤胃的发酵功能,如瘤胃挥发性脂肪酸(volatile fatty acids,VFA)[4]和微生物蛋白(microbial protein,MCP)[5]产量的预测等。有研究表明,支链脂肪酸(branched-chain fatty acids,BCFA)包括异构十四烷酸(iso-tetradecanoic acid,iso-14∶0)、异构十五烷酸(iso-pentadecanoic acid,iso-15∶0)和异构棕榈酸(iso-hexadecanoic acid,iso-16∶0)等,均具有抑制癌细胞脂肪酸合成的功效[6]。同时,流行病学研究表明,血浆中奇链脂肪酸(odd-chain fatty acids,OCFA)的含量与降低冠心病和Ⅱ型糖尿病的发病风险有关[7-8]。因此,通过营养调控手段生产富含OBCFA的功能性乳制品受到越来越多研究学者的关注。
牛奶中OBCFA的含量并不是恒定的,受到许多因素的影响,饮食是影响乳脂中OBCFA含量的一个主要因素[9]。饲粮中高比例的粗饲料有利于瘤胃细菌中BCFA的合成,因此可提高奶牛乳脂中OBCFA含量[10]。例如,Zhang等[11]研究表明,饲粮的粗精比为70∶30时,奶牛乳脂中iso-15∶0、iso-16∶0、异构十七烷酸(iso-heptadecanoic acid,iso-17∶0)和十七烷酸(n-heptadecanoic acid,n-17∶0)含量要显著高于粗精比为30∶70和50∶50时。饲粮中补充脂质可通过增加瘤胃微生物对膳食脂肪酸的吸收而改变牛奶中脂肪酸的分布[12]。然而,Rego等[13]研究表明,奶牛饲粮中添加植物油包括菜籽油、葵花籽油和亚麻籽油均使乳脂中iso-14∶0、十五烷酸(n-pentadecanoic acid, n-15∶0)和iso-15∶0等含量降低。Vazirigohar等[14]研究发现,用葵花油(富含18∶2n-6)完全取代奶牛饲粮中的棕榈油(富含n-16∶0)不是一种提高乳脂中OBCFA含量的有效方法。因此,提高乳脂中OBCFA含量的营养调控策略仍需进一步探究。
瘤胃微生物以丙酸和戊酸为前体物合成OCFA,而BCFA则是以支链氨基酸(branched-chain amino acid,BCAA)(亮氨酸,异亮氨酸和缬氨酸)和与之相对应的支链羧酸(异戊酸、2-甲基丁酸和异丁酸)为前体进行合成[15]。改变前体物的供应模式也可以改变乳脂中脂肪酸的含量[16]。然而,瘤胃中OBCFA前体物含量与瘤胃、血浆及牛奶中OBCFA含量是否具有相关关系,目前尚未有研究报道。因此,本试验旨在探究瘤胃中合成OBCFA前体物含量与瘤胃、血浆及牛奶中OBCFA含量的相关性,以期为通过营养调控策略提高乳脂中OBCFA含量提供建议。
1 材料与方法
1.1 试验设计、饲养管理和样品采集
本试验在北京中地畜牧科技有限公司奶牛场进行。选取27头体重[(630±27) kg/d]、胎次[(3.6±0.3)胎]、泌乳日龄[(170±18) d]及产奶量[(25.7±3.1) kg/d]相近的健康荷斯坦奶牛。所有奶牛饲养在同一圈舍中饲喂相同饲粮4周,饲养管理按照牧场的常规管理程序进行,奶牛每天饲喂3次(07:00、14:00和22:00)基础饲粮,基础饲粮的各种营养成分能够满足或略超过NRC(2001)中推荐的泌乳奶牛营养需要量,其组成及营养水平见表1。试验期间奶牛自由采食及饮水,每天挤奶3次(06:30、14:30和22:30)。
于试验第4周的最后3 d每天采集9头牛的牛奶、瘤胃液及血液样品。挤奶时采集牛奶样品,并按照4∶3∶3的比例将早、中、晚采集的牛奶样品混合,-20 ℃保存,用于测定牛奶中OBCFA含量。晨饲前,尾静脉采集血液于10 mL添加肝素钠的真空采血管中,加冰块保存,3 000×g、4 ℃离心15 min获取血浆,-20 ℃保存,用于测定血浆中OBCFA含量。采集完血液样品后,用瘤胃采集器经奶牛口腔采集晨饲前瘤胃液样品,为消除唾液污染,弃掉初始50 mL液体,剩余瘤胃液经4层纱布过滤后收集于10 mL离心管中,-20 ℃保存,用于测定瘤胃液中合成OBCFA的前体物(丙酸、戊酸、异丁酸、异戊酸、亮氨酸、异亮氨酸和缬氨酸)含量以及OBCFA含量。于采样日07:00、14:00和22:00分别采集等量饲粮样品并混合,在65 ℃烘箱中干燥48 h制成风干样品,粉碎后用于后续营养成分的分析。
1.2 样品测定与分析
1.2.1 饲粮样品营养成分的测定
将风干饲粮样品在105 ℃烘箱内烘干4 h,参照AOAC(1990)[17]方法测定干物质(DM)含量。粗蛋白质(CP)含量参照AOAC(1990)[17]方法,使用凯氏定氮仪(K1100,山东海能科学仪器有限公司)进行测定。中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量参照Van Soest等[18]的方法使用FOSS Fibertec纤维分析仪(Fibertec 2010,FOSS集团,丹麦)进行测定,测定中使用热稳定的α-淀粉酶。粗脂肪含量参照AOAC(1990)[17]的方法使用FOSS索氏脂肪提取仪(SoxtecTM2050,FOSS集团,丹麦)进行测定。在电炉炭化后放入高温电阻炉[(550±20) ℃]内灰化2~4 h测定饲粮粗灰分含量。
1.2.2 瘤胃液中VFA和BCAA含量的测定
解冻后的瘤胃液10 000×g离心10 min,移取1.5 mL上清液至离心管中,加入0.15 mL 25%偏磷酸溶液,静置30 min,10 000×g离心15 min,取上清液用气相色谱仪(6890N,安捷伦公司,美国)测定VFA含量[19]。取瘤胃液800 μL,加入等量8%磺基水杨酸溶液,4 ℃冰箱过夜,取500 μL过夜后的悬浮液加500 μL甲醇振荡混匀后,10 000×g离心10 min,取上清过0.22 μm滤膜到上机瓶中,用液相色谱-质谱联用仪(6470A,安捷伦公司,美国)测定BCAA含量[20]。
1.2.3 牛奶、瘤胃液及血浆中OBCFA含量的测定
牛奶、瘤胃液及血浆中OBCFA含量参照王加启[21]的方法进行测定。牛奶样品操作步骤如下:称取2 g牛奶样品于10 mL带盖离心管中,加入4 mL正己烷-异丙醇溶液(正己烷∶异丙醇=3∶2,体积比),涡旋振荡2 min。加入2 mL硫酸钠溶液(66.7 g/L),于4 ℃、2 500×g离心10 min。将上层正己烷相移至耐高温试管中,加入2 mL 2%氢氧化钠甲醇溶液,于50 ℃水浴皂化30 min。冷却至室温后,加入2 mL 10%盐酸甲醇溶液,90 ℃水浴酯化2 h。冷却后加入2 mL水,用2 mL正己烷浸提3次,合并正己烷层并定容至10 mL。加入约0.5 g无水硫酸钠,涡旋振荡30 s,取上清液待测。
按上述步骤取3 mL瘤胃液样品加5 mL正己烷-异丙醇溶液提取脂肪。将上层正己烷相移至耐高温试管中,用氮气吹干,加入0.5 mL正己烷和1 mL甲醇及2 mL氢氧化钠甲醇溶液,同上进行皂化和酯化后,加入3 mL水和5 mL正己烷,振荡,静置分层。取上层液体,氮气吹至近干,加入0.5 mL正己烷和0.1 g无水硫酸钠,干燥后取上清待测。
血浆样品取样量为1 mL,氢氧化钠甲醇和盐酸甲醇用量为3 mL,其他同瘤胃液样品的操作步骤。
所有上清液用配有HP-88色谱柱(100 m×0.25 mm×0.2 μm,安捷伦公司,美国)的气相色谱仪(6890N,安捷伦公司,美国)测定脂肪酸含量,测定条件为:分流比50∶1,注射体积2 μL。进样口和检测器温度为280 ℃,柱温箱升温程序为:起始温度120 ℃维持10 min,以1.5 ℃/min提高到230 ℃维持30 min,再提高到250 ℃维持10 min。压力为190 kPa,高纯氮气作为载气。总运行时间为113.3 min。
1.2.4 脂肪酸和氨基酸数据处理
使用MassHunter B.07.01工作站软件对脂肪酸和BCAA下机数据进行处理。通过与已知标准品的保留时间对比,定性各脂肪酸甲酯和BCAA,并通过标准曲线对其进行定量。本研究中进行定性和定量的OBCFA包括iso-14∶0、n-15∶0、iso-15∶0、iso-16∶0、n-17∶0、iso-17∶0和反式异构十七烷酸(anteiso-17∶0),BCAA包括亮氨酸、异亮氨酸和缬氨酸。牛奶、瘤胃液及血浆样品中OBCFA含量表达为各OBCFA占总脂肪酸含量的比例。反式异构十五烷酸(anteiso-15∶0)和顺-9-十四碳烯酸(cis-9-14∶1)共洗脱,因此结果中未报告anteiso-15∶0含量。
1.3 统计分析
所有数据使用Excel 2019进行初步分析,计算各指标的最大值、最小值、平均值、标准差及变异系数。使用SAS 9.4软件中的PROC CORR程序对数据进行相关性分析,并用Pearson方法进行检验,P≤0.10表示趋于相关,P<0.05表示显著相关,P<0.01表示极显著相关。相关强度的判断标准为:相关系数(r)=0.8~1.0为极强相关,r=0.6~0.8为强相关,r=0.4~0.6为中等程度相关,r=0.2~0.4为弱相关,r=0~0.2为极弱相关或无相关。
2 结 果
2.1 牛奶、血浆及瘤胃液中OBCFA含量和瘤胃液VFA及BCAA含量
由表2可知,牛奶中n-15∶0含量最高,iso-14∶0含量最低且变异系数最大。血浆中iso-17∶0含量最高,iso-14∶0含量最低且变异系数相对较大。瘤胃液中OBCFA含量与牛奶中相近,n-15∶0含量最高,但低于牛奶中n-15∶0含量;iso-14∶0含量最低,且变异系数相对较大。合成瘤胃OBCFA的VFA前体物中,丙酸含量最高,其他几种酸含量较少,所有VFA的变异系数均在20%~30%。瘤胃液中BCAA含量相近,在0.01~0.03 mmol/L,变异系数较大。

续表2项目Items平均值Mean标准差SD最小值Min最大值Max变异系数CV/%十七烷酸 n-17∶00.550.030.510.625.82异构十七烷酸 iso-17∶00.450.080.360.6116.85反式异构十七烷酸 anteiso-17∶00.400.150.250.8938.29总奇链脂肪酸 ΣOCFA1.410.121.211.738.58总支链脂肪酸 ΣBCFA2.010.511.383.5225.48总奇链支链脂肪酸 ΣOBCFA3.260.662.605.2520.29瘤胃液中挥发性脂肪酸含量 VFA content in rumen/(mmol/L)丙酸 Propionate16.984.537.2226.6126.67戊酸 Valerate1.030.260.421.5825.32异丁酸 Isobutyrate0.750.160.391.1421.52异戊酸 Isovalerate1.200.060.641.9924.89瘤胃液中支链氨基酸含量 BCAA content in rumen/(mmol/L)亮氨酸 Leucine0.020.010.010.0337.51异亮氨酸 Isoleucine0.01<0.010.010.0234.10缬氨酸 Valine0.020.01<0.010.0337.83
总奇链脂肪酸=十五烷酸+十七烷酸。总支链脂肪酸=异构十四烷酸+异构十五烷酸+异构棕榈酸+异构十七烷酸+反异构十七烷酸。总奇链支链脂肪酸=异构十四烷酸+十五烷酸+异构十五烷酸+异构棕榈酸+十七烷酸+异构十七烷酸+反异构十七烷酸。下表同。
ΣOCFA=n-15∶0+n-17∶0. ΣBCFA=iso-14∶0+iso-15∶0+iso-16∶0+iso-17∶0+anteiso-17∶0. ΣOBCFA=iso-14∶0+n-15∶0+iso-15∶0+iso-16∶0+n-17∶0+iso-17∶0+anteiso-17∶0. The same as below.
2.2 瘤胃液中OBCFA前体物含量与OBCFA含量的相关性
由表3可知,瘤胃液中丙酸含量与n-15∶0含量趋于显著正相关(P<0.10),与总奇链脂肪酸(ΣOCFA)和总奇链支链脂肪酸(ΣOBCFA)含量呈显著(P<0.05)或极显著(P<0.01)正相关。瘤胃液中戊酸含量与ΣOBCFA含量呈显著正相关(P<0.05)。瘤胃液中异丁酸含量与anteiso-17∶0、总支链脂肪酸(ΣBCFA)和ΣOBCFA含量呈显著正相关(P<0.05)。瘤胃液中异戊酸含量与iso-14∶0含量呈显著负相关(P<0.05),与iso-15∶0和ΣBCFA含量呈显著正相关(P<0.05)。瘤胃液中亮氨酸含量与iso-14∶0、iso-17∶0、anteiso-17∶0、ΣBCFA和ΣOBCFA含量呈极显著正相关(P<0.01)。瘤胃液中异亮氨酸含量与iso-17∶0、anteiso-17∶0、ΣBCFA和ΣOBCFA含量呈显著(P<0.05)或极显著(P<0.01)正相关。瘤胃液中缬氨酸含量与iso-14∶0、iso-16∶0和ΣOBCFA含量呈显著正相关(P<0.05),与ΣBCFA含量趋于正相关(P<0.10)。上述相关性多属于中等强度相关。

表3 瘤胃液中OBCFA前体物含量与OBCFA含量的相关性
2.3 瘤胃液中OBCFA前体物含量与血浆中OBCFA含量的相关性
由表4可知,瘤胃液中丙酸含量与血浆中n-17∶0含量呈显著正相关(P<0.05),与血浆中ΣOCFA和ΣOBCFA含量趋于显著正相关(P<0.10)。瘤胃液中戊酸与血浆中n-17∶0含量呈显著正相关(P<0.05),与血浆中ΣOBCFA含量趋于显著正相关(P<0.10)。瘤胃液中异丁酸含量与血浆中iso-17∶0、ΣBCFA和ΣOBCFA含量呈显著正相关(P<0.05)。瘤胃液中异戊酸含量与血浆中anteiso-17∶0含量呈极显著正相关(P<0.01)。瘤胃液中亮氨酸含量与血浆中iso-17∶0、anteiso-17∶0和ΣBCFA含量呈显著正相关(P<0.05),与血浆中iso-16∶0和ΣOBCFA含量趋于显著正相关(P<0.10)。瘤胃液中异亮氨酸含量与血浆中anteiso-17∶0和ΣBCFA含量呈极显著(P<0.01)或显著(P<0.05)正相关,与血浆中iso-16∶0和ΣOBCFA含量趋于显著正相关(P<0.10)。瘤胃液中缬氨酸含量与血浆中iso-14∶0和iso-17∶0含量趋于显著正相关(P<0.10)。以上相关性多属于弱相关或中等强度相关。

表4 瘤胃液中OBCFA前体物含量与血浆中OBCFA含量的相关性
2.4 瘤胃液中OBCFA前体物含量与牛奶中OBCFA含量的相关性
由表5可知,瘤胃液中丙酸含量与牛奶中iso-17∶0和anteiso-17∶0含量趋于显著正相关(P<0.10)。瘤胃液中戊酸含量与牛奶中n-17∶0含量趋于显著正相关(P<0.10)。瘤胃液中异丁酸含量与牛奶中iso-17∶0和anteiso-17∶0含量趋于显著正相关(P<0.10)。瘤胃液中异戊酸含量与牛奶中anteiso-17∶0含量趋于显著正相关(P<0.10)。瘤胃液中亮氨酸含量与牛奶中iso-15∶0、iso-17∶0、anteiso-17∶0和ΣBCFA含量趋于显著正相关(P<0.10)。瘤胃液中异亮氨酸含量与牛奶中iso-17∶0、anteiso-17∶0和ΣBCFA含量趋于显著正相关(P<0.10)。瘤胃液中缬氨酸与牛奶中iso-14∶0、iso-15∶0、iso-17∶0和ΣBCFA含量趋于显著正相关(P<0.10)。以上相关性多属于弱相关。
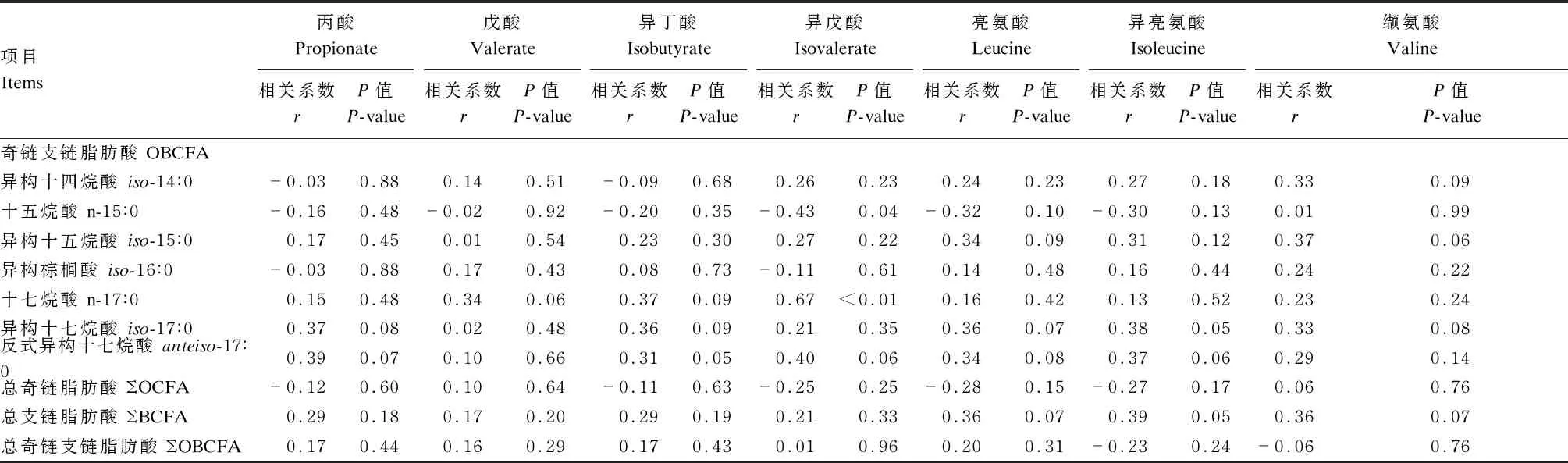
表5 瘤胃液中OBCFA前体物含量与牛奶中OBCFA含量的相关性
2.5 瘤胃液中OBCFA含量与牛奶中OBCFA含量的相关性
由表6可知,瘤胃液中与牛奶中iso-14∶0、iso-15∶0和iso-16∶0含量趋于显著正相关(P<0.10)。瘤胃液中与牛奶中n-15∶0含量呈极显著负相关(P<0.01),n-17∶0含量呈极显著正相关(P<0.01),然而17碳的BCFA含量无显著相关性(P>0.05)。瘤胃液中与牛奶中ΣOCFA含量呈显著负相关(P<0.05),而ΣBCFA含量趋于显著正相关(P<0.10)。
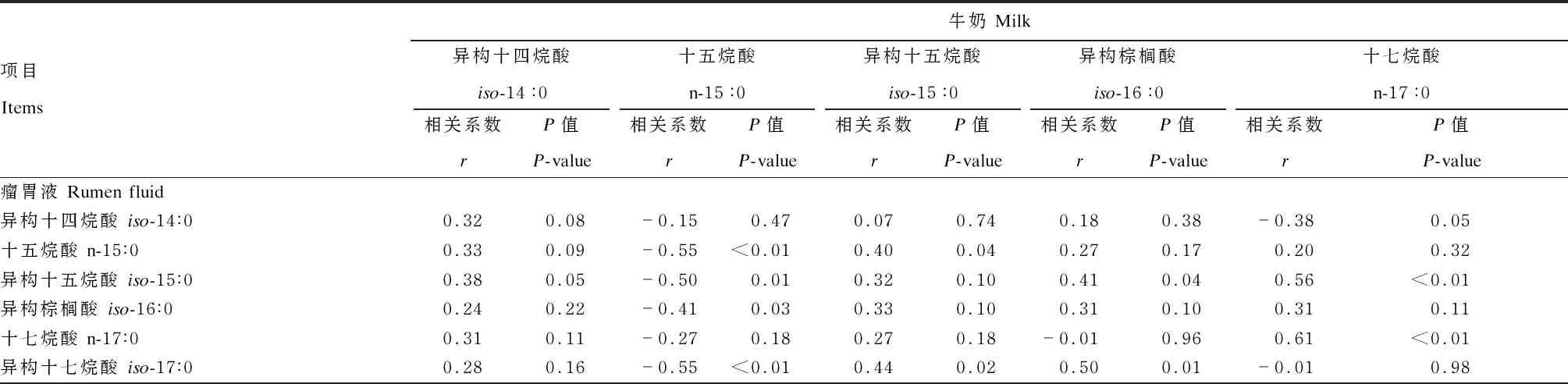
表6 瘤胃液中OBCFA含量与牛奶中OBCFA含量的相关性

续表6项目Items牛奶 Milk异构十四烷酸iso-14∶0相关系数rP值P-value十五烷酸n-15∶0相关系数rP值P-value异构十五烷酸iso-15∶0相关系数rP值P-value异构棕榈酸iso-16∶0相关系数rP值P-value十七烷酸n-17∶0相关系数rP值P-value反式异构十七烷酸 anteiso-17∶00.52<0.01-0.180.360.530.010.340.080.060.76总奇链脂肪酸 ΣOCFA0.410.04-0.53<0.010.420.030.240.230.200.31总支链脂肪酸 ΣBCFA0.380.05-0.440.020.450.020.420.030.190.35总奇链支链脂肪酸 ΣOBCFA0.420.03-0.340.090.400.040.360.06-0.100.61

项目Items牛奶 Milk异构十七烷酸iso-17∶0相关系数rP值P-value反式异构十七烷酸anteiso-17∶0相关系数rP值P-value总奇链脂肪酸ΣOCFA相关系数rP值P-value总支链脂肪酸ΣBCFA相关系数rP值P-value总奇链支链脂肪酸ΣOBCFA相关系数rP值P-value瘤胃液 Rumen fluid异构十四烷酸 iso-14∶0-0.030.870.030.88-0.250.210.020.93-0.380.05十五烷酸 n-15∶00.320.110.200.32-0.510.010.440.030.030.88异构十五烷酸 iso-15∶00.230.250.130.51-0.360.070.310.12-0.210.30异构棕榈酸 iso-16∶00.220.260.180.36-0.340.090.260.20-0.350.07十七烷酸 n-17∶0-0.040.840.130.53-0.110.600.090.660.100.63异构十七烷酸 iso-17∶00.100.62-0.010.99-0.56<0.010.270.18-0.440.02反式异构十七烷酸 anteiso-17∶00.300.130.130.51-0.170.390.460.02-0.220.28总奇链脂肪酸 ΣOCFA0.350.080.240.23-0.480.010.480.010.070.74总支链脂肪酸 ΣBCFA0.240.220.150.44-0.400.040.380.06-0.400.04总奇链支链脂肪酸 ΣOBCFA0.390.040.240.23-0.370.060.510.01-0.280.16
3 讨 论
瘤胃中的VFA主要来源于微生物对碳水化合物的消化,是反刍动物的主要能量来源[22]。同时,瘤胃微生物可以利用VFA合成自身所必需的营养成分[23]。OBCFA是瘤胃微生物细胞膜的特有成分,对维持膜结构的完整性及流动性具有重要作用[24]。其中,OCFA包括n-15∶0和n-17∶0,可以通过脂肪酸合成酶介导,以丙酸和戊酸为前体重复缩合而成[25]。本研究结果显示,瘤胃液中丙酸含量与n-15∶0含量趋于显著正相关,与n-17∶0含量没有显著相关性,瘤胃液中戊酸含量与n-15∶0和n-17∶0含量均没有显著相关性。这与刘鑫[26]利用体外发酵技术探究发酵液中OBCFA含量与VFA含量相关关系的结果相类似。然而刘可园[27]研究发现,瘤胃液中丙酸含量与n-15∶0含量呈显著负相关,与n-17∶0含量呈显著正相关。n-15∶0与n-17∶0合成途径相似,存在底物竞争关系[25],这可能是造成这一差异结果的原因。异丁酸和异戊酸分别是合成偶数异构脂肪酸和奇数异构脂肪酸的前体[15]。本研究发现,瘤胃液中异丁酸含量与iso-14∶0和iso-16∶0含量并无显著相关性,然而与anteiso-17∶0含量呈显著正相关;瘤胃液中异戊酸含量与iso-15∶0含量呈显著正相关,同时与iso-16∶0含量趋于显著正相关。刘可园[27]研究发现,瘤胃液中异丁酸含量与iso-16∶0含量呈显著正相关,异戊酸含量与iso-15∶0和iso-17∶0含量无显著相关性,然而与iso-16∶0含量呈显著正相关。这些研究结果表明,支链VFA前体物与其对应合成的BCFA具有一定的相关性,然而与其他BCFA也存在一定的相关关系,表明不同前体物与OBCFA的相关性不仅与底物利用率有关,可能还与瘤胃微生物组成等因素相关。瘤胃微生物在支链氨基酸氨基转移酶、支链α酮酸脱氢酶及支链脂肪酸合成酶的作用下以亮氨酸、异亮氨酸和缬氨酸为前体合成BCFA[15]。本研究发现,瘤胃液中亮氨酸含量与iso-17∶0含量呈极显著正相关,异亮氨酸含量与anteiso-17∶0含量呈极显著正相关,缬氨酸含量与iso-14∶0和iso-16∶0含量呈显著正相关。Kaneda[15]报道瘤胃微生物以BCAA为底物生成BCFA的合成途径更具有广泛性,这可能是BCAA与BCFA相关性更强的原因之一。
携带OBCFA的瘤胃微生物随食糜离开瘤胃到达十二指肠,OBCFA随后被空肠吸收,并先后在淋巴血液中形成乳糜微粒和极低密度脂蛋白,通过血液被转运到乳腺组织[28]。血浆中n-15∶0和n-17∶0含量低于瘤胃液,可能与脂肪组织的沉积或脂肪酸的稀释作用有关[29]。本研究中,瘤胃液中丙酸和戊酸含量与血浆中n-15∶0含量没有显著相关性,与n-17∶0含量呈显著正相关。与上述瘤胃液中丙酸和戊酸含量与OCFA含量的相关性存在差异,可能是n-15∶0和n-17∶0之间的相互转化造成的[30]。瘤胃液中BCAA和支链VFA都有与之存在一定相关关系的BCFA,且与瘤胃液中这类前体物和BCFA的相关关系有一定的相似性,然而一些相关关系有所减弱,表明瘤胃液中BCFA的组成比例在血液中发生改变,但并未发生剧烈变化。
牛奶中ΣOBCFA含量与瘤胃液中相似,高于血浆中ΣOBCFA含量,主要是较高的OCFA含量所致。Dodds等[31]报道,乳腺组织能够以丙酰-CoA替代乙酰-CoA内源性合成n-15∶0和n-17∶0等OCFA,使得牛奶中这类脂肪酸的含量高于血浆中的含量。与刘可园[27]研究发现瘤胃液中丙酸含量与乳脂中n-15∶0和n-17∶0含量呈显著负相关不同,本研究结果显示,瘤胃中合成OCFA的前体物丙酸和戊酸含量与牛奶中OCFA含量相关性较弱或无显著相关性,同时本研究进一步分析了瘤胃液中和牛奶中OBCFA含量的相关性,发现瘤胃液中和牛奶中n-15∶0含量呈显著负相关,n-17∶0含量呈显著正相关。这一结果可能与OCFA在乳腺中的内源性合成有关[31],与前人研究的差异可能是饲粮结构的不同或动物的生理状态不同造成的。Gervais等[32]研究表明,十二指肠中的BCFA几乎可以完全转化到牛奶中,这使得本研究中瘤胃液、血浆及牛奶中ΣBCFA含量相近。然而瘤胃液中BCFA前体物含量与牛奶中BCFA含量相关性较弱,可能是因为BCFA存在瘤胃后的一些修饰作用,如部分15碳BCFA可以在乳腺中转化为17碳的BCFA[33]。我们进一步分析了瘤胃液中和牛奶中BCFA含量的相关性,发现瘤胃液中和牛奶中部分BCFA含量之间存在一定的相关关系,大多属于中等强度相关,此结果表明瘤胃液中BCFA的组成比例可以在牛奶中反映。
4 结 论
瘤胃内合成OBCFA的前体物与瘤胃液、血浆及牛奶中OBCFA含量均存在不同程度的相关关系,以瘤胃液中的相关关系最强。瘤胃液中OBCFA含量与牛奶中OBCFA含量存在中等强度的相关关系。综上所述,改变瘤胃内合成OBCFA前体物的含量是提高牛奶中OBCFA含量的一种潜在营养调控策略。

