盐角草提取物对绵羊生长性能及血清生化指标的影响
梁见弟 阿不夏合满·穆巴拉克 秦荣艳 陈翔宇 赵 晨 王乐乐 张志军 王承敏 王文奇*
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.新疆畜牧科学院饲料研究所,乌鲁木齐 830011;3.石河子大学动物科技学院,石河子 832000)
盐生植物盐角草(SalicorniaeuropaeaL.)又名“欧洲海蓬子”,是世界上最耐盐的陆生植物之一[1]。盐角草含有丰富的黄酮、生物碱、甾体、萜类等生物活性作物质,具有抗肿瘤、抗病毒、抗炎、抗菌、抗氧化、提高免疫等作用[2-4]。有研究显示,盐角草干草直接饲喂绵羊,可提高机体抗氧化能力[5]。饲喂5%盐角草粉能使大鼠血清瘦素含量明显降低,同时对脂代谢有一定的改善作用[6]。盐角草在植物提取物开发利用方面的潜在价值,受到了科研工作者的广泛关注。有研究显示,盐角草提取物能够有效提高小鼠机体的抗氧化能力,显著降低小鼠肝脏重量、肝脏甘油三酯(TG)含量、血清瘦素和胰岛素含量以及关键脂质合成代谢基因相对表达量[7-8]。盐角草水提取物作为一种新型的食盐替代品,能有效预防高盐所致肥胖小鼠非酒精性脂肪肝病的加重,起到保护肝脏健康的作用,能有效控制高盐摄入引起心脑血管疾病的发病风险[9-10]。盐角草甲醇提取物则有较好的抗氧化和抗癌活性,1 000 mg/mL盐角草甲醇提取物对肝癌细胞毒性抑制率可达80%[11]。盐角草脂质提取物对镉诱导的红细胞损伤具有保护潜力[12]。盐角草提取物可以安全替代抗生素,提升家禽肉品的安全性,并对肉品产生积极影响:盐角草提取物可以通过降低腹部脂肪率来改变肉仔鸡胴体品质[13]。然而,盐角草提取物对畜禽生长性能及血清生化指标的影响鲜有报道。因此,本研究以阿勒泰绵羊为研究对象,通过在饲粮中添加不同水平的盐角草提取物,探究其对绵羊生长性能及血清生化指标的影响,为盐角草提取物在绵羊生产中的应用提供数据支持。
1 材料与方法
1.1 试验材料
盐角草提取物由河南宜新生物科技有限公司提供,经水提、浓缩、喷雾干燥而制。经测定,盐角草提取物中钠、钾等矿物质元素含量在11%以上,并且含有丰富的植物活性物质。图1为盐角草提取物活性物质多峰检测图,显示了样品中检测到的物质,不同颜色的每个峰代表1种被检测到的植物活性物质;共鉴定出543种植物活性物质,分为59个不同类型;峰值前6类不同类型植物活性物质中包括17种有机氧化合物、24种脂肪酰类、47种酚类、22种氨基酸及其衍生物、8种芳香类化合物、72种生物碱。
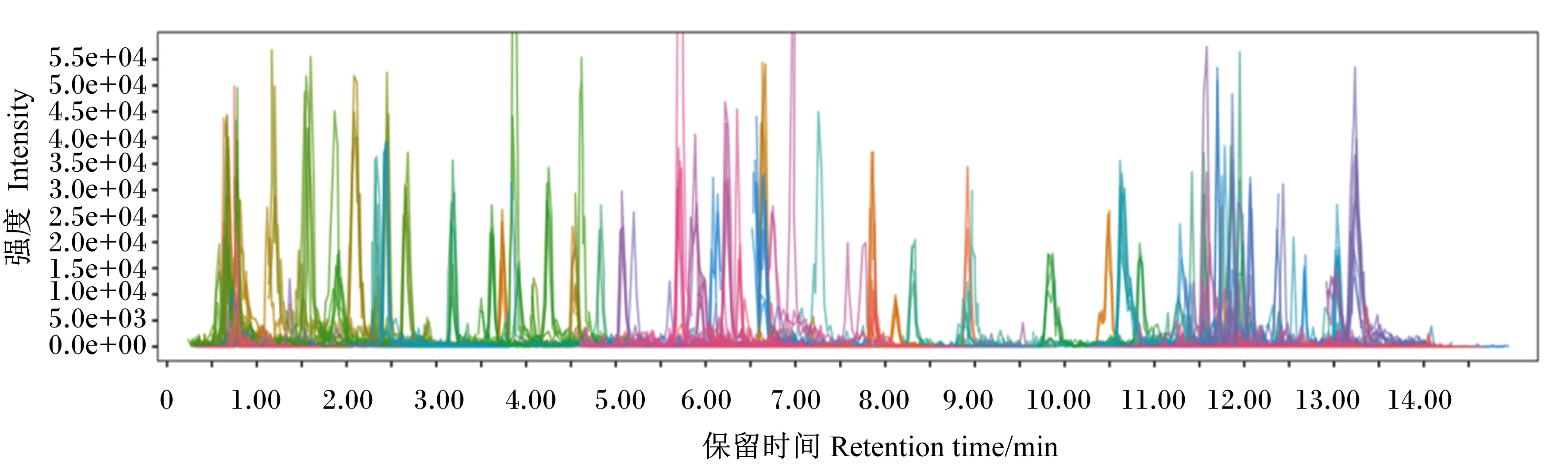
图1 盐角草提取物活性物质多峰检测图
1.2 试验设计及饲养管理
选择3.5月龄、体重[(32.52±2.83) kg]相近、体况良好的阿勒泰公羊60只,随机分为4组(每组5个重复,每个重复3只羊),分别饲喂基础饲粮(对照组)、基础饲粮+0.2%盐角草提取物(0.2%组)、基础饲粮+0.4%盐角草提取物(0.4%组)、基础饲粮+0.6%盐角草提取物(0.6%组)。基础饲粮参照《肉用绵羊日营养需要量》(DB65/T 4244—2019),其组成及营养水平见表1。各组按基础饲粮和盐角草提取物添加水平,制成全混合颗粒饲料,保障羊只采食均匀和完全。整个试验期56 d,其中预试期11 d,正试期45 d。试验羊每天09:00和18:00各饲喂1次(饲喂量各1/2),自由采食,自由饮水。
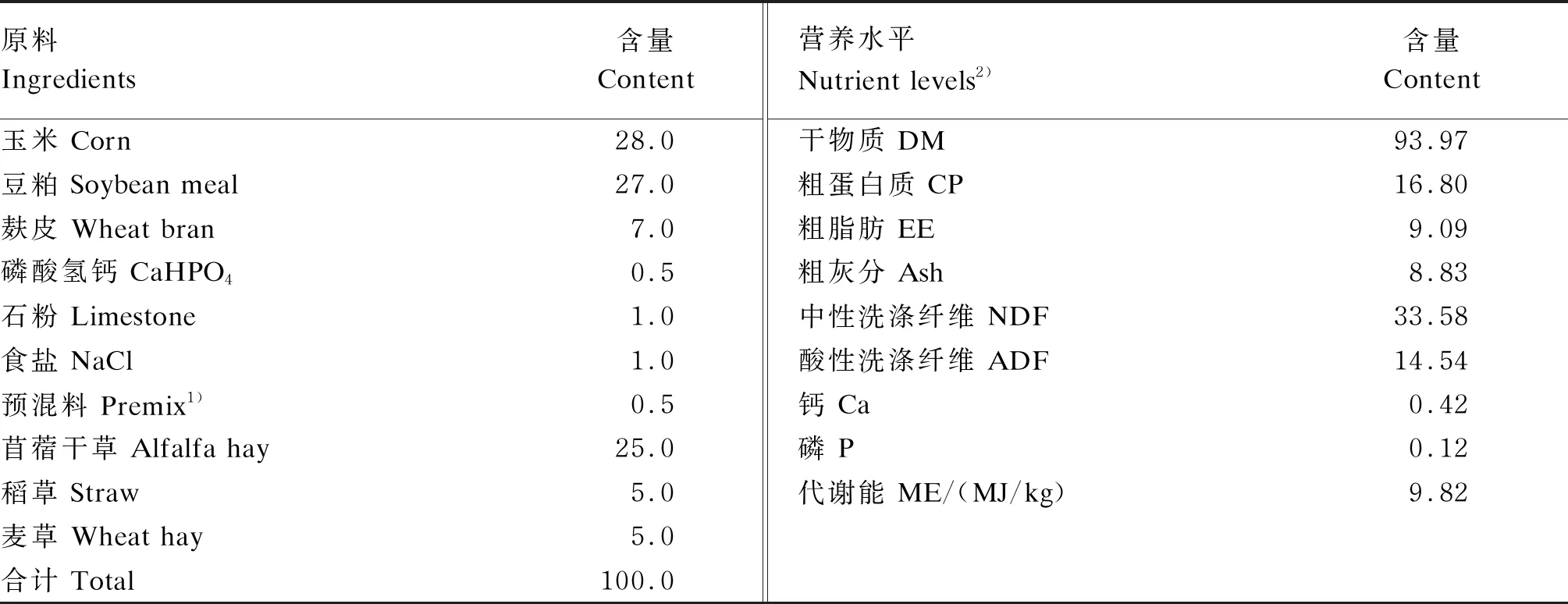
表1 基础饲粮组成及营养水平(干物质基础)
1.3 样品采集与指标测定
1.3.1 生长性能
于正试期第1、15、30、45天早上空腹称重,计算平均日增重(ADG)、干物质采食量(DMI)和料重比(F/G)。
1.3.2 血清生化指标
试验结束时,每组选取6只羊,空腹颈静脉采血5 mL,血液静置2 h后用离心机3 000 r/min离心15 min,吸取上清液分装于1.5 mL离心管内,置于-20 ℃冰箱保存。血清总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿素(UREA)、总胆固醇(TC)、葡萄糖(GLU)、TG、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)、补体3(C3)、补体4(C4)、丙二醛(MDA)含量和超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)活性及总抗氧化能力(T-AOC)采用比色法分析,血清白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、干扰素-γ(IFN-γ)含量采用酶联免疫吸附测定法分析,所有血清生化指标均委托北京华英生物技术研究所进行测定。
1.4 数据统计分析
采用SPSS 19.0统计软件对试验数据进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较分析,结果以“平均值±标准差”表示,P>0.05表示差异不显著,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 盐角草提取物对绵羊生长性能的影响
如表2所示,各组之间第1、15、30、45天体重差异不显著(P>0.05),0.4%组第45天体重最高。各组之间第1~15天、第31~45天和第1~45天平均日增重和干物质采食量差异不显著(P>0.05)。0.6%组第16~30天平均日增重极显著高于对照组(P<0.01),显著高于0.2%组(P<0.05),与0.4%组差异不显著(P>0.05)。0.4%组第16~30天干物质采食量显著低于对照组和0.6%组(P<0.05),与0.2%组差异不显著(P<0.05)。对照组第1~15天料重比极显著低于0.6%组(P<0.01),与0.2%、0.4%组差异不显著(P>0.05);0.6%组第16~30天料重比显著低于对照组(P<0.05),与0.2%、0.4%组差异不显著(P>0.05);0.4%组第31~45天、第1~45天料重比显著低于对照组(P<0.05),与0.2%、0.6%组差异不显著(P>0.05)。

表2 盐角草提取物对绵羊生长性能的影响
2.2 盐角草提取物对绵羊血清生化指标的影响
2.2.1 盐角草提取物对绵羊血清蛋白质代谢指标的影响
如表3所示,各组之间血清ALB、UREA含量差异不显著(P>0.05);其中,0.6%组血清ALB含量最高,0.2%组最低;对照组血清UREA含量最高,0.6%组最低。0.6%组血清TP含量显著高于对照组(P<0.05),与0.2%、0.4%组差异不显著(P>0.05)。0.4%、0.6%组血清GLB含量极显著高于对照组(P<0.01),与0.2%组差异不显著(P>0.05);0.2%组血清GLB含量显著高于对照组(P<0.05)。

表3 盐角草提取物对绵羊血清蛋白质代谢指标的影响
2.2.2 盐角草提取物对绵羊血清能量代谢指标的影响
如表4所示,各组之间血清TC、HDL、LDL含量差异不显著(P>0.05);其中,对照组血清TC含量最高,0.4%组最低;0.6%组血清HDL含量最高,对照组最低;对照组血清LDL含量最高,0.6%组最低。0.4%组血清TG含量显著低于对照组(P<0.05),与0.2%、0.6%组差异不显著(P>0.05)。对照组血清GLU含量极显著高于0.4%、0.6%组(P<0.01),显著高于0.2%组(P<0.05),0.2%、0.4%、0.6%组之间差异不显著(P>0.05)。
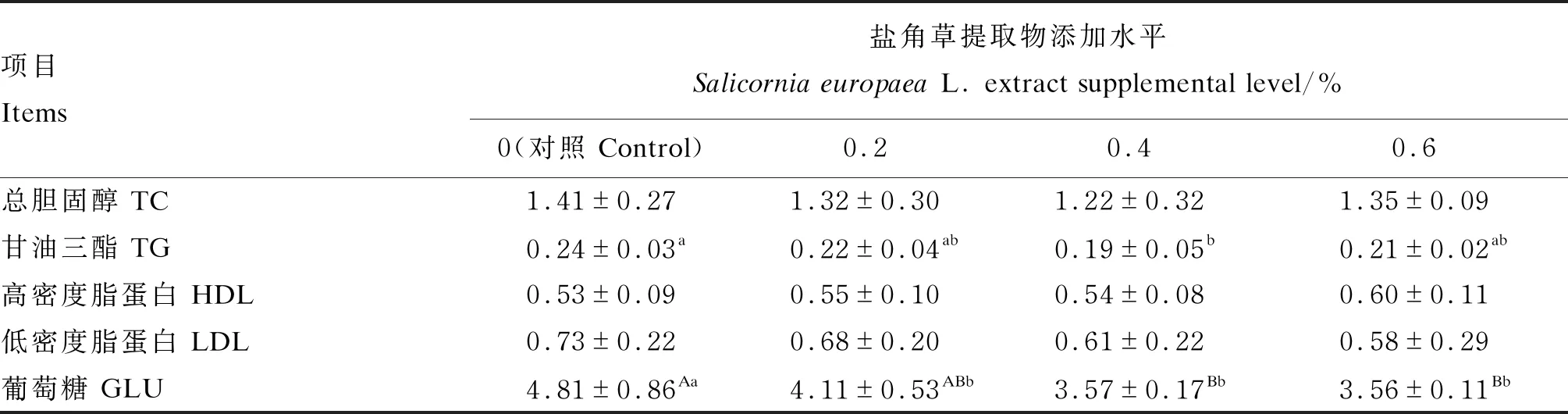
表4 盐角草提取物对绵羊血清能量代谢指标的影响
2.2.3 盐角草提取物对绵羊血清酶指标的影响
如表5所示,各组之间血清AST、ALP活性差异不显著(P>0.05);其中,0.6%组血清AST活性最高,对照组最低;对照组血清ALP活性最高,0.4%组最低。0.6%、0.4%组血清ALT活性极显著低于对照组和0.2%组(P<0.01)。0.6%组血清LDH活性极显著高于其他各组(P<0.01),其他各组之间差异不显著(P>0.05)。
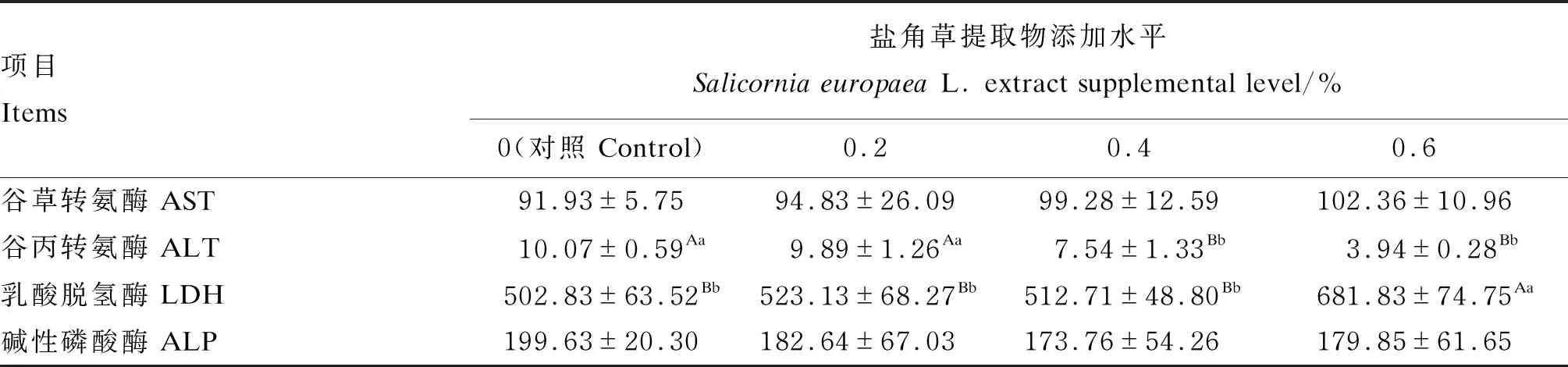
表5 盐角草提取物对绵羊血清酶指标的影响
2.2.4 盐角草提取物对绵羊血清免疫指标的影响
如表6所示,各组之间血清IgM、C3、C4含量差异不显著(P>0.05);其中,0.6%组血清IgM含量最高,0.4%组最低;0.6%组血清C3含量最高,对照组最低。0.6%组血清IgG含量极显著高于对照组(P<0.01),与0.2%、0.4%组差异不显著(P>0.05)。0.4%、0.6%组血清IgA含量极显著高于对照组和0.2%组(P<0.01)。0.4%、0.6%组血清IL-2含量极显著低于对照组和0.2%组(P<0.01),0.6%组极显著低于0.4%组(P<0.01),0.2%组显著低于对照组(P<0.05)。0.6%组血清IL-6含量极显著低于对照组和0.2%组(P<0.01),与0.4%组差异不显著(P>0.05);0.4%、0.2%组血清IL-6含量极显著低于对照组(P<0.01),0.4%组显著低于0.2%组(P<0.05)。0.6%组血清IL-10含量极显著高于对照组和0.2%组(P<0.01),与0.4%组差异不显著(P>0.05);0.2%、0.4%组血清IL-10含量极显著高于对照组(P<0.01),0.4%组极显著高于0.2%组(P<0.01)。0.4%、0.6%组血清IFN-γ含量极显著低于对照组和0.2%组(P<0.01),0.6%组显著低于0.4%组(P<0.05)。

表6 盐角草提取物对绵羊血清免疫指标的影响
2.2.5 盐角草提取物对绵羊血清抗氧化指标的影响
如表7所示,0.2%、0.4%和0.6%组血清SOD活性极显著高于对照组(P<0.01),0.2%、0.4%和0.6%组之间差异极显著(P<0.01)。0.6%组血清T-AOC极显著高于其他各组(P<0.01),0.2%、0.4%组极显著高于对照组(P<0.01)。0.4%和0.6%组血清GSH-Px活性极显著高于对照组(P<0.01);0.6%组血清GSH-Px活性显著高于0.2%组(P<0.05),与0.4%组差异不显著(P>0.05);0.2%组血清GSH-Px活性显著高于对照组(P<0.05)。0.6%组血清MDA含量极显著低于对照组和0.2%组(P<0.01),与0.4%组差异不显著(P>0.05);0.4%组血清MDA含量极显著低于对照组(P<0.01),显著低于0.2%组(P<0.05);0.2%组血清MDA含量与对照组差异不显著(P>0.05)。

表7 盐角草提取物对绵羊血清抗氧化指标的影响
3 讨 论
3.1 盐角草提取物对绵羊生长性能的影响
平均日采食量、平均日增重、料重比等均是反映反刍动物生长性能的主要指标。Sarker等[14]研究表明,饲粮中添加0.5%、1.0%盐角草粉对肉鸡的体增重、料重比均没有显著影响。Kim等[15]用酶处理获得的盐角草植物提取物饲喂大鼠,大鼠的体重指数和料重比与对照组相比无显著差异。Jiao等[13]在肉鸡饮水中添加不同水平的盐角草提取物,结果发现试验组肉鸡增重明显提高,饲料系数明显降低。Pea等[16]研究发现,饲粮中添加以干草为原料的盐角草有利于山羊羔羊的生长和提高母羊的产奶量。本试验中,饲粮中添加盐角草提取物可改善绵羊平均日增重,降低料重比,以0.4%组效果较好。
3.2 盐角草提取物对绵羊血清生化指标的影响
血清生化指标不仅与动物机体免疫功能、组织器官功能等有关,也与机体营养物质消化代谢、抗氧化能力等有密切联系,因此血清生化指标可以直接或间接反映动物的生长性能[17]。
3.2.1 盐角草提取物对绵羊血清蛋白质代谢指标的影响
血清TP由血清ALB和GLB组成,三者的含量可反映机体蛋白质的吸收和代谢状况。血清TP参与机体营养物质运输,与组织蛋白质合成等有密切联系,其含量的升高与肝脏的蛋白质合成代谢增强有关,与动物的生长发育和饲料报酬呈正相关[18-20]。血清ALB对于维持机体内代谢物质运输具有重要作用,具有维持血浆渗透压的恒定等功能[21]。血清GLB即免疫球蛋白,与机体抗病能力密切相关。Taghipour等[5]用盐角草部分替代苜蓿干草饲喂绵羊,其血清ALB含量无明显变化,这与本研究结果相似。血清UREA含量是反映动物体内蛋白质代谢和氨基酸之间的平衡状态的主要指标[22],其含量与瘤胃氨态氮含量高度相关。有研究发现,盐角草部分替代苜蓿干草后,绵羊血清UREA含量降低[5]。本试验中,各组之间血清UREA含量虽然差异不显著,但随着盐角草提取物添加水平的升高,绵羊血清UREA含量有降低的趋势。
3.2.2 盐角草提取物对绵羊血清能量代谢指标的影响
血清TC、TG、HDL和LDL含量可以反映动物机体的脂类代谢情况。血清TG为脂肪代谢的产物,一定程度上可以反映机体脂肪消化吸收状况,其含量越低,表明机体脂肪利用率越高[23]。作为载脂蛋白的HDL与LDL主要参与血液中胆固醇的运输与血脂的代谢,HDL可以将脂类由外周转运至肝脏,并将其分解代谢,故HDL被认为是有益胆固醇;LDL转运血液中的胆固醇,可以将脂类由肝脏向外周转运,故LDL被认为是有害胆固醇[24-26]。高朝煜等[27]研究表明,血清TC、TG和LDL含量的增加可以引起机体血脂异常,同时也是引起腹部肥胖的主要因素。Pichiah等[8]研究显示,草本植物是类黄铜的丰富来源,植物中的黄酮类化合物负责抗肥胖和肝脏脂质降低作用,给饲喂高脂饲粮的小鼠补充盐角草能显著影响肝脏重量、肝脏TG含量等以及关键脂质合成代谢基因的表达。在本试验中,0.2%、0.4%、0.6%组血清TC、TG和LDL含量均低于对照组,说明盐角草提取物对绵羊脂代谢方面有较好的改善作用,可能与盐角草提取物中含有的黄酮类化合物有关。
3.2.3 盐角草提取物对绵羊血清酶指标的影响
ALT常作为肝脏生理功能的重要指标,通常存在于细胞内,在血清中的活性较低,而在心脏和肝脏的活性最高[28]。当组织细胞受损时,大量的ALT逸入血液,造成血清ALT活性明显升高,因此,血清ALT活性过高则表明肝脏功能有可能受损;此外,ALT还参与了肝脏、肾脏等组织中进行的联合脱氨基作用,在非必需氨基酸和蛋白质的分解过程中,起着重要的中介作用[29-30]。LDH是主要参与细胞液中糖酵解的一种酶,参与机体内部能量代谢,不仅可作为诊断应激的一种指标,也与动物机体的生长发育有关[31-32]。ALP是消化代谢的相关酶,其活性与动物生长性能呈正相关。刘明丽[33]研究发现,血清ALP活性可以在一定程度上预测驴的骨骼发育状况。本试验中,饲粮中添加0.6%的盐角草提取物可极显著降低血清ALT活性,极显著提高血清LDH活性,说明添加盐角草提取物对绵羊肝脏的正常生理及机体代谢并未造成不良影响。
3.2.4 盐角草提取物对绵羊血清免疫指标的影响
动物机体在受到抗原刺激后由浆细胞产生的免疫球蛋白,可与抗原发生特异性结合。免疫球蛋含量升高与机体免疫能力增强有关,免疫球蛋含量下降与机体免疫能力抑制有关[34-36]。有研究显示,IgG具有激活补体、中和毒素的作用;动物感染初期首先产生的IgM具有溶解消除病原体的作用;IgA是阻碍病原体入侵动物机体的第1道防线,具有阻止微生物在呼吸道上皮附着、抑制病毒增殖等作用[37-39]。本试验中,饲粮中添加盐角草提取物可在不同程度地提高绵羊血清IgA和IgG含量,提高绵羊机体免疫性能。
细胞因子是由免疫细胞和某些非免疫细胞经刺激诱导而合成、分泌的活性因子,可以作为细胞间的信号传递分子并调节炎症反应[40]。由多种细胞产生并作用于多种细胞的细胞因子——白细胞介素,在机体炎症反应中起着非常重要的作用[41-43]。本试验中,随着饲粮中盐角草提取物添加水平的升高,绵羊血清中促炎因子IL-2、IL-6含量降低,抗炎因子IL-10含量升高,表明盐角草提取物可能通过影响绵羊细胞因子调控机体免疫系统,提高绵羊机体的免疫机能,这或许与盐角草提取物中富含酚类、生物碱等营养素有关。
3.2.5 盐角草提取物对绵羊血清抗氧化指标的影响
在正常生理条件下,动物机体自由基类高活性分子的生成和清除维持在稳态水平。当自由基的生成超过机体的清除能力时,容易造成炎症细胞的浸润,并产生大量氧化中间产物,发生氧化还原平衡的紊乱[44-45]。机体主要的抗氧化酶SOD能够清除体内的超氧阴离子,其含量的变化能比较准确地反映机体内的抗氧化系统的情况。T-AOC是衡量机体抗氧化系统功能状况的综合性指标,是体内酶性和非酶性抗氧化物的总体水平。GSH-Px可特异催化谷胱甘肽(GSH)对脂质过氧化物的还原反应;MDA是脂质过氧化最终产物之一,能引起细胞代谢及功能的障碍,其含量越低说明机体抗氧化效果越好[46-47]。Rhee等[48]研究发现几种盐角草属植物均有抗氧化活性,包括盐角草、印度海蓬子等,并且这几种盐生植物均含有酚类化合物。Zheng等[49]研究发现,茶多酚可通过多种机制获得抗氧化能力。Zhang等[9]研究发现,给SD大鼠饲喂盐角草提取物,可使大鼠血清SOD活性升高,血清MDA含量降低。Kim等[10]研究显示,盐角草提取物作为一种食盐替代品,可提高机体抗氧化能力,防止高盐摄入对肾脏和肝脏造成的损害,有效避免高血压的发生。本试验中,随着盐角草提取物添加水平的升高,绵羊血清SOD、GSH-Px活性和T-AOC升高,而血清MDA含量降低,说明添加盐角草提取物可提高绵羊机体抗氧化能力,这可能与盐角草提取物富含酚类等营养成分有关。
4 结 论
在本试验条件下,饲粮中添加盐角草提取物有助于改善绵羊生长速度,降低料重比,提高机体免疫性能和抗氧化能力,以饲粮中添加0.4%的盐角草提取物效果较好。

